不同丙酸盐/乙酸盐比对单级好氧生物除磷的影响
2011-10-20李小明王冬波曾光明湖南大学环境科学与工程学院环境生物与控制教育部重点实验室湖南长沙410082
常 克,李小明,王冬波,杨 麒,曾光明 (湖南大学环境科学与工程学院,环境生物与控制教育部重点实验室,湖南 长沙 410082)
不同丙酸盐/乙酸盐比对单级好氧生物除磷的影响
常 克,李小明*,王冬波,杨 麒,曾光明 (湖南大学环境科学与工程学院,环境生物与控制教育部重点实验室,湖南 长沙 410082)
在 2个序批式反应器(R1、R2)中,采用合成废水,研究了废水中常见的两种挥发性脂肪酸(VFAs)盐-丙酸盐和乙酸盐-的不同浓度比值(R1:丙酸盐/乙酸盐=0.165;R2:丙酸盐/乙酸盐=2.00)对于单级好氧生物除磷的影响.结果表明,经过 30d的驯化后,R2的除磷效果要优于R1,R1和 R2的平均去除率分别为 77.95%和 84.79%.但是,R1中单位微生物的除磷性能要好于 R2,R1单位微生物磷平均去除量为8.66mg/g,R2为8.03mg/g.静置期,R1和R2中均有明显的释磷现象,但R2释磷量大于R1,单位微生物的释磷量也大于R1,可能的原因是R1中尚有部分糖原在静置期分解供能,而R2中全为聚磷分解供能.
SBR;单级好氧;丙酸钠;乙酸钠;生物除磷
磷是生物的重要营养源,水体中磷含量过多会导致水体富营养化,从而使水质恶化[1].因此,水中磷的去除起着至关重要的作用.传统的生物除磷工艺(A/O)主要通过聚磷菌在厌氧条件下,水解细胞原生质中聚合磷酸盐(poly-P)释放磷,在有氧的条件下过量摄取磷,并排除富磷污泥的途径达到除磷的目的.Li等[2]研究发现,在低溶解氧的条件下,生物除磷的效率随着污水中丙酸盐对乙酸盐浓度比值的增大而升高.Chen等[3]研究表明,在溶解氧浓度较高的情况下,当进水丙酸盐对乙酸盐浓度比值由0.16增大到2.06时,系统除磷效率由 76.9%升至 87.3%.金大勇等[4]研究发现,当进水丙酸盐对乙酸盐浓度比值由 0.16增大至2.06时,一个典型周期内磷的吸收和释放比例由1.29升至1.36.由此可见,进水丙酸盐/乙酸盐比值不同会导致A/O工艺除磷性能的显著改变.
本研究小组在前期工作[5]中发现,在葡萄糖作为单一碳源的情况下,SBR工艺进水直接曝气而不经过厌氧段仍能达到较好的除磷效果.有研究表明[6],碳源是影响单级好氧生物除磷效率的重要因素之一.丙酸盐和乙酸盐是实际废水中最常见的两种有机物[7],两者之和占到实际废水中VFA的 90%左右[8].现阶段大多关于单级好氧生物除磷工艺的研究采用的是乙酸盐或葡萄糖作为有机碳源[6,9-10,16],目前还没有研究涉及丙酸盐或其与乙酸盐的混合物对于单级好氧生物除磷工艺的影响.而Wang等[11]研究发现,单级好氧工艺除磷过程中的能量代谢途径与 A/O工艺完全不同.因此,当碳源是丙酸盐和乙酸盐的混合物时,不同丙酸盐/乙酸盐比值对该工艺除磷效果的影响是否和对A/O工艺一样还有待研究.为此,作者研究不同丙酸盐/乙酸盐比值对SBR单级好氧生物除磷效果的影响,并探讨了其中可能的原因.
1 材料与方法
1.1 实验装置及运行方法
实验在两个相同的 SBR反应器(分别称为R1、R2)中进行,SBR反应器为圆柱体,采用有机玻璃制作,直径为 12cm,高约 100cm,有效体积约为 12L.实验运行方式如下:瞬间进水→曝气(4h)→沉淀出水(0.5h)→闲置(7.5h),不设置厌氧段.好氧采用鼓风曝气,曝气开始时DO浓度约为6mg/L,两反应器污泥停留时间(SRT)均控制在11d左右.接种的活性污泥取自长沙市第二污水处理厂,最初反应器中接种活性污泥浓度约为4000mg/L,按上述方式进行驯化培养,约15d后污泥呈黄褐色,活性以及沉淀效果较好,第30d开始试运行.
1.2 污水水质
进水采用合成废水,R1、R2中进水有机碳源为不同比例的乙酸钠和丙酸钠混合物,但 2个反应器中保持碳元素的投加量相等(约10mmol/L).R1中进水丙酸钠对乙酸钠的浓度比值为 0.165,R2中进水丙酸钠对乙酸钠的浓度比值为 2.00.除了有机碳源之外,2个反应器其他进水成分及浓度相同:磷酸盐 25mg/L;氯化铵40mg/L;硫酸镁 5mg/L;氯化钙 5mg/L;微量元素0.6mL,微量元素的主要成分以及浓度见文献[12].
1.3 分析方法
总磷(TP)采用钼锑抗分光光度法[13]测定;混合液悬浮固体(MLSS)与混合液挥发性悬浮固体(MLVSS)采用重量法[13]测定;COD采用重铬酸钾法[13]测定;糖原质(Glycogen)采用苯酚-硫酸法[11]测定.聚羟基脂肪酸酯(PHA)采用气相色谱法[14-15]测定.
2 结果与讨论
2.1 R1、R2长期运行中磷去除情况
R1,R2反应器长期运行过程中,进出水每2d取1次样,水样过滤后用于磷含量的测定.反应器中的污泥经过 30d的驯化,除磷效果已经基本稳定.2个反应器的除磷效果见图1.

图1 R1、R2长期运行中TP去除情况Fig.1 Removal of TP in R1 and R2 during long-term operation
由图1可以看出,在1~100d内,2个反应器进水磷浓度均为25mg/L左右.在30~100d内,R2较R1有更高的除磷效率,R2的最大磷去除率为86.58%,最小去除率为 82.86%,平均去除率为84.79%;R1的最大磷去除率为79.96%,最小去除率为75.40%,平均去除率为77.95%.
Chen等[3]研究表明,在传统A/O工艺条件下,进水COD约为480mg/L,进水磷浓度为7.75mg/L时,采用本实验中两种丙酸盐/乙酸盐浓度比值时磷的去除率分别为 76.9%和 87.3%,丙酸盐比例高的反应器中磷去除率也高.金大勇等[4]的研究也得出类似的结论.通常认为,COD/P的比值越高,磷的去除率也越高.但是,对比2种工艺的数据可以看出,当碳源采用相同的丙酸盐/乙酸盐浓度比值时,传统A/O工艺在COD/P约为62的情况下的磷去除率和单级好氧工艺在 COD/P约为13~14的情况下磷去除率相差不大.由此可知,当其他条件相同时,采用同样的丙酸盐/乙酸盐浓度比值,单级好氧工艺在实验室的磷去除率要优于传统A/O工艺.R1与R2稳定运行期间的MLSS以及MLVSS变化如表1所示.
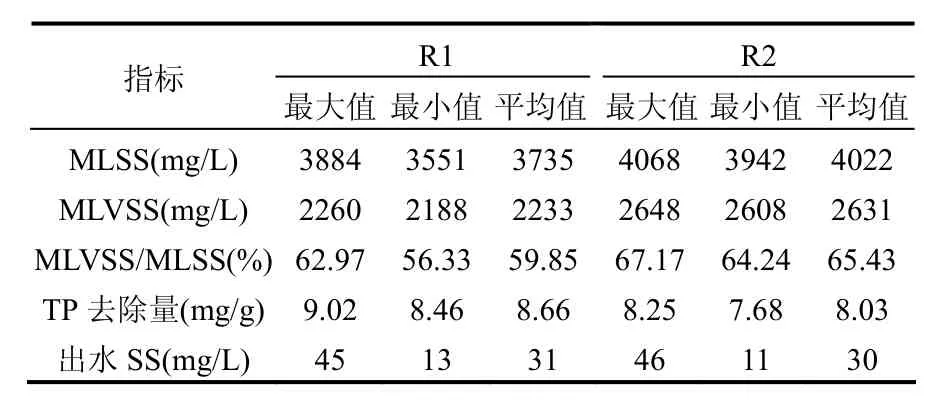
表1 R1和R2长期运行中MLSS、MLVSS变化Table 1 Changes of MLSS and MLVSS in R1 and R2 during steady-state operation
由表1可以看出,R2中的MLSS及MLVSS均高于 R1,同时 MLVSS/MLSS数值也高于 R1.由 Oehmen等[16]的研究结果可知,较高的MLVSS/MLSS说明 R2中微生物体内合成的聚磷更少.这与R2单位MLVSS的磷去除量平均值低于R1相吻合,R2中单位MLVSS的磷去除量平均值为8.03mg/g,R1中为8.66mg/g.由此可见,虽然R2系统的整体除磷效率高于R1,但R1中单位微生物的除磷性能却要略好于 R2.另外,出水SS也是除磷效率的影响因素之一.在本研究中,出水基本清澈,出水SS见表1.R1和R2中出水SS平均值相差不多,因此在本研究中忽略出水SS对除磷效率的影响.
2.2 典型周期内TP、COD、糖原质和PHA的变化
糖原质和PHA已经被证明在聚磷微生物的代谢过程中充当能量储存与供给的物质[17].单级好氧工艺中,以乙酸盐作为碳源时生物除磷所需要的能量主要来自PHA的分解[6].本研究采用乙酸盐和丙酸盐的混合碳源,为进一步探讨 R2具有较高除磷性能的原因,分析了典型周期内TP、COD、糖原质和PHA的变化.
丁艳等[18]研究发现,pH值会影响单级好氧生物除磷的效果.因此,为了排除 pH值是本实验中影响除磷性能的重要因素的可能性,分析了反应器典型周期内pH值的变化,结果见图2.
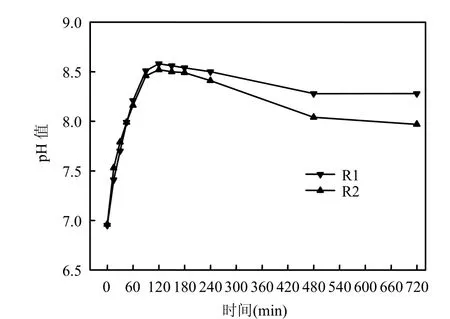
图2 R1、R2典型周期内pH值的变化Fig.2 Variations of pH during one typical cycle in R1 and R2
由图2可知,R1中起始pH值为6.96,R2为6.95.在开始曝气的120min内2个反应器内的pH值均迅速由7.0左右升高至8.5左右,这是由于曝气吹脱了CO2而引起的[19].随后2个反应器中pH值缓慢下降,并最终稳定在 8.1左右.整个典型周期过程中,2个反应器 pH值不存在很大的差别,因此不考虑pH值对于生物除磷性能的影响.
R1、R2典型周期内 TP、COD、糖原质和PHA的变化见图3和图4.由图3可知,R1中外碳源在曝气开始后 60min内大部分被消耗掉,而 2种常见的微生物体内储能物质PHA和糖原质则大量积累.PHA的积累在45min左右达到最大值(4.1mmol/g),随后迅速下降,并在 120min左右降到曝气开始时的水平.而在PHA浓度开始下降时,糖原质却继续积累,并在90min左右达到最大值(3.87mmol/g),之后逐渐降低.由此可见,R1中虽然糖原和PHA均有明显的积累,但是主要的储能物质是 PHA.这与王冬波等[6]在单级好氧工艺中观察到的储能物质积累的现象相似.外碳源消耗完之后,微生物生长和摄取污水中磷酸盐所需的能量主要来自体内储能物质的分解.因此,伴随着PHA和糖原质浓度的下降,R1中TP浓度也迅速降低,在好氧阶段结束时降至 5.13mg/L.在静置期,R1中有明显的释磷现象,释磷量为3.84mg/L.糖原质在静置期结束时恢复到曝气开始时水平,PHA则无明显变化.
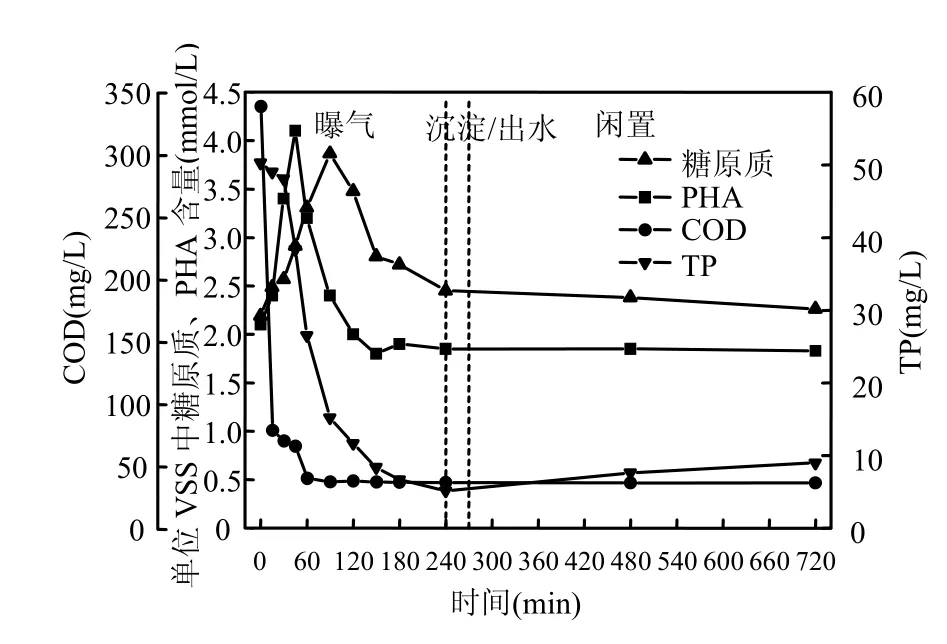
图3 R1典型周期内TP、COD、糖原质与PHA的变化Fig.3 Variations of TP, COD and glycogen as well as sludge PHA during a typical cycle in R1
由图4可知,与R1不同的是,R2中外碳源在曝气开始后30min大部分被消耗掉.和R1一样,外碳源被分解消耗的过程中,PHA和糖原质大量积累.
不同的是,R2中微生物体内PHA的积累量高于R1(R1中为2.00mmol/g,R2中为2.4mmol/g),但是糖原的积累量低于R1(R1中为1.68mmol/g,R2中为 1.27mmol/g).这与姚樱等[20]在传统 A/O工艺中观察到的现象相似.伴随着微生物体内储能物质的分解,TP的浓度也逐渐降低,好氧结束时降至 3.88mg/L(低于 R1的出水磷浓度,R1为5.13mg/L),PHA和糖原在好氧结束时都降至曝气开始时水平.静置期 R2也有明显的释磷现象,释磷量为8.72mg/L,高于R1.R2中PHA和糖原在静置期均无明显变化.
综上所述,R1与 R2在好氧段均有明显摄磷,PHA和糖原的积累和降解;静置期也都有明显的释磷现象.不同的是 R2中好氧段摄磷量高于R1,静置期释磷量也高于R1;R2中PHA和糖原在静置期均无明显变化,这与R1不同(R1糖原含量在静置期有少量下降).
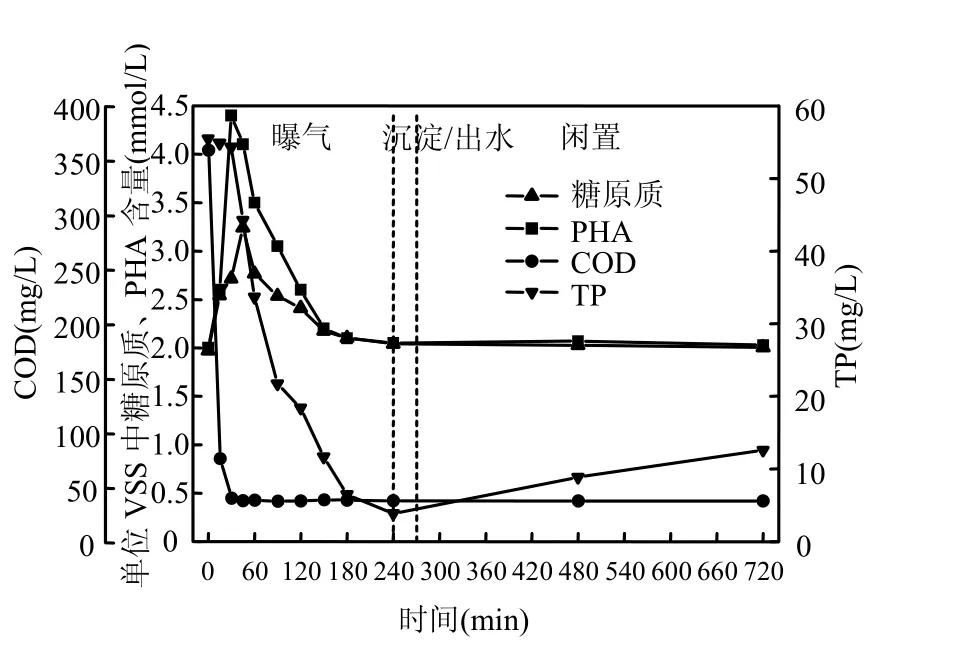
图4 R2典型周期内TP、COD、糖原质与PHA的变化Fig.4 Variations of TP, COD and glycogen as well as sludge PHA during a typical cycle in R2
2.3 讨论
在好氧阶段,根据微生物摄取污水中的磷所需能量来源的不同可以分为 2个阶段.即外碳源阶段和内碳源阶段.因此,要探讨单级好氧工艺在不同丙酸盐/乙酸盐浓度比值下具有不同的除磷性能以及不同的MLSS和MLVSS的原因,可以从外碳源和内碳源两个阶段入手.
外碳源阶段是指好氧前期外碳源还未完全消耗的阶段.在微生物的好氧呼吸过程中,乙酸钠和丙酸钠有着不同的好氧代谢途径.1mol乙酸钠消耗1mol腺嘌呤核苷三磷酸(ATP)生成1mol乙酰辅酶 A,然后通过三羧酸(TCA)循环和乙醛酸循环氧化分解.1mol丙酸钠首先消耗2molATP经过β-氧化生成1mol乙酰辅酶A和0.33mol丙酰辅酶A,产生5molATP.然后乙酰辅酶A通过TCA循环和乙醛酸循环 2条途径被氧化分解,而丙酰辅酶A在经过3步酶促反应之后生成琥珀酰辅酶A,琥珀酰辅酶A再通过TCA循环被完全氧化分解.由此可见,单位丙酸钠氧化分解产生的能量高于乙酸钠.由于 R2中外碳源的丙酸钠比例较高,因此R2中外碳源氧化分解产生的ATP较多.外碳源氧化分解产生的ATP主要用于微生物维持自身代谢,从污水中摄取磷以及合成微生物体内储能物质.外碳源迅速氧化分解时R1中TP去除量为2.18mg/L,R2中为 1.14mg/L,说明用于摄磷的ATP量R1多于R2.从图3和图4中可以看出,两反应器中单位微生物合成体内储能物质的量几乎相同,说明合成过程中消耗的ATP量也基本相同.因此,R2中微生物用于维持自身生长的ATP的量多于R1,这也解释了R2中MLVSS高于R1的原因.
当外碳源消耗完之后,进入内碳源阶段.由于实验中外碳源很快被消耗并转化为内碳源,因此可以推断,好氧阶段的磷吸收主要是利用内碳源进行的.本研究中当丙酸钠/乙酸钠比值由 0.165升至 2.00时,平均除磷效率由 77.95%升至84.79%,R2的除磷效率高于 R1,但 R1中微生物具有更好的除磷性能(单位微生物TP去除量高).有研究表明[21-22],微生物体内内碳源在好氧条件下通过TCA循环和氧化磷酸化,被氧化成二氧化碳和水,并产生大量ATP.而且,碳含量相同的不同内碳源(PHA和糖原等)通过此过程产生的 ATP几乎相等.从图3和图4中可以看出,在内碳源阶段,R1和R2中PHA优先于糖原分解,这是由于PHA是好氧条件下最容易被微生物利用的细胞内储能物质[23].而R2中PHA的积累量高于R1,糖原的积累量低于R1,这可能是因为当丙酸钠浓度高时,PHA组分中的PH2MV和PH2MB的合成量有较大的增加[20].R1中微生物消耗的体内储能物质(即内碳源)的量为 3.67mmol/g,高于R2(3.55mmol/g).因此,内碳源阶段 R1中微生物体内储能物质分解产生的 ATP多于 R2,这部分ATP主要用于微生物维持自身生长以及摄取污水中的磷,而 R1中微生物用于维持自身生长所需的能量少于R2.所以,R1中微生物用于摄取污水中磷的能量高于R2,导致R1中单位微生物除磷性能好.另外,Lin等[24]研究表明,丙酸盐为单一碳源时,合成的PHA中以PHV居多;乙酸盐为单一碳源时,合成的 PHA中以 PHB居多.因此,R2中PHA以PHV为主,R1中以PHB为主.刘燕等[25]研究表明,磷的吸收主要受PHB影响,R1中PHB含量较多,这可能也是 R1单位微生物除磷性能好的原因之一.
R1、R2好氧阶段结束时,外碳源全部被氧化分解.R2中体内储能物质也都恢复到曝气开始时水平,由此可以推断静置期维持微生物生命和代谢所需要的能量主要来自微生物体内聚磷的水解.而 R1中体内储能物质尚未完全氧化分解到原始水平,在进入静置期之后尚有少量被氧化分解.Lu等[23]研究表明,聚磷和糖原质同时存在时,微生物倾向于先分解糖原质来维持自身生命和代谢.R1中曝气结束时糖原质水平相比原始水平仍较高(比起始浓度高 0.26mmol/g),因此在静置期,首先是糖原质的分解提供微生物维持自己生命所需的能量,直到糖原质的水平降到比较低的水平之后(约为起始浓度),聚磷才开始分解.这可能是导致R2中释磷量大于R1的原因.静置期R1中单位微生物的释磷量为 0.0017mg/g,低于 R2的 0.0033mg/g,而好氧阶段 R1中单位微生物的磷去除量却高于R2.除了上面提到的R1中糖原在静置期分解供能优先于聚磷水解外,单级好氧工艺中微生物不同于传统 A/O工艺的能量代谢途径可能也是导致这一现象的原因之一.由于R2在静置期释磷量高于 R1,因此水中 H2PO4-离子较多.因为H2PO4-离子的电离趋势大于水解趋势,产生的H+增多,从而解释了R2中的静置期pH值略低于R1的现象.
综上所述,本研究中由于R1、R2中丙酸钠/乙酸钠比例不同,致使微生物分解外碳源产生的ATP不同以及合成的内碳源比例不同,从而用于摄取水中磷的ATP也不同,导致R1与R2中微生物不同的除磷性能.由于用于维持微生物自身生命的ATP不同,也导致了MLVSS的不同.综合这些因素,R2中整体的除磷效果要好于R1,但是R1中单位微生物的除磷性能更强.
3 结论
3.1 SBR单级好氧工艺在丙酸钠/乙酸钠为0.165和 2.00时均有较好的除磷效果,在稳定运行期间,丙酸钠/乙酸钠为0.165的TP平均去除率为77.95%,丙酸钠/乙酸钠为2.00的TP平均去除率为 84.79%,可见,不同的丙酸钠/乙酸钠对单级好氧工艺有一定的影响.
3.2 丙酸钠/乙酸钠为0.165的单位微生物除磷性能高于丙酸钠/乙酸钠为 2.00,丙酸钠/乙酸钠为0.165时磷平均去除量为8.66mg/g,丙酸钠/乙酸钠为2.00时磷平均去除量为8.03mg/g,其主要原因是丙酸钠和乙酸钠的好氧分解途径不同产生的ATP不同以及合成的内碳源比例不同,并且用于摄磷的ATP也不相同.
[1] Helen P Jarvie, Colin Neal, Paul J A Withers. Sewage-effluent phosphorus: A greater risk to river eutrophication than agricultural phosphorus? [J]. Science of the Total Environment,2006,360(1-3):246-253.
[2] Li Hongjing, Chen Yinguang, Gu Guowei. The effect of propionic to acetic acid ratio on anaerobic-aerobic(low dissolved oxygen)biological phosphorus and nitrogen removal [J]. Bioresource Technology, 2008,99(10):4400-4407.
[3] Chen Yinguang, Randall Andrew A, McCue Terrence. The efficiency of enhanced biological phosphorus removal from real wastewater affected by different ratios of acetic to propionic acid[J]. Water Research, 2004,38(1):27-36.
[4] 金大勇,刘建勇,顾国维.两种挥发性有机酸的浓度比值对生物除磷的影响 [J]. 中国环境科学, 2005,25(2):249-251.
[5] 王冬波,李小明,曾光明,等.内循环SBR反应器无厌氧段实现同步脱氮除磷 [J]. 环境科学, 2007,28(3):534-539.
[6] 王冬波,李小明,杨 麒,等.碳源对SBR单级好氧工艺中微生物摄磷能力的影响及其机理研究 [J]. 中国科学(B辑:化学),2009,39(6):560-568.
[7] Shah R R. Study of the performance of biological nutrient removal systems with and without prefermenters [D]. Orlando,Florida: University of Central Florida, 2001.
[8] 艾海男.废水COD组分S_S、X_S和S_A的表征方法及其应用[D]. 重庆:重庆大学, 2009.
[9] 王冬波,李小明,杨 麒,等.SBR无厌氧段实现生物除磷 [J]. 环境科学, 2008,29(7):1867-1873.
[10] Wang D, Li X, Yang Q, et al. Biological phosphorus removal in sequencing batch reactor with single-stage oxic process [J].Bioresour. Technol., 2008,99:5466-5473.
[11] Wang Dong-bo, Li Xiao-ming, Yang Qi, et al. The probable metabolic relation between phosphate uptake and energy storages formations under single-stage oxic condition [J]. Bioresour.Technol., 2009,100:4005-4011.
[12] Smolders G J F, van derMeij J, van Loosdrecht M C M, et al.Stoichiometric model of the aerobic metabolism of the biological phosphorus removal process [J]. Biotech. Bioeng., 1994b,44:837-848.
[13] 国家环境保护局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002.
[14] Takabatake H, Satoh H, Mino T, et al. PHA(polyhydroxyaikanoate) production potential of activated sludge treating wastewater [J]. Wat. Sci. Tech., 2002,45:119-126.
[15] Oehmen A, Keller-Lehmann B, Zeng R J, et al. Optimisation of poly-β-hydroxyalkanoate analysis using gas chromatography for enhanced biological phosphorus removal systems [J]. J.Chromatography A, 2005,1070:131-136.
[16] Oehmen Adrian, Vives M Teresa, Lu Huabing, et al. The effect of pH on the competition between polyphosphate-accumulating organisms and glycogen-accumulating organisms [J]. Water Res.,2005,39:3727-3737.
[17] Janssen P M J, Meinema K, van der Roest H F. 生物除磷设计与运行手册 [M]. 祝贵兵,彭永臻译.北京:中国建筑工业出版社,2005.
[18] 丁 艳,王冬波,李小明,等.pH值对SBR单级好氧生物除磷的影响 [J]. 中国环境科学, 2010,30(3):333-338.
[19] 曾 薇,彭永臻,王淑莹,等.pH值与温度对SBR法反应时间控制的影响 [J]. 中国环境科学, 2002,22(5):456-459.
[20] 姚 樱,陈银广,马 民,等.不同丙酸/乙酸对聚糖菌长/短期代谢的影响 [J]. 环境科学, 2002,28(9):1970-1974.
[21] 周群英,高廷耀.环境工程微生物学 [M]. 北京:高等教育出版社, 2000.
[22] 王镜岩,朱圣庚,徐长发.生物化学 [M]. 北京:高等教育出版社,2002.
[23] Lu H, Keller J, Yuan Z. Endogenous metabolism of Candidatus Accumulibacter phosphatis under various starvation conditions [J].Water Res., 2007,41:4646-4656.
[24] Lin Dong-en, Zhang Yi-wei, Sun Dong-cheng, et al.Polyhydroxyalkanoates of different structure synthesized by activated sludge with acetate and propionate as sole carbon source[J]. Acta Scientiarum Naturalium University Sunyatseni,2003,42:118-121.
[25] 刘 燕,行智强,陈银广,等.聚烃基烷酸转化对强化生物除磷影响研究 [J]. 环境科学, 2006,27(6):1103-1106.
Effect of different ratios of propionate to acetate on phosphorus removal in sequencing batch reactor with single-stage oxic process.
CHANG Ke, LI Xiao-ming*, WANG Dong-bo, YANG Qi, ZENG Guang-ming (Key Laboratory of Environmental Biology and Pollution Control, Ministry of Education, College of Environmental Science and Engineering, Hunan University, Changsha 410082, China). China Environmental Science, 2011,31(3):371~376
To investigate the effect of different concentration ratios of propionate to acetate on phosphorus removal in single-stage oxic process, two lab-scale sequencing batch reactors (SBRs) were operated (R1: propionate to acetate ratio=0.165; R2: propionate to acetate ratio=2.00) using synthetic wastewater. After a period of sludge acclimation (30d),R2 showed a higher SOP removal efficiency than R1. The average efficiency of phosphorus removal in R1 and R2 were 77.95% and 84.79% respectively. However, the phosphorus removal amount per MLVSS in R1 was higher than R2. The phosphorus removal amount per MLVSS in R1 was 8.66mg/g while in R2 was 8.03mg/g. In the idle phase, though obvious phosphorus release was observed in both R1 and R2, the content of phosphorus released in R2 was higher than that in R1. The phosphorus release amount per MLVSS of R2 was higher than R1. Besides, glycogen in R1 degraded obviously while that in R2 seldom degraded, which maybe the reason why the phosphorus release amount per MLVSS of R2 was higher than R1.
sequencing batch reactor (SBR);single-stage oxic process;sodium propionate;sodium acetate;biological phosphorus removal
X703.1
A
1000-6923(2011)03-0371-06
2010-08-13
国家自然科学基金资助项目(51078128)
* 责任作者, 教授, xmli@hnu.cn
常 克(1986-),男,浙江杭州人,湖南大学硕士研究生,主要研究方向为水污染控制.
