酵母甘露聚糖处理对李果实褐腐病及贮藏特性的影响
2011-10-13孙晓婷曹建康龙柳燕
孙晓婷,曹建康*,陈 妮,龙柳燕,杨 雪
(中国农业大学食品科学与营养工程学院,北京 100083)
酵母甘露聚糖处理对李果实褐腐病及贮藏特性的影响
孙晓婷,曹建康*,陈 妮,龙柳燕,杨 雪
(中国农业大学食品科学与营养工程学院,北京 100083)
研究酵母甘露聚糖对李褐腐菌(Monilinia fructicola)菌丝生长的影响及对李果实褐腐病的抑制作用。离体抑菌试验表明5、25、50、100g/L的甘露聚糖对李褐腐菌菌丝生长均有抑制作用,且质量浓度越高抑制效果越好。抑菌试验表明,甘露聚糖浸泡处理能有效抑制处理前/处理后损伤接菌的李果实褐腐病病斑扩展。酵母甘露聚糖处理还有效地降低了贮藏期间李果实的质量损失率和呼吸强度,推迟果实转色,从而维持李果实良好的贮藏品质。
甘露聚糖;李果实;褐腐病;贮藏特性
李果实成熟于夏季高温季节,采后极易受到病原菌的侵染而发生严重腐烂、造成巨大的损失[1-2]。其中,由Moniliniaspp.侵染引起的褐腐病是李果实在贮藏期间发生的主要病害,是导致果实腐烂损失的主要因素[3-4]。目前,利用1-甲基环丙烯(1-methylcyclopropene,1-MCP)处理[1]、壳聚糖处理[2]、拮抗菌生物防治[3]、热水处理[4]、低温贮藏[5]、气调保鲜[6]、浸钙处理[7]以及化学杀菌剂处理等方法防治李果实病害和保持果实采后品质。但是,对李果实褐腐病控制技术的研究尚不够深入。
甘露聚糖是一种细胞壁多糖,是果实等植物体细胞壁半纤维素的重要构成成分。因其侧链的不同,甘露聚糖分别以半乳甘露聚糖、半乳葡萄甘露聚糖等形式存在[8-9]。研究表明,果实的后熟软化与甘露聚糖的裂解有关[8-10]。但是,关于甘露聚糖处理对果实贮藏特性的影响却未见报道。
利用生物来源的天然产物进行果实采后病害防治已经得到越来越多的重视[11]。近年来的研究表明,一些多聚糖如壳聚糖[1-2,12]、葡甘聚糖[13]等具有较强的抑制微生物生长繁殖的作用,可用作食品被膜材料和果蔬保鲜剂应用。酵母甘露聚糖存在于酵母细胞壁的最外层,占细胞壁干重的40%左右,容易制备获得[14-15]。酵母甘露聚糖能增加动物体液免疫和细胞免疫能力,调节肠道菌群平衡,结合吸附外源性病原菌,并具有抗辐射、抗氧化、抗肿瘤等活性功能[14-15]。但是,还未见到将酵母甘露聚糖用于食品保藏和水果保鲜的报道。因此,本实验拟研究酵母甘露聚糖对李果实褐腐病的控制及贮藏特性的影响。
1 材料与方法
1.1 材料与试剂
李果实(Prunus salicinaL. cv. Gaixian)于2009年7月18日采自辽宁省营口市盖县果园,采后当天运回实验室,挑选表面光滑、大小均匀、成熟度一致、无机械损伤和病虫害的绿熟果实进行随机分组;褐腐菌(Monilinia fructicola)分离自典型发病果实,于27℃在马铃薯葡萄糖琼脂培养基(PDA)上培养10d,在无菌条件下,用无菌水配制成孢子悬浮液(1×105个孢子/mL)。
酵母甘露聚糖 安琪酵母股份有限公司,溶于蒸馏水中,分别配制成0(对照)、1、5、10g/L溶液待用。
1.2 仪器与设备
GC7890F气相色谱仪[配有CO2转化炉、flame ionization detector(FID)检测器、不锈钢填充柱(Porapak 80-100,2m×2mm)] 上海天美科技有限公司;SPX-250BZ生化培养箱 上海博讯实业有限公司医疗设备厂;SWCJ-ZFD超净工作台 苏州净化设备有限公司;手提式不锈钢蒸汽消毒器 上海三申医疗器械有限公司。
1.3 方法
1.3.1 甘露聚糖体外抑菌试验[12]
制备含有不同质量浓度(0、5、25、50、100g/L)甘露聚糖的平皿培养基。在培养皿中央接种27℃条件下生长6d的褐腐菌菌饼(直径为6mm)。将平皿置于27℃恒温培养,定期测量菌落直径,重复3次。
1.3.2 甘露聚糖体内抑菌试验
1.3.2.1 处理后损伤接菌
分别将李果实浸没到0、1、5、10g/L的甘露聚糖溶液中,浸泡1min。取出自然晾干后置于塑料框中,并用黑色聚乙烯(PE)袋包装。24h后用灭菌接种针在果实赤道部位对应面分别刺两个孔(3mm宽×4mm深)。待伤口表面晾干,向每个孔注入10μL褐腐菌孢子悬浮液。自然晾干后于17℃(85%~95% RH)保温观察。在接菌48、72h后分别测定病斑面积。每处理30个果实。
1.3.2.2 处理前损伤接菌
李果实损伤接菌3h后再分别经0、5g/L的甘露聚糖溶液处理。处理方法、损伤接菌方法、贮藏与病斑面积的测定方法同1.3.2.1节。
1.3.3 品质测定
李果实经0、5g/L甘露聚糖处理后,于23℃(85%~95%RH)贮藏,定期测定呼吸强度、质量损失率、转色率。
1.3.3.1 呼吸强度的测定[16]
取8个果实称质量后置于经空气平衡的1.8L具橡胶塞的玻璃容器中,密闭30min后顶空取1mL气体,用气相色谱法测定CO2含量。果实呼吸强度按CO2含量以mg/(kg·h)表示。重复3次。
1.3.3.2 质量损失率的测定
取20个果实分别编号,定期测定果实质量。按式(1)计算平均质量损失率:

1.3.3.3 转色指数的测定
取20个果实进行分级,分级标准如下:0级:0%变红;1级:25%果面开始泛白转红;2级:25%~50%果面转红;3级:50%~75%果面转红;4级:75%以上果面转红。

1.3.4 数据分析
应用SPSS 11.5软件进行方差分析,利用邓肯氏多重比较对差异显著性(P≤0.05)进行分析。
2 结果与分析
2.1 甘露聚糖对褐腐菌菌丝生长的抑制作用
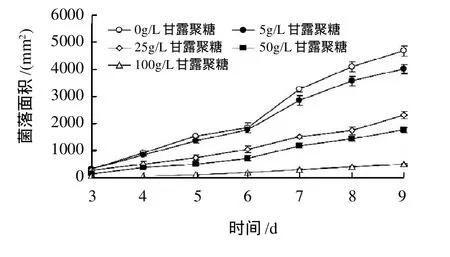
图1 甘露聚糖对离体培养的褐腐菌生长的抑制作用Fig.1 Inhibitory effect of yeast mannan on the growth ofMonilinia fructicolain PDA medium at 27 ℃
在离体培养过程中,褐腐菌菌落面积不断扩展。不同质量浓度的甘露聚糖对离体培养的褐腐菌的生长均有抑制作用(图1)。在培养第9天时,5、25、50、100g/L的甘露聚糖处理对褐腐菌生长的抑制率分别为14.3%、50.5%、61.9%、88.6%(P≤0.05)。显然,甘露聚糖对李褐腐菌生长具有较强的直接抑制作用。而且,25g/L的甘露聚糖即能抑制褐腐菌一半的生长程度。
2.2 甘露聚糖处理对李果实褐腐病的抑制作用
在经甘露聚糖处理24h后接种褐腐菌,可以测定甘露聚糖诱导果实对病原菌侵染产生的抗病能力。结果表明,甘露聚糖处理能诱导李果实对褐腐病的侵染产生较强的抗性。如图2A所示,在发病72h时,经1、5、10g/L甘露聚糖处理的李果实病斑面积分别比对照降低了10.0%、8.6%和14.3%(P≤0.05)。但是,不同质量浓度甘露聚糖之间诱导果实产生抗病性的差异不显著。
李果实接种褐腐菌3h后经5g/L甘露聚糖浸泡处理,可以测定甘露聚糖对果实活体上生长的病原菌的抑制作用。在17℃贮藏期间甘露聚糖浸泡处理李果实发病面积明显小于对照组(图2B),说明甘露聚糖处理对能够明显地抑制李果实活体上褐腐菌的生长,从而有效抑制李果实褐腐病的扩展。在发病72h时,经5g/L甘露聚糖处理果实病斑面积比与对照组降低了22.6%(P≤0.05)。
可见,甘露聚糖对李果实褐腐病的控制作用既与其直接的抑菌作用有关,又与其诱导果实产生抗性有关。分析发现,5g/L甘露聚糖使处理前/处理后损伤接菌果实的病斑面积分别比对照降低了22.6%(图2B)、8.6%(图2A),由此可以看出,甘露聚糖的直接抑菌特性在果实病害控制中具有重要作用。

图2 甘露聚糖处理对李果实损伤接种褐腐病的抑制作用Fig.2 Inhibitory effect of yeast mannan on brown rot disease of plum fruits
2.3 常温贮藏过程中甘露聚糖处理对李果实呼吸强度的影响
李果实经5g/L甘露聚糖处理后23℃贮藏,测定结果表明,甘露聚糖处理能有效的抑制李果实的呼吸强度(图3)。在贮藏4、5d时,经甘露聚糖处理的李果实呼吸强度分别比对照降低了19.6%、38.1%(P≤0.05)。这可能与甘露聚糖处理在果实表面形成的透明薄膜有关。甘露聚糖涂膜在一定程度上阻隔了果实内部与外界环境的O2、CO2等气体交换,从而降低了果实的呼吸代谢过程。
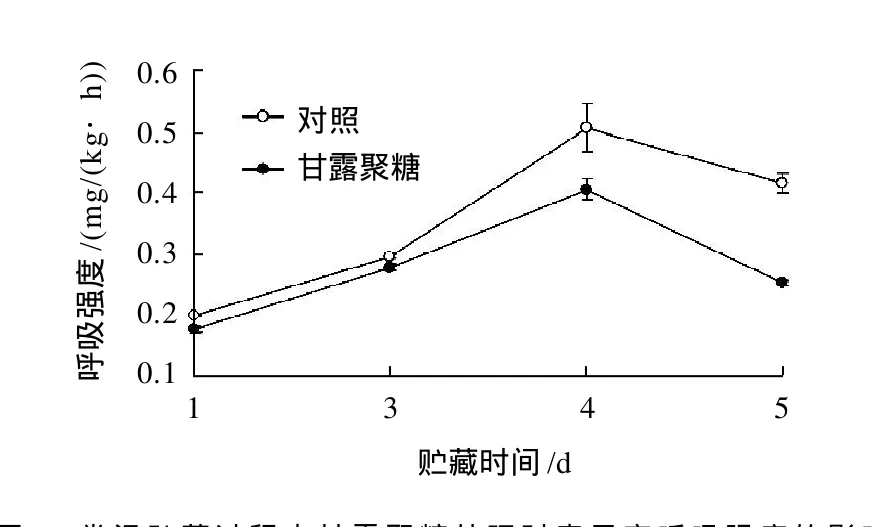
图3 常温贮藏过程中甘露聚糖处理对李果实呼吸强度的影响Fig.3 Effect of yeast mannan treatment on respiratory intensity of plum fruits stored at 23 ℃
2.4 常温贮藏过程中甘露聚糖处理对李果实质量损失率的影响
在23℃贮藏过程中,李果实的质量损失率呈逐渐升高趋势。甘露聚糖处理能降低贮藏过程中李果实的质量损失率(图4)。在贮藏3、4d时,经5g/L甘露聚糖处理果实的质量损失率分别比对照降低了17.3%、19.3%(P≤0.05)。可见,甘露聚糖处理后在果实表面形成的薄膜能有效降低李果实贮藏期间的失水。
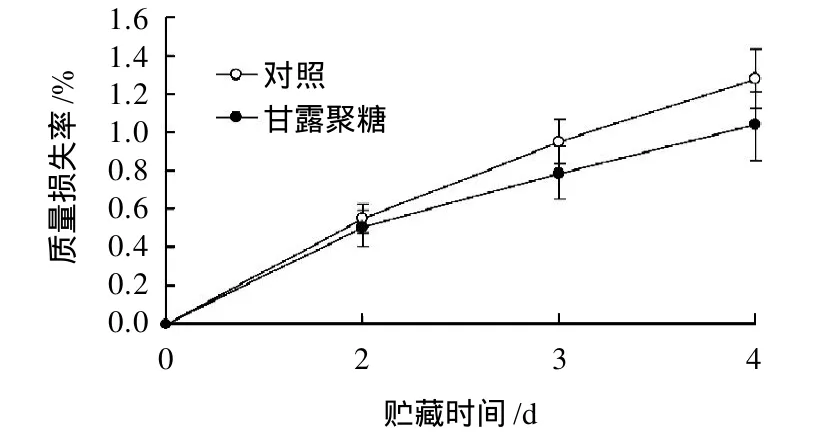
图4 常温贮藏过程中甘露聚糖处理对李果实质量损失率的影响Fig.4 Effect of yeast mannan treatment on weight-loss rate of plum fruits stored at 23 ℃
2.5 常温贮藏过程中甘露聚糖处理对李果实转色率的影响
李果实经5g/L甘露聚糖处理后23℃贮藏,测定结果表明,甘露聚糖处理能有效的抑制李果实由绿转红的进程(图5)。在贮藏6d时,经甘露聚糖处理李果实的转色指数比对照降低了21.3%。

图5 常温贮藏过程中甘露聚糖处理对李果实转色指数的影响Fig.5 Effect of yeast mannan treatment on color change index of plum fruits stored at 23 ℃
3 结 论
离体实验和活体实验都表明,酵母甘露聚糖对李褐腐菌的生长具有直接抑制作用,从而有效控制李果实褐腐病。这与葡甘聚糖的抑菌作用及其对果实的防腐作用研究结果类似[12-13]。然而,酵母甘露聚糖对李果实褐腐病的抑制作用除了与其直接的抑菌特性有关外,还可能与其诱导李果实自身产生抗病性有关。此外,通过酵母甘露聚糖浸泡处理还能形成一层极薄的透明膜,可以有效延缓李果实质量损失,降低呼吸强度,推迟果实转色,从而保持果实良好的贮藏品质。因此,本研究为酵母甘露聚糖在食品保藏和果实保鲜方面的应用提供了理论依据和绿色生产实践参考。
研究表明,甘露聚糖是果实细胞壁半纤维素的重要组成成分。随着果实的成熟, 甘露糖残基在果实中逐渐增加,果实质地软化加快[10]。因此,保持完整、牢固的细胞壁对推迟果实后熟软化和抵抗病原菌侵染具有重要意义[11]。至于甘露聚糖在李果实软化、腐烂过程中起着什么样的作用,以及外源酵母甘露聚糖处理能否影响到果实本身甘露聚糖的存在形态和细胞壁的完整状态,尚需进一步研究。
[1] 曹建康, 陈文化, 赵玉梅, 等. 壳聚糖结合1-甲基环丙烯处理对李果实货架期品质的影响[J]. 食品科学, 2009, 30(22): 366-368.
[2] 赵玉梅, 曹建康, 陈文化, 等. 壳聚糖涂膜对采后李果实贮藏品质及腐烂的影响[J]. 新疆农业大学学报, 2009, 32(1): 52-55.
[3] ZHANG D, SPADARO D, GARIBALDI A, et al. Efficacy of the antagonistAureobasidium pullulansPL5 against postharvest pathogens of peach, apple and plum and its modes of action[J]. Biological Control,2010, 54(3): 172-180.
[4] KARABULUT O A, SMILANICK J L, CRISOSTO C H, et al. Control of brown rot of stone fruits by brief heated water immersion treatments[J].Crop Protection, 2010, 29(8): 903-906.
[5] 汪洋, 胡花丽, 李鹏霞, 等. 不同贮藏温度对安哥诺李果实品质的影响[J]. 江西农业学报, 2009, 21(5): 124-127.
[6] 史辉, 邓伯勋. 气调贮藏对李果实保鲜效果的影响[J]. 杭州师范学院学报: 自然科学版, 2007, 6(2): 125-128.
[7] 王文凤, 冯晨静, 杨建民, 等. 浸钙对黑宝石李果实采后品质和延缓衰老的影响[J]. 农业工程学报, 2007, 23(5): 237-240.
[8] BOURGAULT R, OAKLEY A J, BEWLEY J D, et al. Three-dimensional structure of (1,4)-β-D-mannan mannanohydrolase from tomato fruit[J]. Protein Science, 2005, 14(5): 1233-1241.
[9] 王傲雪, 张丙秀, 李景富.β-1,4-甘露聚糖内切酶在番茄发育中的作用[J]. 园艺学报, 2006, 33(5): 1157-1161.
[10] HUYSAMER M, GREVE L C, LABAVITCH J M. Cell wall metabolism in ripening fruit. VIII. Cell wall composition and synthetic capacity of two regions of the outer pericarp of mature green and red ripe cv.Jackpot tomatoes[J]. Physiologia Plantarum, 1997, 101(2): 314-322.
[11] TRIPATHI P, DUBEY N K. Exploitation of natural products as an alternative strategy to control postharvest fungal rotting of fruit and vegetables[J]. Postharvest Biology and Technology, 2004, 32(3): 235-245.
[12] MENG X, YANG L, KENNEDY J F, et al. Effects of chitosan and oligochitosan on growth of two fungal pathogens and physiological properties in pear fruit[J]. Carbohydrate Polymers, 2010, 81(1): 70-75.
[13] 庞杰, 谢建华, 张甫生, 等. 可食性葡甘聚糖复合抑菌膜及其应用研究[J]. 农业工程学报, 2004, 20(3): 157-162.
[14] 刘红芝, 王强, 周素梅. 酵母甘露聚糖分离提取及功能活性研究进展[J]. 食品科学, 2008, 29(5): 465-468.
[15] 汪立平, 王锡昌, 陈有容, 等. 啤酒废酵母甘露聚糖的制备[J]. 食品科学, 2009, 30(2): 134-137.
[16] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化试验指导[M]. 北京: 中国轻工业出版社, 2007: 49-51.
Effect of Yeast Mannan Treatment on Storage Characteristics and Brown Rot Disease of Plum Fruits
SUN Xiao-ting,CAO Jian-kang*,CHEN Ni,LONG Liu-yan,YANG Xue
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
The effect of yeast mannan treatment on the growth ofMonilinia fructicolain potato dextrose agar (PDA) medium and the brown rot disease of plum fruits was studied.In vitroexperiments showed that yeast mannan treatment with different concentrations (5, 25, 50 g/L and 100 g/L) could obviously inhibit the growth ofMonilinia fructicolahypha, and the inhibitory effect of yeast mannan treatment on the growth of fungi was in a concentration-dependent manner.In vivotests showed that yeast mannan treatment could effectively inhibit brown rot disease of plum fruits inoculated withMonilinia fructicolabefore/after yeast mannan dipping. Yeast mannan treatment could also reduce the respiration intensity and weight-loss rate, and delay the color change of plum fruits stored at 23 ℃, which could maintain better storage quality of plum fruits.
mannan;plum fruit;brown rot disease;storage characteristics
TS255.3
A
1002-6630(2011)06-0261-04
2010-06-04
“十一五”国家科技支撑计划重点项目(2006BAD22B03);国家自然科学基金项目(30700645)
孙晓婷(1987—),女,硕士研究生,研究方向为农产品加工与贮藏工程。E-mail:sxt8706@126.com
*通信作者:曹建康(1976—),男,副教授,博士,研究方向为食品科学。E-mail:cjk@cau.edu.cn
