分离β-伴大豆球蛋白和大豆球蛋白工艺研究
2011-10-13迟玉杰孙艳梅王喜波
姜 剑,迟玉杰,2,*,孙艳梅,范 淼,王喜波
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.教育部大豆生物学重点实验室,黑龙江 哈尔滨 150030;3.东北农业大学理学院应用化学系,黑龙江 哈尔滨 150030)
分离β-伴大豆球蛋白和大豆球蛋白工艺研究
姜 剑1,迟玉杰1,2,*,孙艳梅3,范 淼1,王喜波1
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.教育部大豆生物学重点实验室,黑龙江 哈尔滨 150030;3.东北农业大学理学院应用化学系,黑龙江 哈尔滨 150030)
采用大容量(250×4mL)低速(5300×g)离心机分离β-伴大豆球蛋白和大豆球蛋白,进行碱溶条件、酸沉条件等条件的研究。结果表明:提取蛋白的碱性溶液(pH8.5的Tris-HCl溶液)离心效果较佳,沉淀大豆球蛋白pH6.4为佳,沉淀β-伴大豆球蛋白pH4.8为佳,用pH5.0沉淀杂蛋白离心分离效果较好;每一个待离心的浊液,在离心之前4℃冷藏2h以上,对离心效果的提高十分有效;采用最佳条件,从300g脱脂豆片分离大豆球蛋白和β-伴大豆球蛋白,收率分别为6.8%和2.2%,用SDS-PAGE电泳实验方法测定大豆球蛋白和β-伴大豆球蛋白样品纯度分别为89.1%和78.9%。因此该低速离心法较适合数十克级别的β-伴大豆球蛋白和大豆球蛋白的分离。
β-伴大豆球蛋白;大豆球蛋白;分离
大豆分离蛋白是用低变性脱脂大豆粕为原料,采用现代化加工技术来制取的一种蛋白质含量极高的功能性食品原料[1]。大豆分离蛋白具有多种功能特性[2],其在食品工业中主要应用于乳制品、肉制品、烘焙食品、面制品等加工[3]。近些年来大豆分离蛋白在非食品行业中也有很多重要用途[4]。大豆蛋白的一个主要分类方式是根据离心分离系数(即沉降系数)不同分类,分为2S、7S、11S、15S 4种组分,对应的分子质量分别是25、160、350、600kD。目前工艺上大豆分离蛋白的生产主要就是碱溶酸沉[5],其中,15S组分由大豆球蛋白聚集体或大分子聚合物组成,在提取时不溶。而大多数2S组分在酸性条件下也不沉淀,保持溶解状态,称为乳清蛋白。所以,大豆分离蛋白的主要组成成分是7S和11S组分,在大豆分离蛋白中含量分别约为37%和31%。大豆球蛋白是11S球蛋白。β-伴大豆球蛋白是7S球蛋白的一个主要的成分,当然简单的把7S球蛋白和β-伴大豆球蛋白等同看待是不严谨的。本实验为了尊重文献,同时使用7S和11S球蛋白。
1976年以前,11S球蛋白的分离方法主要有Koshiyama法[6]、Saio法[7]和Thanh法[8]等。一般文献中较多采用了Thanh法分离7S和11S大豆球蛋白。随后又有Nagano法[9]、Wu 法[10]、雷继鹏法[11]、Liu 法[12]和 Deak 法[13]等分离β-伴大豆球蛋白和大豆球蛋白方法出现。这些研究以前人研究为基础不断完善,产率纯度都有了较大提高,分离步骤不断简化。Nagano法也被广泛采用,如Wu等[10]使用修改了的Nagano法成功地生产出千克级的β-伴大豆球蛋白和大豆球蛋白。王孝英等[14]通过实验验比较了Nagano法、Thanh法和Saio法3种方法分离7S和11S大豆球蛋白的效果,结论是Nagano法分离得到的β-伴大豆球蛋白和大豆球蛋白大豆球蛋白纯度最高,分别达到71.5%和70.5%,Thanh法居中,Saio法分离的效果则相对较差,纯度只能达到60.5%和40.4%。
以上这些分离方法均需要高速冷冻离心机,如Thanh法离心转速为10000r/min,离心温度2~5℃;其他分离方法中,4℃,离心转速最低为6500×g。大容量高速冷冻离心机昂贵,即使是普通冷冻离心机(200mL)在很多实验室也达不到普及的程度。本实验研究使用大容量(250×4mL)低速(5300×g)离心机分离β-伴大豆球蛋白和大豆球蛋白的方法。
1 材料与方法
1.1 材料
脱脂豆片 哈尔滨高科技(集团)股份有限公司;其他化学试剂为国产分析纯。1.2 仪器与设备
TD5M低速大容量离心机(最大转速5500r/min≈5300×g,最大容量250×4mL) 上海卢湘仪离心机仪器有限公司;FDU-1100型冷冻干燥机 日本Tokyo Rikakikai公司;DYY-Ⅲ-6B型稳压稳流电泳仪 江苏南达生物技术开发公司。
1.3 方法
1.3.1β-伴大豆球蛋白和大豆球蛋白分离流程
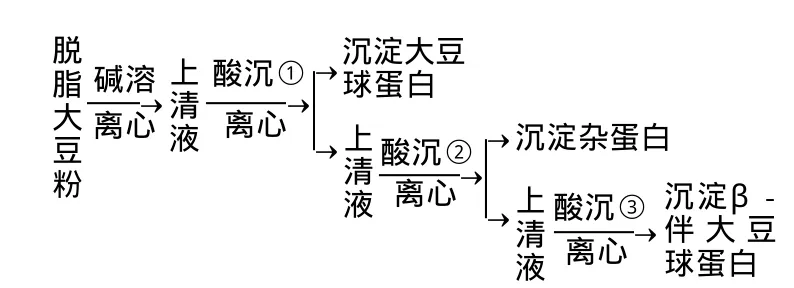
1.3.2β-伴大豆球蛋白和大豆球蛋白分离方法
1.3.2.1 碱溶方案
100g脱脂豆片与2L的碱提取液在室温条件下,用搅拌机搅拌1h,提取蛋白。然后放入4℃冰箱,冷藏2h,得浑浊液。将该浑浊液除去上层泡沫后,用离心机4500r/min,20min离心分离。沉淀全部弃去,得上清液。
1.3.2.2 酸沉分级分离
向上述碱溶液的上清液加入亚硫酸氢钠至0.01mol/L。充分搅拌后用1mol/L HCl溶液调pH6.4,进行第1次酸沉。该次酸沉浊液于4℃冷藏过夜放置后,4500r/min、20min离心分离,沉淀为大豆球蛋白。同时分离得到的上清液中加入固体NaCl至浓度0.25mol/L,加入1mol/L HCl溶液调pH5.0,进行第2次酸沉。得浊液放入冰箱冷藏2h后,4500r/min、20min离心分离,得沉淀为杂蛋白,弃去。同时得到的上清液用蒸馏水稀释2倍。加入1mol/L HCl溶液调pH4.8,进行第3次酸沉,得浊液冷藏过夜后,立即4500r/min、20min离心分离。弃去上清液,沉淀为β-伴大豆球蛋白。
1.3.2.3 蛋白粗品的纯化和干燥
沉淀大豆球蛋白和β-伴大豆球蛋白分别加4倍体积的蒸馏水后搅拌,加入1mol/L NaOH溶液调pH7.00。放入分子质量10000D透析袋,并用蒸馏水冷藏×透析3d。冷冻干燥机冻干。
1.3.3 最佳分离条件的验证实验
采用最佳条件,用300g脱脂豆片,加6L缓冲溶液提取分离β-伴大豆球蛋白和大豆球蛋白。依据1.3.1节的分离流程,第一次酸沉后离心所得沉淀经中和,透析,冻干得大豆球蛋白干质量A,计算大豆球蛋白第三次酸沉后离心所得
沉淀经中和,透析,冻干得β-伴大豆球蛋白干质量B,计算得β-伴大豆球蛋白收率
1.3.4 SDS-PAGE电泳实验方法
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)法对SPI的组分及各组分的百分含量进行分析,浓缩胶和分离胶的质量分数分别为3.0%和12.5%。pH8.8分离。电泳凝胶色带用扫描仪扫描,然后用Bandscan软件对图像进行分析。
2 结果与分析

表1 碱提取溶液4种方案Table 1 Four designs for protein extraction with alkali solution
2.1 碱溶方法
β-伴大豆球蛋白和大豆球蛋白的分离主要采用碱性溶剂,调酸性分步沉淀β-伴大豆球蛋白和大豆球蛋白。不同文献碱性提取在8.0~8.5之间,基于碱用量较少可节约成本的考虑,部分文献采用pH8.0碱溶液提取,Liu等[6]通过数据对比认为pH8.5提取效果较好。碱性溶液有两种,一种是NaOH溶液,另外有些文献倾向于用Tris-HCl溶液。本实验对比了不同碱性溶液分离大豆球蛋白球蛋白效果。
本实验研究发现与高速冷冻离心条件相比,在当前的离心条件下,大豆球蛋白沉淀的沉降确实困难。采用100g脱脂豆片提取大豆球蛋白时,大豆球蛋白湿蛋白产量实验结果见图1。可见用NaOH溶液提取分离大豆球蛋白,4500r/min离心只能看到很少的沉淀,而文献用9000×g、4℃离心时,可以达到较好离心分离效果。用Tris-HCl溶液提取分离大豆球蛋白,4500r/min离心分离沉淀量明显提高,约是NaOH溶液提取分离方法的4倍。因此,确定提取蛋白的碱性溶液为0.03mol/L pH8.5的Tris-HCl溶液。

图1 大豆球蛋白湿蛋白产量Fig.1 Yield of wet glycinin
由于提取需要使用0.03mol/L pH8.5的Tris-HCl溶液提取,而Tris-HCl溶液较脱脂豆片成本高,因此,仅对脱脂豆片进行一次提取。
2.2 酸沉方法
2.2.1 酸沉pH值的确定
大豆球蛋白和β-伴大豆球蛋白的分离是利用大豆球蛋白和β-伴大豆球蛋白在不同pH值时的溶解度,通过调pH值,令他们分步沉淀,实现大豆球蛋白和β-伴大豆球蛋白的分级分离,为了提高大豆球蛋白和β-伴大豆球蛋白的纯度,在沉大豆球蛋白之后和沉β-伴大豆球蛋白之前,还沉了一次杂蛋白。因此,调3次pH值,沉淀3次。一般文献沉淀大豆球蛋白的pH6.4。pH4.8沉淀β-伴大豆球蛋白pH4.8。本实验也是采用这两个pH值沉淀大豆球蛋白和β-伴大豆球蛋白。然而,一般文献沉淀沉杂蛋白的pH值则在5.0~5.5之间。如Nagano和Wu都是用pH5.0沉淀杂蛋白,而Liu是用pH5.5沉淀杂蛋白。他们离心分离在9000×g、4℃条件下实现的。常温条件下,4500r/min离心时,pH5.5沉淀杂蛋白离心分离很困难,上清液仍然十分混浊,杂蛋白沉淀少到与上清液难于分离,常随上清液一块倒出。用pH5.0沉淀杂蛋白,离心分离效果较好。
2.2.2 离心效果的提高
每一个待离心的浊液,在离心之前,在4℃冷藏一段时间,对离心效果的提高十分有效。通常文献只是对分离大豆球蛋白用的浊液进行了过夜冷藏处理,因为众所周知大豆球蛋白为冷沉组分。由于本研究采用的不是冷冻离心机,其他待离心的浊液直接用离心机离心效果远没有经过冷藏处理的离心效果好。经过冷藏处理的经离心后,上清液清澈,而没有经过冷藏处理的离心上清液明显浑浊。本研究把待离心的浊液,在离心之前,在4℃冷藏至少2 h以上。其中对分离大豆球蛋白和β-伴大豆球蛋白用的浊液均进行了过夜冷藏处理。这样,一个从脱脂豆片提取分离大豆球蛋白和β-伴大豆球蛋白蛋白沉淀的周期为2.5d。时间上虽然较长,但分离效果好,样品处理量大,对离心机的要求较低,适合较多大豆球蛋白和β-伴大豆球蛋白样品的分离制备。
2.3 SDS-PAGE电泳测定大豆球蛋白和β-伴大豆球蛋白样品纯度
SDS-PAGE电泳技术测定了最佳条件分离条件下制得的大豆球蛋白和β-伴大豆球蛋白样品纯度。用Bandscan软件,对SDS-PAGE电泳图像中条带进行相对分子质量和含量分析。其中泳带1和泳带2中,各取15个明显条带,处理情况见图2。泳带1和泳带2中各条带由上向下编号,其相对分子质量和含量分析结果列于表2。

图2 大豆球蛋白和β-伴大豆球蛋白样品电泳图和Bandscan软件选取的15个明显条带Fig.2 Fifteen clear bands selected from electrophoresis picture ofβ-conglycinin and glycinin by Bandscan software
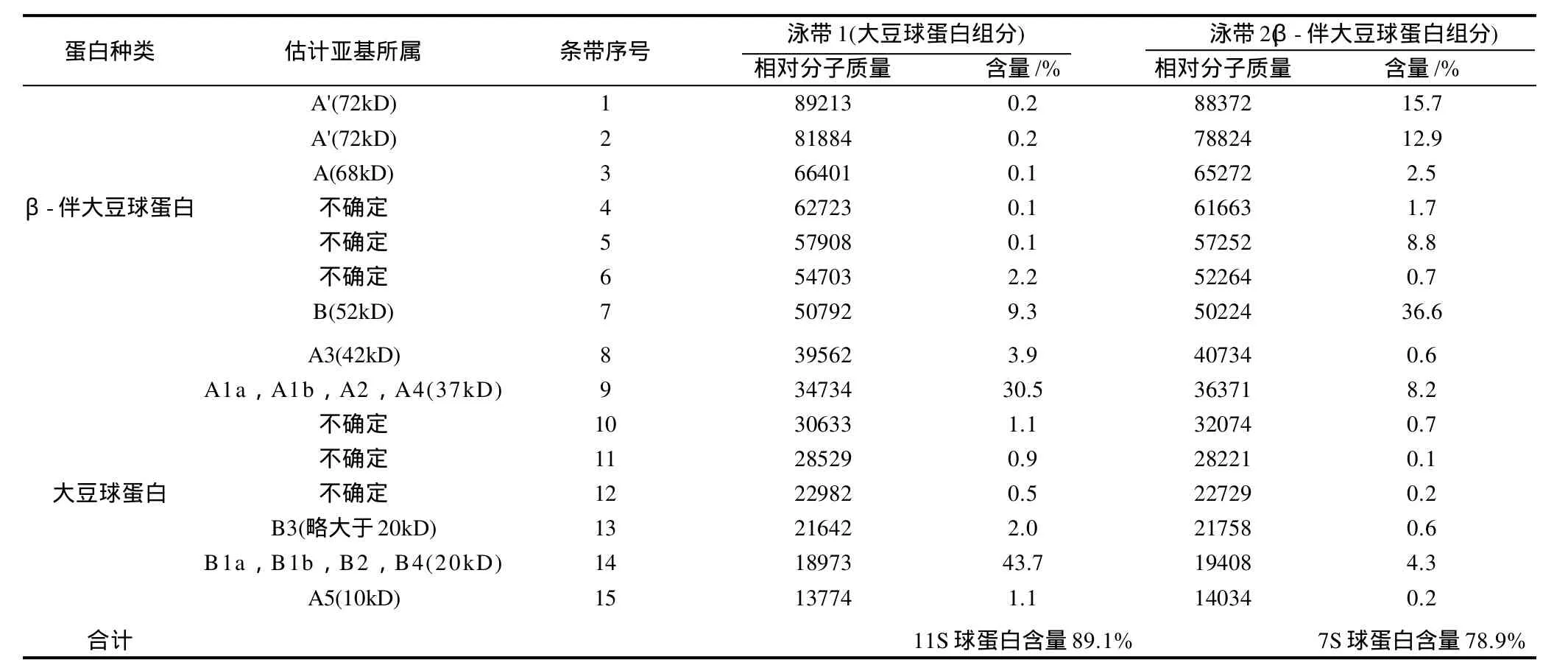
表2 大豆球蛋白组分和β-伴大豆球蛋白组分中亚基相对分子质量和含量分析Table 2 Analysis of molecular weights and contents of subunits inβ-conglycinin and glycinin fractions
β-伴大豆球蛋白含有3种类型亚基,即α、α'、β。β-伴大豆球蛋白是这3种亚基以不同的方式结合的三聚体。α(68kD)α'(72kD)β(52kD)[15]。大豆球蛋白的单聚体亚基是一个由一个酸性多肽和一个碱性多肽以一个二硫键相连的蛋白,结构表示为A-S-S-B。其中A代表酸性多肽链,B代表碱性多肽链,S-S是二硫键。组成亚基的酸性多肽链有6种[A1a(37kD) A1b(37kD) A2(37kD) A3(42kD) A4(37kD) A5(10kD)[15]],碱性多肽链有5种B1a(20kD) B1b(20kD) B2(20kD) B3(略大于20kD) B4(20kD)[15]。条带分析发现大豆球蛋白和β-伴大豆球蛋白样品亚基种类较全,可能是脱脂豆片品种不单一等。
结果统计表明,该大豆球蛋白组分中大豆球蛋白含量89.1%,β-伴大豆球蛋白组分中β-伴大豆球蛋白78.9%。可见,大豆球蛋白和β-伴大豆球蛋白样品纯度较高,基本达到了预期效果。
2.4β-伴大豆球蛋白和大豆球蛋白最佳分离条件的验证实验
采用最佳方案,用300g脱脂豆片加6L缓冲溶液提取β-伴大豆球蛋白和大豆球蛋白。各分离阶段分离结果见表3。

表3 β-伴大豆球蛋白和大豆球蛋白分离结果Table 3 Separation results ofβ-conglycinin and glycinin
用SDS-PAGE电泳实验方法测定大豆球蛋白和β-伴大豆球蛋白样品纯度分别为89.1%和78.9%。大豆球蛋白收率为6.8%,收率较文献9%~10%的收率略小,β-伴大豆球蛋白收率为2.2%,该收率较文献9%~10%的收率小很多。但一次可以制备具有如此纯度的大豆球蛋白和β-伴大豆球蛋白样品的量(大豆球蛋白20.5g和β-伴大豆球蛋白6.5g)还是达到了预期的效果。
3 结 论
本研究尝试了用大容量低速(5300×g)离心机(1L)分离β-伴大豆球蛋白和大豆球蛋白。进行碱溶条件、酸沉条件等条件的探讨,发现提取蛋白的碱性溶液为pH8.5的Tris-HCl溶液较佳,沉淀大豆球蛋白的pH6.4,沉淀β-伴大豆球蛋白pH4.8。用pH5.0沉淀杂蛋白,离心分离效果较好。每一个待离心的浊液,在离心之前,在4℃冷藏2h以上,对离心效果的提高十分有效。用最佳条件,从300g脱脂豆片分离大豆球蛋白和β-伴大豆球蛋白,收率分别为6.8%和2.2%。用SDS-PAGE电泳实验方法测定大豆球蛋白和β-伴大豆球蛋白样品纯度分别为89.1%和78.9%。该方法较适合几十克级别的β-伴大豆球蛋白和大豆球蛋白的制备。
[1] 肇立春. 大豆分离蛋白生产工艺探讨[J]. 粮油加工与食品机械, 2006(1): 51-52.
[2] 陈伟斌. 大豆分离蛋白的功能性和改性研究进展[J]. 粮食加工, 2006(4): 67-71.
[3] 李玉珍, 肖怀秋, 兰立新. 大豆分离蛋白功能特性及其在食品工业中的应用[J]. 中国食品添加剂, 2008(1): 121-124.
[4] 郑环宇, 许慧, 黄艳玲, 等. 大豆蛋白在非食品用途中的应用与研究现状[J]. 大豆科技, 2009(6): 51-56.
[5] 陈慧. 浅谈大豆分离蛋白的生产实践[J]. 中国油脂, 2008(6): 26-28.
[6] KOSHIYAMA I. Purification of the 7S component of soybean proteins[J]. Agric Biol Chem, 1965, 29: 885-887.
[7] SAIO K, WATANABE T. Food use of soybean 7S and 11S proteins(extraction and functional properties of their fractions)[J]. J Food Sci,1973, 38(7): 1139-1145.
[8] THANH V H, SHIBASAKI K. Major protein of soybean seeds. A straightforward fraction and their characterization[J]. Jounal of Agricultural and Food Chemistry, 1976, 24(6): 1117-1121.
[9] NAGANO T, HIROTSUK A M, MORI H. Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6): 941-944.
[10] WU S, MURPHY P A, JOHNSON L A, et al. Pilot-plant fractionation of soybean glycinin andβ-conglycinin[J]. J Am Oil Chem, 1999, 76(3): 285-293.
[11] 雷继鹏, 田少君, 李晓吸. 分离75和115大豆球蛋白简便方法[J]. 粮食与油脂, 2003(6): 6-8.
[12] LIU Chun, WANG Hongling, CUI Zhumei, et al. Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein[J]. Food Chemistry, 2007, 102(4): 1310-1316.
[13] DEAK N A, MURPHY P A, JOHNSON L A. Characterization of fractionated soy proteins produced by a new simplified procedure[J]. J Am Oil Chem, 2007, 84(2): 137-149.
[14] 王孝英, 张雪旺, 刘汉灵. 7S和11S大豆球蛋白的分离研究[J]. 中国食品添加剂, 2006(3): 74-77.
[15] FONTES E P B, MOREIRA M A, DAVIES C A, et al. Urea-Elicited changes in relative electrophoretic mobility of certain glycinin andβconglycinin subunits[J]. Plant Physiol, 1984, 76(3): 840-842.
An Investigation into the Separation Process forβ-Conglycinin and Glycinin
JIANG Jian1,CHI Yu-jie1,2,*,SUN Yan-mei3,FAN Miao1,WANG Xi-bo1
(1. School of Food Sciences, Northeast Agricultural University, Harbin 150030, China;2. Key Laboratory of Soybean Biology, Ministry of Education, Harbin 150030, China;3. Department of Application Chemistry, College of Science, Northeast Agricultural University, Harbin 150030, China)
β-conglycinin and glycinin were separated by large-capacity (250 × 4 mL) low-speed (5300 ×g) centrifugation at the condition of alkali dissolution and acid precipitation. Results indicated that better centrifugation efficiency of soybean protein was in pH 8.5 Tris-HCl solution; The optimal pH values for precipitating glycinin andβ-conglycinin were 6.4 and 4.8, respectively. Meanwhile, the optimal pH for removing the impure proteins was 5.0. The enhancement of entrifugation efficiency was achieved by keeping turbid liquid at 4 ℃ for more than 2 h before centrifugation. Under the optimal conditions, the yields of glycinin andβ-conglycinin were 6.8% and 2.2%, respectively. The purities of separated proteins determined by SDS-PAGE were 89.1% and 78.9%. Low-speed centrifugation is suitable for separatingβ-conglycinin and glycinin.
β-conglycinin;glycinin;separation
Q816
A
1002-6630(2011)06-0011-05
2010-04-24
黑龙江省自然科学基金重点项目(ZD200902)
姜剑(1985—),男,硕士研究生,研究方向为农产品加工与贮藏工程。E-mail:jiangjian.113@163.com
*通信作者:迟玉杰(1963—),女,教授,博士,研究方向为食品化学及农产品深加工。E-mail:yjchi@126.com
