超声波辅助提取水溶性大豆多糖及纯化工艺
2011-10-13刘秀奇王大为
陈 红,张 波,刘秀奇,李 红,王大为*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
超声波辅助提取水溶性大豆多糖及纯化工艺
陈 红,张 波,刘秀奇,李 红,王大为*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
以脱脂挤压豆渣为原料,对超声波辅助提取水溶性大豆多糖及纯化工艺进行研究。通过单因素试验和正交试验,确定最佳工艺参数为提取pH4.5、热水温度90℃、液料比20:1(mL/g)、超声波功率200W、超声波提取时间40min时,水溶性大豆多糖的得率为8.82%。纯化粗多糖的条件为Sevag试剂中氯仿与正丁醇体积比3:1、萃取3次,所得纯化多糖的回收率为60.30%。
脱脂挤压豆渣;水溶性大豆多糖;超声提取;纯化
我国是世界上加工大豆的主要国家之一,工业生产中一般会产生30%~35%的豆渣(soybean residue,SR),由于其水分含量大,极易腐败变质[1],通常用作饲料或废弃,造成浪费。豆渣的主要成分是子叶部的细胞壁多糖,约含30%的水溶性大豆多糖[2-3]。水溶性大豆多糖简称大豆多糖,它是一种酸性多糖,主要成分是半乳糖、阿拉伯糖、鼠李糖、海藻糖以及木糖等,具有多种生物活性,是一种天然的功能性成分,它可以改善食品的食用品质、加工特性,能够抑制脂类氧化[4]和稳定酸性饮料中的蛋白质[5],还可以作为食品中的乳化成分[6],在食品中具有广泛的应用前景。在抗氧化、抗菌、抗病毒及免疫调节等方面也有一定功效[7]。大豆多糖传统的提取方法是热水浸提,该法得率低、操作费时、能耗大。近年来,超声波、微波等辅助提取方法已应用于多糖的提取[8-15]。两种方法操作简单,可大大缩短提取时间。美国环保局(EPA)已经将超声波提取法作为基本分析方法[16]。本研究以脱脂挤压豆渣为原料,将超声波技术应用于大豆多糖的提取,并对其粗多糖进行纯化,旨在为工业化提取大豆多糖提供新方法,以期能提高豆渣的利用率,降低大豆产品的生产成本。
1 材料与方法
1.1 材料、试剂与仪器
豆渣(烘干,经检测干豆渣含水分8.45%、蛋白质18.61%、脂肪11.87%、纤维素52.46%、灰分3.52%)市购。
浓硫酸、苯酚、无水乙醇、9 5%乙醇、氯仿、正丁醇、葡萄糖、丙酮等(均为分析纯);葡萄糖标准品 Sigma公司。
101型电热鼓风干燥箱 上海跃进医疗器械厂;VCX500型超声波破碎机 宁波新芝生物科技股份有限公司;LJX-Ⅱ型离心沉淀机 上海医用分析仪器厂;722型可见分光光度计 北京普析通用仪器有限责任公司;6K-80电热恒温水浴锅 常州市国立试验设备研究所;GB204分析天平 日本岛津公司;RE-52AA旋转蒸发仪上海申胜生物科技有限公司;FD21冷冻干燥机 北京博医康技术公司。
1.2 方法
1.2.1 超声波辅助提取与纯化工艺流程
干豆渣→索氏提取(乙醚脱脂)→挤压(单螺杆挤压机)→粉碎(过40目筛)→加一定温度蒸馏水→调pH值→超声波辅助浸提→离心(4500r/min,30min)→取上清液→浓缩→95%乙醇沉淀粗多糖→抽滤→称量计算得率→水溶解→Sevag试剂去蛋白→95%乙醇沉淀→离心(4000r/min,20min)→沉淀物→无水乙醇洗涤→真空冷冻干燥→测定多糖含量
1.2.2 样品中大豆多糖得率计算
1.2.2.1 标准曲线的测定
大豆多糖测定采用改进的苯酚-硫酸法[17]。精确称取105℃干燥至质量恒定的葡萄糖标准样品25mg于250mL容量瓶中加水定容,摇匀,然后分别吸取0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8mL,各以水补至2.0mL,然后加入6%苯酚液1.0mL,再加浓硫酸至总体积达10mL,混合均匀后,室温放置30min,在波长490nm处测定吸光度,以2.0mL水按同样显色操作为空白,横坐标为葡萄糖质量浓度、纵坐标为吸光度,绘制标准曲线。得线性回归方程为:
A=0.0129C+0.029,r=0.997
式中:A为吸光度;C为测定液质量浓度/(mg/mL)。
1.2.2.2 大豆多糖得率计算
吸取样品液1.0mL按上述步骤操作,在波长490nm处测定大豆多糖吸光度。重复3次,取平均值。根据标准曲线方程求出样品液中大豆多糖的含量,并计算多糖得率。

1.2.3 多糖提取单因素试验设计
利用单因素试验分别考察pH值、液料比、热水温度、超声功率、超声时间、超声温度6个因素对大豆多糖得率的影响程度,选择最佳的提取工艺条件。
1.2.4 多糖提取正交试验设计
为了优化提取工艺条件,参照单因素试验结果设计正交试验L9(34),其因素及水平见表1。

表1 多糖提取正交试验因素水平Table 1 Factors and levels in orthogonal tests
1.2.5 多糖纯化
应用Sevag法[18-20]去除大豆多糖中的蛋白质。此方法条件温和,可避免多糖降解。用于除蛋白的Sevag试剂(氯仿+正丁醇)具有不同比例,本实验结合大豆多糖的性质,选择Sevag试剂的最佳比例及萃取次数,以取得最高的纯化多糖的回收率。
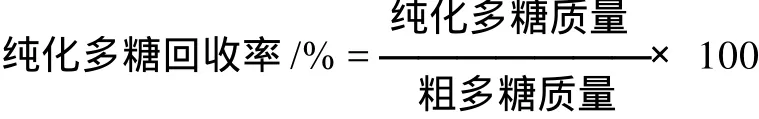
本实验选择Sevag试剂中氯仿-正丁醇的体积比分别为5:1、4:1、3:1,除蛋白的次数分别为2、3次。
2 结果与分析
2.1 单因素试验
2.1.1 pH值对大豆多糖得率的影响
称取20g干豆渣,按液料比25:1(mL/g)加入90℃蒸馏水,调pH值分别为3.0、3.5、4.0、4.5、5.0、5.5,在60℃、200W功率条件下超声处理40min,结果见图1。
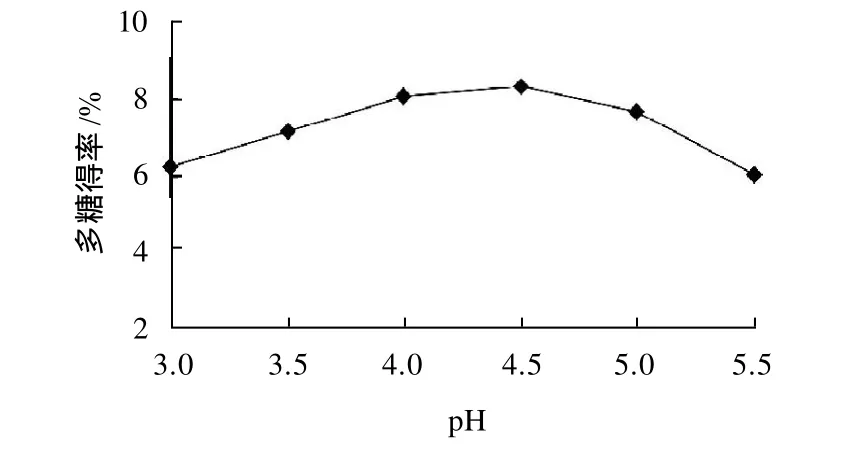
图1 pH值对大豆多糖得率的影响Fig.1 Effect of pH on extraction rate of soybean polysaccharides
结果表明,当pH值为3时,大豆多糖的得率较低,主要是因为大豆多糖虽属酸性多糖,但在酸性较强的条件下,易导致其中某些键或侧链的断裂,从而造成得率较低。当pH值为4.5时,多糖的得率达到最大。故pH值选定在4.5为最佳。
2.1.2 液料比对大豆多糖得率的影响
称取20g干豆渣,按液料比10:1、15:1、20:1、25:1、30:1、35:1加入90℃的蒸馏水,调至pH4.5,在60℃、200W功率条件下超声处理40min。
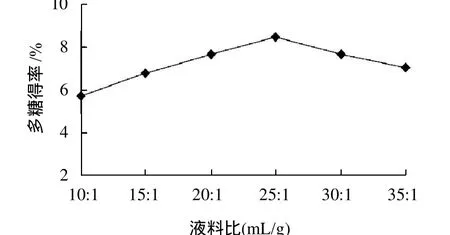
图2 液料比对大豆多糖得率的影响Fig.2 Effect of material/liquid ratio on extraction rate of soybean polysaccharides
由图2可知,液料比在10:1~25:1之间时,大豆多糖得率上升最为迅速。液料比高于25:1时,多糖的得率趋于稳定,变化幅度不大。这是由于大豆多糖从细胞到溶剂是一个由浓度差推动的扩散过程,溶剂用量越多细胞内外的浓度差就越大。当溶剂增加到一定程度之后再增加溶剂用量并不会明显提高多糖的得率。
2.1.3 热水提取温度对大豆多糖得率的影响
称取20g干豆渣,按液料比25:1加入蒸馏水,蒸馏水温度分别为60、70、80、90、100℃,调至pH4.5、60℃、200W功率条件下超声处理40min。
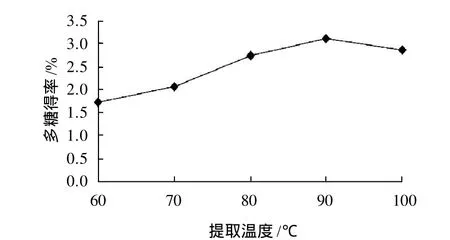
图3 提取温度对大豆多糖得率的影响Fig.3 Effect of extraction temperature on extraction rate of soybean polysaccharides
由图3可知,多糖得率随提取温度的升高不断提高,因为提取温度升高会加快溶液的扩散速率,促进细胞内的多糖物质向外扩散。提取温度为90℃时得率达到最大,由于大于100℃提取需要压力设备,不仅会使提取成本增加,而且提取温度过高还会破坏大豆多糖的结构,故提取温度选择90℃为宜。
2.1.4 超声波功率对大豆多糖得率的影响
本实验频率保持在45kHz,选用不同的功率进行提取。称取20g干豆渣,按液料比25:1加入90℃蒸馏水,调至pH4.5,在60℃,50、100、150、200、250、300W条件下超声处理40min。

图4 超声波功率对大豆多糖得率的影响Fig.4 Effect of ultrasonic power on extraction rate of soybean polysaccharides
由图4可知,当功率较小时,大豆多糖的得率随着超声波功率的提高而提高,因为加大超声波功率,超声空化作用加强,机械剪切作用也加强,有助于细胞多糖的溶出。但当功率达到一定程度(200W)时,功率再进一步提高,得率反而呈下降趋势。这是因为功率过大可能会使多糖分子降解程度加大,故超声波功率以150~200W为宜。
2.1.5 超声波辐射时间对大豆多糖得率的影响
称取20g干豆渣,按液料比25:1加入90℃的蒸馏水,调至pH4.5,在60℃、200W的功率条件下超声处理 10、20、30、40、50、60min。

图5 超声波辐射时间对大豆多糖得率的影响Fig.5 Effect of ultrasonic treatment time on extraction rate of soybean polysaccharides
从图5可知,超声波辐射时间少于40min时,超声波辐射时间越长,多糖得率越高。处理40min时多糖得率达到最大。超声波辐射时间再延长,多糖得率开始下降,究其原因可能是由于超声波较强的机械剪切作用,长时间处理不仅会使大分子多糖降解,同时也使蛋白质等其他杂质开始溶出,得到的多糖含量下降。故用超声波处理多糖浸提液的时间以40min为宜。
2.2 大豆多糖提取正交试验
超声波辅助提取大豆多糖时,超声波处理温度以60℃为宜。实验显示,高于60℃易使蛋白质发生变性,而且会使部分多糖水解为单糖或低聚糖,多糖得率反而下降。故提取过程中超声波处理温度60℃为宜。
在超声波处理温度60℃、热水温度90℃条件下,以大豆多糖得率作为评价指标,选取对得率有较大影响的超声波功率、超声波辐射时间、液料比、pH值4个因素进行L9(34)正交试验,确定最佳提取工艺条件,结果见表2。

表2 大豆多糖提取正交试验设计及结果Table 2 Scheme and results of orthogonal array design
从表2可以看出,超声波功率(A)、超声波辐射时间(B)、液料比(C)、pH值(D)对大豆多糖得率影响的大小顺序是B>C>D>A;根据正交试验结果最佳工艺条件为A2B3C1D2,即超声波功率200W、超声波辐射时间40min、液料比20:1、pH4.5,此时多糖得率为8.82%。
2.3 粗多糖的纯化
将正交试验提取的粗多糖进行纯化。将按最佳提取条件所获粗多糖用不同比例Sevag试剂纯化,以期获得最佳品质多糖,具体见表3。结果表明,Sevag试剂配方中氯仿与正丁醇的比值较小,且萃取的次数较多时,对提高纯化多糖回收率有利。最佳萃取条件为氯仿与正丁醇体积比为3:1,且萃取3次时,纯化多糖的回收率达到60.30%。
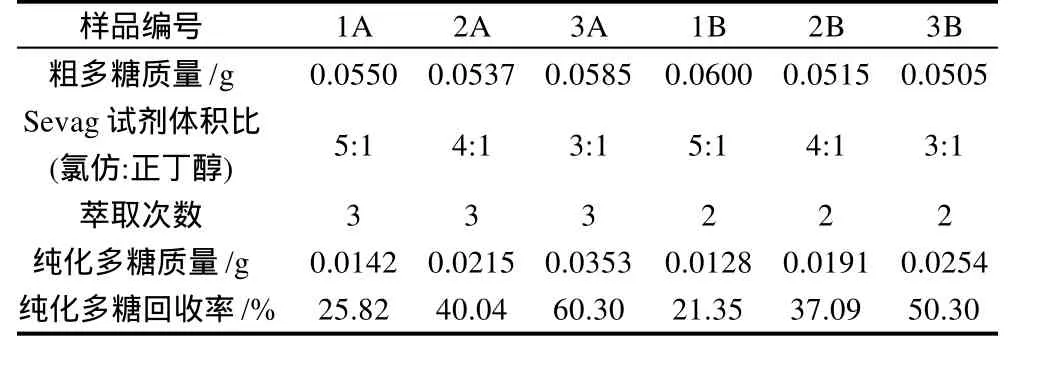
表3 Sevag试剂配方与纯化多糖回收率的关系Table 3 Relationship between Sevag reagent formula and extraction rate of soybean polysaccharides
2.4 传统的热水浸提法与超声波辅助提取法比较

表4 两种方法比较结果Table 4 Comparison of extraction rates between two extraction methods
由表4可知,与传统的热水浸提法相比,超声波辅助提取可显著提高大豆多糖的得率,明显缩短提取时间,同时又降低能量消耗,所以该方法是辅助提取多糖的好方法,具有快速、节能、高效等优点。
3 结 论
超声波辅助提取大豆多糖的最佳工艺条件为提取pH4.5、热水温度90℃、液料比20:1、超声波功率200W、超声波提取时间40min、超声波提取温度60℃,此时水溶性大豆多糖的得率为8.82%。
纯化粗多糖的最佳条件为Sevag试剂中氯仿与正丁醇的比例3:1、萃取3次,此时蛋白脱除效果较好,多糖损失也较少,所得纯化产物中多糖的回收率最高,达到60.30%。
[1] 张振山, 叶素萍, 李泉, 等. 豆渣的处理与加工利用[J]. 食品科学,2004, 25(10): 400-406.
[2] 赵国志, 刘喜亮, 刘智锋. 水溶性大豆多糖类开发与应用[J]. 粮油与食品, 2006, 16(8): 15-17.
[3] 石彦国, 任莉. 大豆制品工艺学[M]. 北京: 中国轻工业出版社, 1993:52-55.
[4] MATSUMURA Y, EGAMI M, SATAKE C, et al. Inhibitory effects of peptide-bound polysaccharides on lipid oxidation in emulsions[J]. Food Chemistry, 2003, 83(1): 107-119.
[5] NAKAMURA A, FURUTA H, KATO M, et al. Effect of soybean soluble polysaccharides on the stability of milk protein under acidic conditions[J]. Food Hydrocolloids, 2003, 17(3): 333-343.
[6] NAKAMURA A, TAKAHASHI T, YOSHIDA R, et al. Emulsifying properties of soybean soluble polysaccharide[J]. Food Hydrocolloids,2004, 18(5): 795-803.
[7] 张晓华, 任辰刚, 郭顺堂. 可溶性大豆多糖的提取工艺及其应用研究[J]. 大豆科学, 2006, 25(1): 28-31.
[8] LUQUE-GARCA J L, LUQUE de CASTRO M D. Ultrasound: a powerful tool for leaching[J]. Trends in Analytical Chemistry, 2003, 22(1): 41-47.
[9] 韩玉珠, 殷涌光, 李风伟, 等. 高压脉冲电场提取中国林蛙多糖的研究[J]. 食品科学, 2005, 26(9): 337-339.
[10] 向东, 赖凤英, 梁平. 植物性多糖的强化提取[J]. 食品与发酵工业,2004, 30(5): 81-84.
[11] 王莉, 陈正行, 张兵. 不同方法提取米糠多糖工艺的优化研究[J]. 食品科学, 2007, 28(4): 112-116.
[12] 聂少平, 谢明勇, 罗珍. 微波技术提取茶多糖的研究[J]. 食品科学,2005, 26(11): 103-106.
[13] 刘依, 韩鲁佳. 微波技术在板蓝根多糖提取中的应用[J]. 中国农业大学学报, 2002, 7(2): 27-30.
[14] 江和源, 蒋迎. 茶叶多糖的微波辅助提取技术研究[J]. 食品科技, 2003(10): 17-19.
[15] HROMADKOVA Z, EBRINGEROVA A, VALACHOVIC P. Ultrasound-assisted extraction of water-soluble polysaccharides from the roots of valerian (Valeriana oficinalisL.)[J]. Ultrasonics Sonochemistry,2002, 9(1): 37-44.
[16] 周秀琴. 水溶性大豆多糖的开发和应用[J]. 食品与开发, 1992, 27(9): 27-28.
[17] 董群, 郑丽伊, 方积年. 改良的苯酚-硫酸法测定多糖和寡糖含量的研究[J]. 中国药学杂志, 1996, 31(9): 550-552.
[18] 范远景, 张倩. 豆渣中水溶性大豆多糖提取及组分鉴定[J]. 食品科学, 2007, 28(9): 295-298.
[19] 李俊, 陈海燕, 邓胜平, 等. 罗汉果多糖的分离纯化及分析[J]. 化学世界, 2005(5): 277-280.
[20] 夏新奎. 茶多糖的提取纯化及组成研究综述[J]. 信阳农业高等专科学校学报, 2004, 14(2): 45-47.
Ultrasonic-assisted Extraction and Purification of Water-soluble Polysaccharides from Soybean Dregs
CHEN Hong,ZHANG Bo,LIU Xiu-qi,LI Hong,WANG Da-wei*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Skimmed extruded soybean dregs were used as the raw material to prepare water-soluble polysaccharides through the steps of ultrasonic-assisted extraction and purification by Sevag's method. The optimal ultrasonic-assisted extraction parameters were found to be extraction pH of 4.5, temperature of 90 ℃, material/liquid ratio of 1:20 (g/mL), ultrasonic power of 200 W, and ultrasonic extraction time of 40 min. Under these optimal extraction conditions, the extraction rate of watersoluble soybean polysaccharides was up to 8.82%. The purification of crude polysaccharides was achieved by treating with a Sevag reagent composed of CHCl3 andn-butanol (3:1,V/V) 3 times. The recovery rate of purified polysaccharides was up to 60.30%.
skimmed extruded soybean dregs;water-soluble soybean polysaccharide;ultrasonic extraction;purification
TS214.2
A
1002-6630(2011)06-0139-04
2010-07-11
吉林农业大学科学研究启动基金项目(2009-6)
陈红(1976—),女,讲师,博士,主要从事食品营养与功能食品开发研究。E-mail:chenhong216@yahoo.com.cn
*通信作者:王大为(1960—),男,教授,博士,主要从事功能食品开发研究。E-mail:xcpyfzx@163.com
