正常山羊腰椎间盘营养途径的DCE-MRI观察
2011-09-27麻少辉尹战海杨广夫
杜 恒,麻少辉,管 民,尹战海,韩 博,杨广夫,张 明,刘 淼
(1.西安交通大学医学院第一附属医院骨科,西安 710061;2.西安交通大学医学院第一附属医院影像科,西安 710061;3.西安市高新医院放射科,西安 710075)
正常山羊腰椎间盘营养途径的DCE-MRI观察
杜 恒1,麻少辉2,管 民2,尹战海1,韩 博3,杨广夫3,张 明2,刘 淼1
(1.西安交通大学医学院第一附属医院骨科,西安 710061;2.西安交通大学医学院第一附属医院影像科,西安 710061;3.西安市高新医院放射科,西安 710075)
目的 研究正常山羊腰椎间盘软骨终板营养途径。方法 选取健康24月龄山羊8只,每只山羊观察4个腰椎间盘,共32个腰椎间盘。麻醉后,行磁共振动态增强扫描,观察感兴趣区的信号变化特点。分别测量增强前及增强后 0 min、5 min、10 min、30 min、1 h、1.5 h、2 h、2.5 h、3 h、3.5 h 感兴趣区信号强度值,分析时间-信号强度曲线及峰值出现时间。结果 椎体磁共振信号强度在0 min时达到高峰后迅速下降;软骨终板区在30 min时缓慢达到第一高峰后轻度下降,于2 h上升达到第二高峰;髓核在5 min内为负值,之后缓慢上升于2 h达到高峰,随后逐渐下降。结论 正常山羊腰椎椎间盘主要通过软骨终板途径进行营养代谢。
磁共振成动态增强;髓核;软骨终板区;钆卞氧丙基四乙酸盐(钆贝葡胺);山羊
1 材料与方法
1.1 研究对象
选取健康成年山羊8只(西安交通大学医学院动物中心提供),24月龄,体重为35~45 kg(平均41.3 kg)。标准饲养条件下适应性饲养2周。
1.2 仪器与方法
使用Philips Intera Achieva 1.5T双梯度磁共振系统。术前禁饮食24 h,术前30 min肌注阿托品0.03~0.05 mg/kg。山羊肌内注射速眠新(0.3 mL/kg体重)基础麻醉后,持续耳缘静脉滴注丙泊酚(2 mg/kg)维持镇定,并行气管插管术。在腰椎背侧放置装有纯净水的50 min注射器作为水模。体表定位采用SENSE相共振体线圈包裹羊腰椎水平,侧卧位,尾先进。先行T2WI-TSE-SPAIR(TR/TE=3500 ms/60 ms,层厚/层间距 =4.0 mm/0.6 mm,扫描时间为211 s)扫描。排除扫描野内腰椎间盘区域无退变畸形。然后进行矢状位T1-TSE-SPIR(TR/TE=400 ms/7.8 ms,层厚/层间距 =4.0 mm/0.6 mm,扫描时间为211 s)平扫。之后行DCE-MRI,经耳缘静脉留置针注射增强造影钆贝葡胺(离子型、分子量1058.17),剂量为0.3 mmol/kg。以推注完造影剂后扫描作为 0 min,分别于 0 min、5 min、10 min、30 min、1 h、1.5 h、2 h、2.5 h、3 h、3.5 h 扫描,序列为矢状位T1-TSE-SPIR,参数与平扫时完全相同。全部实验用时约5~7 h。
1.3 MRI分析
扫描结束后选取腰椎正中矢状位层面,感兴趣区(region of interest,ROI)分别选取相应椎间隙上下椎体、上下软骨终板区、髓核共五个区域。按照观察部位形态,椎体及终板区 ROI选取矩形,像素数目分别为80和12个;髓核区ROI选取椭圆形,像素数目为16个。在水模区放置矩形 ROI,像素数目为100个左右。选取 ROI时避免容积效应影响(见图1)。在相同的窗宽窗位下分别测量并记录不同时间点扫描野内显示清晰的腰椎间盘各自5个ROI信号强度值。绘制椎体、软骨终板区及髓核时间-信号强度曲线。
1.4 统计学分析
统计处理使用SPSS 13.0统计软件。P<0.05认为有统计学意义。

图1 髓核及水模ROI选择示意图Fig.1 Diagram of the selection of ROI in nucleus pulpous and water model
2 结果
8只山羊均顺利的完成了实验,实验后拔除耳部静脉留置针及气管插管,约5 min后山羊清醒。
2.1 髓核纳入
在扫描野内,8只羊共计32个显示清晰并无发育畸形,髓核退变的腰椎间盘纳入本研究。
2.2 正常山羊腰椎间盘形态观察
在T2WI-TSE-SPAIR序列上髓核呈均匀高信号,形状为椭圆形,外周纤维环及软骨终板呈低信号(图2A);在 T1-TSE-SPIR序列上正常腰椎间盘可见,与T2-TSE-SPAIR显示相近。髓核与椎体间可见条带状低信号区,本研究将此区域定为软骨终板区(图2B)。
2.3 MR动态增强扫描各个区域信号强度变化
静注钆贝葡胺后,上下椎体信号强度均在0 min时迅速达到高峰然后较快下降,于1 h开始逐渐上升,于2 h出现第二个较低峰值,随后逐渐下降。上下椎体信号强度变化趋势基本一致。上下软骨终板区在10 min时缓慢达到较缓峰值,轻微下降后较快上升到2 h出现第二个峰值。上下软骨终板区曲线未重叠,下软骨终板区信号强度高于上终板区。髓核在5 min内显示为负值,之后缓慢上升,至30 min时上升增快,于2 h达到高峰,随后逐渐下降。(图2C)。各感兴趣区的值进行统计学处理后,描绘出时间-信号强度曲线(图3)。
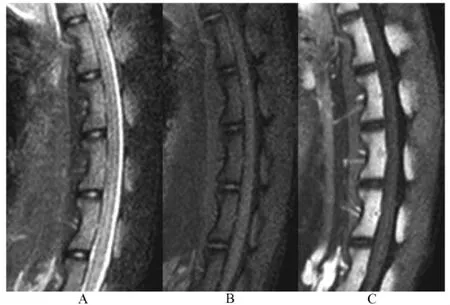
图2 MR扫描序列示意图Fig.2 Diagram of the MR scanning sequence
3 讨论
许多研究表明椎间盘的营养主要通过终板途径,终板的退变与椎间盘退变也有着密切的关系。Horner等[3]研究表明,髓核细胞的密集程度受营养物质多少的调节,营养物质的减少会导致髓核细胞活性的下降以及细胞数目的减少,进而导致椎间盘的退变。Benneker等[4]研究发现椎间盘骨性终板内通道的大小、密度同退变密切相关,通道的阻塞可能是细胞营养不足、基质合成下降而导致髓核退变的原因。
但是Hutton等阻断犬的单侧终板营养途径长达70周,在解剖学及形态学上却未发现明显椎间盘退变[5]。因此对椎间盘终板途径的研究以及该途径与椎间盘退变的关系的研究有着重要的价值。
3.1 实验动物的选择
应用实验动物模型,通过控制动物种类、年龄、性别、体重、饲养环境、活动范围等因素,限制活动,可以很好地、有效地控制非实验因素,保留实验因素。椎间盘退变动物模型要求与人类的椎间盘退变及突出具有相似性和可比拟性,应包括以下几个方面:(1)能再现椎间盘退变的组织学特征和椎间盘突出的形态学特征;(2)模型重复性好;(3)所选动物解剖和生理特点尽可能与人类近似[6]。用与人类最相近的灵长类动物(猴)建立椎间盘退变模型很理想,在生物进化方面同人类的亲缘关系密切,且其腰椎间盘与人类在生物化学、机械力学特性方面类似,是用于制作椎间盘退变模型理想的动物[7]。但因经济、法律因素其应用受到一定限制。近10余年来,倾向于选择猪、羊或犬等较大动物建立椎间盘突出和退变模型[8-9]。山羊除了具有性格温顺、易于饲养和管理,价格相对较便宜,饲养成本低,体形大,可以反复获取血、尿标本和组织标本等优点外,重要的一点是山羊可以在长时间镇静麻醉的情况下进行MRI动态增强扫描,并且影像学资料清晰、较易分辨。本实验时间长达5~7h之多,山羊显示出良好的耐受性。本实验选用24月龄的山羊,相当于人的青春期,此阶段椎间盘结构稳定,且尚未开始发生退行性改变。
3.2 DCE-MR在髓核营养机制的研究
最早的椎间盘营养通路研究是通过将荧光或放射活性标记物注入动物椎间盘来进行的研究证实,标记物从椎体和纤维环外周的组织渗透入椎间盘[10-11]。近年来,越来越多的研究运用磁共振技术。DCE-MRI通过测量顺磁性造影剂进入椎间盘的快慢及多少反映椎间盘的营养扩散过程,具有可重复、无创、可定量分析的优点,是一种新的研究椎间盘营养机制的方法[12]。
3.2.1 椎体时间-信号强度曲线:磁共振造影剂经静脉进入血循环后,通过两个途径到达椎体:自脊动脉发出的分支经椎体后正中进入椎体;自腰动脉、肋间动脉发出的分支经椎体前外侧进入椎体。进入椎体的血管呈水平位向椎体中心分布,相互吻合后以放射状向上下发出树枝样分支,分别伸向椎体两端,进而在椎体终板及其下吻合成血管网襻[13]。因此在造影剂进入血循环后,椎体磁共振信号强度即迅速达到高峰,之后随着血药浓度的逐渐下降。于1h时曲线逐渐上升,至2h时到达第二高峰,推断此过程形成可能是由于造影剂随髓核代谢排除,经终板逆向到达椎体,而此峰值显著低于第一高峰。
3.2.2 终板区时间-信号强度曲线:椎体的血管在椎体终板及其下吻合成血管网襻,然后伸入软骨终板而形成血管芽状结构,其数目的多少也决定了软骨终板的渗透性[14]。软骨区终板内血管芽呈膨大交错,具有很大的接触面积,因而渗透性比较高。内层纤维环区的血管芽仅呈单一的襻状结构,其接触面小,则渗透性较低。毛细血管和营养管道内的营养成分必须通过扩散作用穿过高密度的透明软骨终板(对流机制相对次要),才能到达椎间盘的细胞外基质。从终板区域时间-信号强度曲线上看,注射完造影剂后,曲线缓慢上升,在10 min时达到第一个高峰,之后缓慢小幅下降,在1 h后开始较快上升,2 h到达第二高峰,然后快速下降。第二高峰较第一高峰明显高且陡峭。此曲线变化可能是由于椎体终板和软骨终板血管芽的血管直径小,造影剂由椎体血窦进入的速度减慢,故整个过程中终板区造影剂浓度及上升速度均小于椎体。因而终板区域时间信号-强度曲线缓慢上升并在10 min达较小峰值。之后,由于扩散的延迟和血药浓度的快速下降,造成终板区造影剂浓度下降,故曲线表现为缓慢下降,但仍维持在较高水平。随着造影剂进入髓核,同时部分造影剂又随代谢物向外排出,曲线于1 h后出现第二次上升,并在2h达到动态平衡,形成第二个高峰。此后进入髓核的造影剂明显减少,而随着代谢产物排出的造影剂增多,曲线开始下降。

图3 山羊腰椎间盘时间-信号强度曲线Fig.3 The time-intensity curve of five ROIs
3.2.3 髓核区时间-信号强度曲线:髓核时间-信号强度曲线在5 min内低于平扫信号强度水平,其可能的原因是在5 min内椎体及周围软组织结构出现显著强化,而在此时间点处髓核内造影剂浓度极低。椎体及周围软组织的增强效应对髓核产生“负干扰”,从而导致髓核的信号强度值出现一过性下降。5min后呈缓慢强化,考虑终板内造影剂逐渐缓慢向髓核扩散。至30 min时出现快速的强化,2h时达到高峰,之后逐渐下降,考虑在2 h时造影剂在髓核内浓度达到最高。髓核强度的增加发生在椎体及终板区第一个峰值之后,表明营养成分主要从终板弥散而来,说明髓核的营养是很缓慢的过程。山羊髓核的时间-信号强度曲线同 Rajasekaran等[12]通过 MRI研究人腰椎间盘营养物质的扩散过程相似。说明山羊腰椎间盘营养途径与人类相似。但本研究与Rajasekaran等研究所描述的时间-信号强度曲线有所不同,髓核高峰明显提前到2 h,到达高峰后即出现较明显的下降。可能基于以下原因:(1)可能是由于山羊的软骨终板的厚度(细胞层数)较人类薄,髓核明显小于人腰椎髓核,造影剂较容易达到饱和,因此较早到峰值;(2)本实验研究选用的造影剂为新型双相对比剂钆贝葡胺(Gd-BOPTA),含有苯氧基:属于芳香环类化合物,具亲脂性,可与血浆蛋白尤其是白蛋白发生可逆性结合,从而使其的弛豫率明显高于其他钆类顺磁性对比剂[15]。De[16]指出该苯环在Gd-BOPTA代谢中起着分子调控的作用,它可使肝细胞选择性吸收Gd-BOPTA分子,并将其经胆系排泄,具体吸收机制同胆红素代谢,即通过肝细胞膜上的管状多特异有机阴离子转运通道来实现。由此推测钆贝葡胺可能与髓核中带有较高的固定负电荷的蛋白多糖的代谢有关,但其作用机制尚待进一步研究。
3.3 磁共振设备的稳定性的评价
理论上讲,磁共振扫描过程中存在磁场的不稳定性。另外山羊在全麻状态下,躯体被体线圈包裹,实验时间长达数小时,体温、汗液等对磁场有一定的干扰,因而信号强度值也会相应发生变化。基于以上原因,本实验在山羊腰椎背侧放置水模,以此来半定量评价磁共振设备的稳定性,以便得到可信的信号强度测量值。
总之,本实验通过DCE-MRI技术研究了山羊腰椎间盘营养物质进入及代谢产物运出的动态过程,初步阐明了山羊腰椎间盘软骨终板途径,对进一步研究营养在椎间盘退变中的作用和建立山羊椎间盘退变动物模型奠定实验基础。
[1] Diwan AD,Parvataneti HK,Khan SN,et al.Current concepts in intervertebral disc restoration [J].Orthop Clin North Am,2000,31:453-464.
[2] Buckwalter J A.Aging and degeneration of the human intervertebral disc[J].Spine,1995,20(11):1307.
[3] Horner HA,Urban JPG.2001 Volvo Award winner in basic science studies:Effect of nutrient supply on the viability of cells from the nucleus pulposus of the intervertebral disc[J].Spine,2001,26(23):2543-2549.
[4] Benneker LM ,Heini PF,Alini M,et al.2004 Young Investigator Award Winner:vertebral endplate marrow contact channel occlusions and intervertebral disc degeneration[J].Spine,2005,30(2):167-173.
[5] Hotton WC,Murakami H,Li J,et al.The effect of blocking a nutritional pathway to the intervertebral disc in the dog model[J].Spinal Disord Tech.2004,17(1):53-63.
[6] Singh K,Masuda K,An HS.Animal models for human disc degeneration [J].Spine,2005,5(6 Suppl):267-279.
[7] Lauerman WC,Plateberg RC,Cain JE,et al.Age-related disk degeneration:preliminary report of a naturally occurring baboon model[J].Spinal Disord,1992,5(2):170-174.
[8] Cinotti G,Della RC,Romeo S,et al.Degenerative changes of porcine intervertebral disc induced by vertebral endplate injuries[J].Spine,2005,30(2):174-180.
[9] Holm S,Holm AK,Ekstrom L,et al.Experimental disc degeneration due to endplate injury[J].Spinal Disord Tech,2004,17(1):64-71.
[10] Urban JP,Smith S,Fairbank JC.Nutrition of the intervertebral disc[J].Spine,2004,29(23):2700-2709.
[11] Urban MR,Fairbank JC,Etherington PJ,et al.Electrochemical measurement of transport into scoliotic intervertebral discs in vivo using nitrous oxide as a tracer[J].Spine,2001,26:984-990.
[12] Rajasekaran S,Naresh-Babu J,Murugan S.Review of postcontrast MRI studies on diffusion of human lumbar discs[J].J Magn Reson Imaging,2007,25(2):410-418.
[13] Kurunlahti M,Kerttula L,Jauhianen J,et al.Correlation of diffusion in lumbar intervertebral disks with occlusion of lumbar arteries: a study in adult volunteers[J].Radiology 2001,221:779-778.
[14] Holm S,Holm AK,Ekstrom L,et al.Experimental disc degeneration due to endplate injury[J].Spinal Disord Tech,2004,17:64-71.
[15] Spinazzi A,Davies A,Villa A,et al.Current status and future perspectives of research for new MR contrast media[J].Radiol Med,1997,93(1):36-45.
[16] De Haen C,La Ferla R ,Maggioni F.Gadobenate dimeglumine 0.5 M solution for injection(MultiHance)as contrast agent for magnetic resonance imaging of the liver:mechanistic studies in animals[J].Comput Assist Tomogr,1999,23:169-179.
Dynamic contrast-enhanced-MRI observation of the nutrition approach for lumbar intervertebral disc cartilage in normal goat
DU Heng1,MA Shao-hui2,GUAN Min2,YIN Zhan-hai1,HAN Bo3,YANG Guang-fu3,ZHANG Ming2,LIU Miao1
(1.Department of Orthopaedics,2.Department of Medical Imaging,the First Affiliated Hospital of Medical College,Xi′an Jiaotong University,Xi′an 710061,China;3.Department of Radiology,Xi′an Gaoxin Hospital,Xi′an 710075)
Objective To study the nutrition approach for lumbar intervertebral disc cartilage in normal goat.Methods Eight 24-month-old healthy adult goats were included in this study.There were four lumbar intervertebral discs for each goat,and there were a total of 32 lumbar intervertebral discs.After anesthesia of the goats,The signal changes of regions of interest were observed by dynamic contrast-enhanced magnetic resonance scan.On the time points before enhancement,and 0 min,5 min,10 min,30 min,1 h,1.5 h,2 h,2.5 h,3 h,and 3.5 h after enhancement,the ROI signal intensities were measured,respectively,and values of the time-signal intensity curve and the peak time were analyzed.Results Magnetic resonance signal intensity in the vertebrae reached a peak at 0 min and decreased rapidly afterwards.The signal intensity in cartilage endplate zone reached the first peak at 30 min,and slow down slightly afterwards,and then raised to the second peak at 2 h.The signal intensity in nucleus was negative within 5 min,and increased slowly to a peak at 2 h,and then declined.Conclusion The lumbar intervertebral disc of normal goat carries on nutrient metabolism mainly through the cartilage end-plate channels.
Dynamic contrast-enhanced MRI;Nucleus pulpous;Intervertebral disc;Cartilage endplate;Gadobenate dimeglumine(Gd-BOPTA);Goat;Nutrition
Q95-33,R-332
A
1005-4847(2011)02-0115-05
10.3969/j.issn.1005-4847.2011.02.007
椎间盘退变是颈、腰椎病发生发展的根本原因,不同程度的影响患者的生活质量[1]。许多研究表明,椎间盘退变与营养供应减少、细胞凋亡失衡、基质酶活性改变、生物力学机制及自身免疫反应有关。营养物质的减少被认为是诸多因素导致椎间盘退变的最终途径[2]。MRI动态增强扫描(dynamic con-trast-enhanced MRI,DCE-MRI)作为一种无创、可重复的方法,逐渐被用于研究椎间盘的营养机制。本实验通过对正常山羊腰椎间盘进行无创的DCEMRI,研究正常山羊腰椎软骨终板营养途径。
陕西省科技攻关项目【2007K14-01-(3)】。
杜恒(1974-),男,陕西西安人,在读博士,主治医师。研究方向:脊柱外科。E-mail:duheng18@yahoo.com.cn
2010-08-13
