不同毒力疟原虫感染早期根治性治疗对再感染体液免疫应答的影响
2011-09-25刘英杰李莹潘艳艳郑丽刘军单风平曹雅明
刘英杰,李莹,潘艳艳,郑丽,刘军,单风平,曹雅明*
( 1.中国医科大学基础医学院病原生物学教研室,辽宁沈阳110001 ; 2.中国医科大学基础医学院免疫学教研室,辽宁沈阳110001 )
不同毒力疟原虫感染早期根治性治疗对再感染体液免疫应答的影响
刘英杰1,李莹2,潘艳艳2,郑丽2,刘军2,单风平2,曹雅明2*
( 1.中国医科大学基础医学院病原生物学教研室,辽宁沈阳110001 ; 2.中国医科大学基础医学院免疫学教研室,辽宁沈阳110001 )
为探讨不同毒力疟原虫感染早期根治性治疗对再感染体液免疫应答的影响,用致死型和非致死型约氏疟原虫感染DBA/2小鼠,感染后3 d进行根治性治疗,并于初次感染后90 d进行再感染。计数红细胞感染率和检测再感染前(0 d)和再感染后(1、3、5 d)不同时间点脾细胞中活化性B细胞百分率以及血清中IgG、IgG1和IgG2a水平,结果显示,再感染后2组小鼠均出现短暂的低水平虫体血症,再感染后第3天活化性B细胞、IgG、IgG1和IgG2a均出现有意义的升高,但在每一相同检测时间点,2组小鼠的虫体血症、活化性B细胞百分率、IgG、IgG1和IgG2a水平均没有显著差异。这些结果表明,不同毒力疟原虫感染早期的根治性治疗并不影响宿主在再感染时产生有效的体液免疫应答,强毒株原虫感染也能获得与弱毒株相同的可抵御再感染的能力。
不同毒力疟原虫;根治性治疗;再感染;体液免疫应答
我国流行的疟疾主要由恶性疟原虫和间日疟原虫感染所致,但2个虫种的毒力存在明显差异,其中前者毒力较强,是导致脑疟等严重并发症发生的主要虫种。疟疾流行的显著特征是反复感染普遍存在。与恶性疟感染相比,机体针对间日疟感染产生保护性免疫应答更为迅速,其抵御再感染的能力也明显优于恶性疟感染者[1]。这表明原虫毒力差异与抵御再感染的保护性免疫建立存在密切相关性。特异性抗体是抵御再感染的主要效应分子[2],但毒力不同虫株感染早期根治性治疗后,其在再感染过程中体液免疫应答是否存在差异,目前尚未见明确报道。致死型约氏疟原虫(Plasmodium yoelii 17XL,P.y17XL)和非致死型约氏疟原虫(Plasmodiumyoelii 17XNL,P.y17XNL)分别与恶性疟原虫和间日疟原虫具有相似的生物学特性[3]。为此,对P.y17XL和P.y17XNL感染早期DBA/2小鼠进行根治性治疗,然后用同种疟原虫进行再感染,通过对再感染前后体液免疫应答相关分子水平进行检测,探讨了毒力不同疟原虫感染早期的根治性治疗对再感染体液免疫应答的影响。
1 材料与方法
1.1 材料
1.1.1 试材雌性,6~8周龄DBA/2小鼠,购自中国医学科学院实验动物研究所;P.y17XL和P.y17XNL由日本爱媛大学分子寄生虫学教研室惠赠。
1.1.2 药品与试剂氯喹和青蒿琥脂片分别购自上海中西药业有限公司和广西桂林药业有限公司;细胞荧光标记抗体、HRP-羊抗鼠IgG(IgG1或IgG2a)及底物均购于BD Pharmigen。
1.2 方法
1.2.1 小鼠感染和治疗及再感染小鼠经腹腔分别接种P.y17XL和P.y17XNL(1×106)寄生的红细胞,尾静脉采血,观察红细胞感染率。初次感染后3 d,经口给药(青蒿琥脂片60 mg/kg,氯喹90 mg/kg)治疗,每天1次,连续3 d,待初次感染后90 d,小鼠用同种疟原虫再次感染。
1.2.2 血清收集心脏采集再感染前(0 d)和再感染后第1、3、5天小鼠血液。收集血清,待抗体检测。
1.2.3 脾细胞中活化性B细胞百分率的检测无菌取出上述时间点小鼠脾脏,制备脾细胞悬液,调脾细胞终浓度为1×107/mL。每份样品用Per-CP-conjugated anti-mouse B220和PE-conjugated anti-mouse CD69进行双色分析。在预先加入封闭抗体的染色管中加入脾细胞悬液0.1 mL,再加入抗B220-PerCP和抗CD69-PE mAb进行表面染色,流式细胞仪检测。
1.2.4 血清抗体检测以P.y17XL和P.y17XNL抗原(10 μg/mL)包被酶标板,常规加入抗血清(1∶100稀释)、HRP-羊抗鼠IgG(IgG1或IgG2a)、底物、终止液,酶标仪检测492 nm处OD值。
1.2.5 统计学处理应用SPSS11.5统计学分析软件,Student’s-t检验比较各组均值的显著性差异,P<0.05为差异显著(结果为3次结果的均值)。
2 结果与分析
2.1 小鼠再感染后不同时间的原虫血症水平
如图1所示,感染早期根治性治疗小鼠在再感染过程中均出现了短暂的低水平虫体血症。在再感染后每一检测时间点,不同毒力虫株的虫体血症水平基本相似,并均于攻击后第6天左右自愈;而未治疗初次感染小鼠的虫体血症水平持续升高。这表明,毒力不同疟原虫初次感染早期根治性治疗的小鼠对同种疟原虫的再感染具有相似的抵抗力。
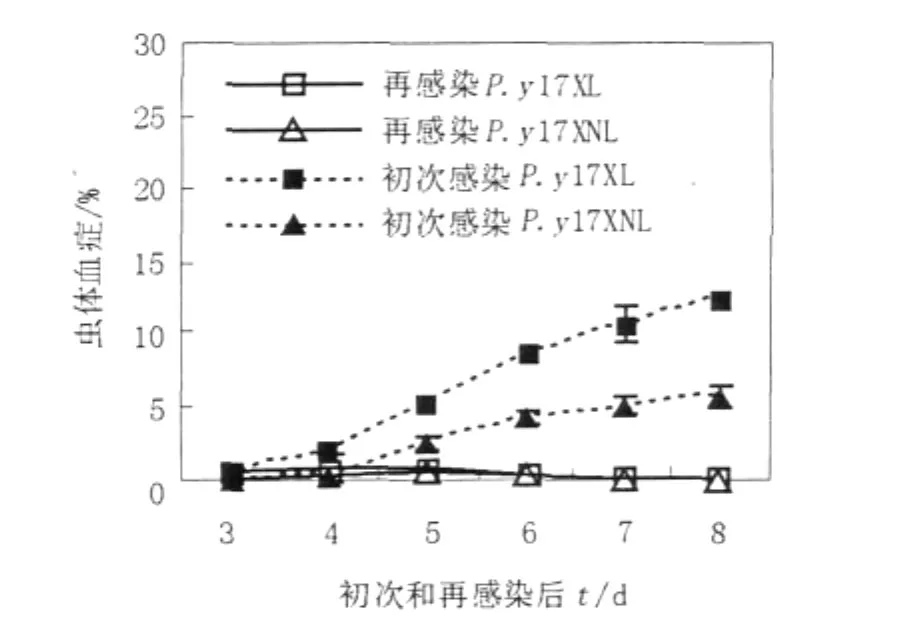
图1 P.y17XL和P.y17XNL初次感染和再感染后的虫体血症水平Fig.1The levels of parasitemia after primary infection and reinfection with P.y17XL and P.y17XNL
2.2再感染前后不同时间点脾细胞中活化性B细胞的百分率
如图2所示,与未感染的正常小鼠或再感染前小鼠相比,再感染后第3天小鼠脾细胞中活化性B细胞百分率即出现了有意义的升高(P<0.01),表明再感染前小鼠体内存在一定数量的记忆性B细胞;但其此后进一步升高,则提示除记忆性B细胞活化外,可能又有一些初始B细胞开始活化。尽管P.y17XL再感染鼠的活化性B细胞百分率略高于P.y17XNL再感染鼠,但没有显著性差异。这表明毒力不同虫株感染早期根治性治疗后,其毒力强弱未使宿主在再感染时B细胞的活化水平产生明显变化。
2.3 小鼠再感染前后不同时间点特异性IgG和IgG1以及IgG2a水平
如图3(ABC)所示,与未感染的正常小鼠相比,2种小鼠再感染前血清中即存在高水平IgG、IgG1和IgG2a(*P<0.05或**P<0.01);与再感染前相比,感染后第3天这些抗体明显增加(☆P<0.05或☆☆P<0.01),此后继续升高,这与活化性B细胞百分率的升高完全同步。在每一检测时间点,不同毒力虫株感染鼠的这些抗体水平基本相似。
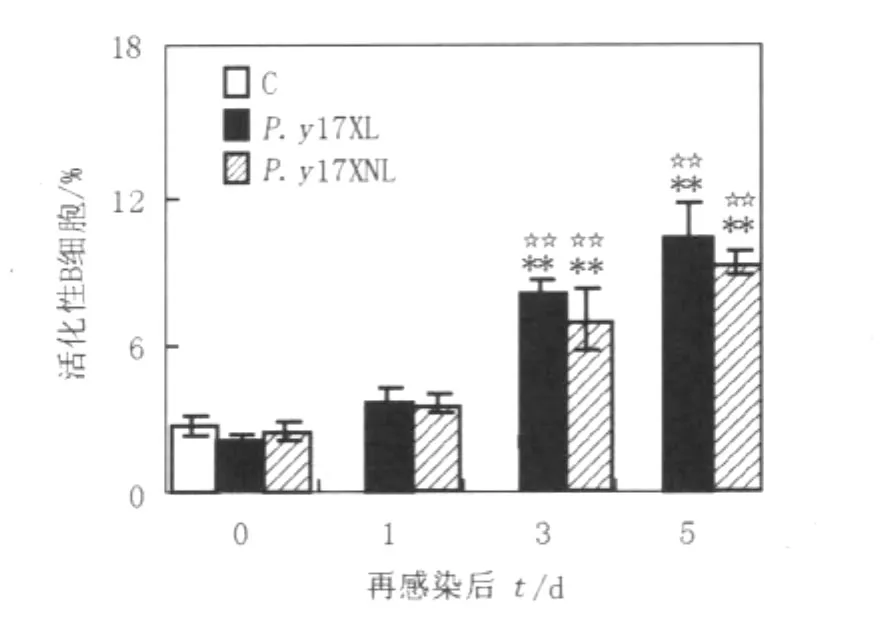
图2 再感染前后不同时间点脾细胞中活化性B细胞的百分率Fig.2The percentage of actived B cells in spleen cells from mice pre-and post-reinfection with P.y17XL and P.y17XNL at different time points

图3 小鼠再感染前后不同时间点特异性IgG和IgG1以及IgG2a水平Fig.3The levels of specific IgG and IgG1 as well as IgG2a in sera from mice pre-and post-reinfection with P.y17XL and P.y17XNL at different time points
3 讨论
有资料显示,间日疟再感染后的虫荷水平仅为初次感染后的1/10左右,并且患者没有明显的发热等临床表现[4];与初次感染相比,恶性疟再感染后的虫荷水平虽有所下降,但多数感染者仍具有较高的虫荷水平,同时有明显的发热等临床表现[5]。这表明,原虫毒力差异与再感染的保护性免疫效应存在密切相关性。本研究显示,P.y17XL和P.y17XNL感染早期根治性治疗后,其在同种疟原虫再感染过程中均出现短暂的低水平虫体血症,并且2种原虫的虫荷水平基本相同,表明初次感染早期根治性治疗后,小鼠获得了相似的抵御再感染的免疫保护。特异性IgG是抵御再感染的主要效应分子,尤其是IgG2a的免疫保护效应更强[6]。实验证实,在再感染后每一相同检测时间点,2组小鼠活化性B细胞百分率的升高幅度是相似的;IgG、IgG1和IgG2a水平在再感染前均明显高于正常对照鼠,并且在再感染后逐渐升高,但无论是再感染前或再感染后,2组小鼠的IgG、IgG1和IgG2a水平在相同检测时间点均无显著差异。有研究证明,强毒株疟原虫对宿主的免疫器官具有明显的损伤和破坏作用[3];抗原剂量可改变宿主的免疫应答类型和强度[7-8]。据此认为,当P.y17XL和P.y17XNL感染的红细胞在外周血出现时即进行根治性治疗可使小鼠受到相同虫荷的抗原刺激,同时也抑制了P.y17XL对小鼠免疫系统的破坏作用,因此2组小鼠在再感染时产生相似的免疫保护。
综上所述,疟疾感染早期根治性治疗并不影响宿主在再感染时产生有效的体液免疫应答,强毒株原虫感染也能获得与弱毒株相同的抵御再感染能力。
[1]Michon P,Cole-Tobian JL,Dabod E,et al.The risk of malarial infections and disease in Papua New Guinean children[J].Am J Trop Med Hyg,2007,76(6):997-1008.
[2]Reiling L,Richards JS,Fowkes FJ,et al.Evidence that the erythrocyte invasion ligand PfRh2 is a target of protective immunity against Plasmodium falciparum malaria[J].J Immunol, 2010,185(10):6157-6167.
[3]Schaecher K,Kumar S,Yadava A,et al.Genome-wide expression profiling in malaria infection reveals transcriptional changes associated with lethal and nonlethal outcomes[J].Infect Immun,2005,73(9):6091-6100.
[4]Collins WE,Jeffery GM,Roberts JM.A retrospective examination of reinfection of humans with Plasmodium vivax[J].Am J Trop Med Hyg,2004,70(6):642-644.
[5]Collins WE,Jeffery GM.A retrospective examination of secondary sporozoite-and trophozoite-induced infections with Plasmodium falciparum:development of parasitologic and clinical immunity following secondary infection[J].Am J Trop Med Hyg,1999,61(1 Suppl):20-35.
[6]Wipasa J,Hemsokana P,Ruankham T,et al.Investigation of memory responses following Plasmodium chabaudi AS infection in mice distinct in susceptibility to clinical malaria[J].Parasitol Res,2009,106(1):283-287.
[7]Pombo DJ,Lawrence G,Hirunpetcharat C,et al.Immunity to malaria after administration of ultra-low doses of red cells infected with Plasmodium falciparum[J].Lancet,2002,360 (9333):610-617.
[8]Freitas do Rosário AP,Muxel SM.Gradual decline in malariaspecific memory T cell responses leads to failure to maintain long-term protective immunity to Plasmodium chabaudi AS despite persistence of B cell memory and circulating antibody[J].J Immunol,2008,181(12):8344-8355.
Effect of Radical Cure in Early Phase of Primary Infection with Different Virulent Plasmodia on Humoral Immune Response to Homologous Reinfection
LIU Ying-jie1,LI Ying2,PAN Yan-yan2,ZHENG Li2,LIU Jun2,SHAN Feng-ping2,CAO Ya-ming2
(1.Teach.&Res.Div.of Pathogen Biol.; 2.Teach.&Res.Div.of Immun.,Coll.of Basic Med.Sci.,China Med.Uni.,Shenyang 110001)
In order to investigate the effect of radical cure in early phase of primary infection with different virulent plasmodia(Vp)on humoral immune response to homologous reinfection,DBA/2 mice were infected respectively with P.y17XL and P.y17XNL parasited erythrocytes,and radically cured on 3 d after infection.The mice were reinfected respectively with P.y17XL and P.y17XNL on 90 d after primary infection,then the level of parasitemia and specific IgG,IgG1 and IgG2a in sera as well as percentage of activated B cells in spleen cells were observed.The results showed that parasitemia in post-reinfection mice was transient and extremely low,and the percentage of activated B cells,specific IgG,IgG1 and IgG2a in these mice began to increase on 3 d of post-reinfection,however,in each testing time point the levels of parasitemia,IgG,IgG1 and IgG2a as well as the percentage of activated B cells from two groups of mice were not significantly different.These results suggested that radical cure in early phase of primary infection with different Vp had less effect on humoral immune response to homologous reinfection,Vp infection,being similar to low Vp infection,could also get the ability to resist reinfection.
different virulent plasmodia;radical cure;reinfection;humoral immune response
R382.3
B
1005-7021(2011)01-0102-04
刘英杰男,医学硕士,副教授。主要从事疟疾感染与免疫研究。E-mail:lyjcmu@yahoo.com.cn
*通讯作者。E-mail:yamingcao@yahoo.com.cn
2011-01-02;
2011-01-21
