1株甲基杆菌Methylobacterium sp.WGM16的鉴定及降解甲醇的最佳培养条件
2011-09-25田丹丹宋修鹏蒋承健古恒森李俊芳武波
田丹丹,宋修鹏,蒋承健,古恒森,李俊芳,武波
( 1.广西大学生命科学与技术学院,广西南宁530005 ; 2.微生物及植物遗传工程教育部重点实验室,广西南宁530005 ; 3.广西亚热带生物资源保护利用重点实验室,广西南宁530005 ; 4.广西民族大学化学与生态工程学院,广西南宁530007 )
1株甲基杆菌Methylobacterium sp.WGM16的鉴定及降解甲醇的最佳培养条件
田丹丹1,2,3,宋修鹏1,2,3,蒋承健1,2,3,古恒森1,2,3,李俊芳1,2,3,武波2,3,4*
( 1.广西大学生命科学与技术学院,广西南宁530005 ; 2.微生物及植物遗传工程教育部重点实验室,广西南宁530005 ; 3.广西亚热带生物资源保护利用重点实验室,广西南宁530005 ; 4.广西民族大学化学与生态工程学院,广西南宁530007 )
从水稻根部土壤中筛选到1株粉红色、需氧的兼性甲基营养型菌株WGM16,该菌为革兰阴性杆菌。根据菌株16S rRNA基因序列比对分析及结合菌株常规形态特征、生理生化性状的鉴定,将该菌初步鉴定为Methylobacterium sp.PCR扩增到菌株WGM16编码甲醇脱氢酶α-亚基的mxaF基因,表明菌株WGM16中存在甲基营养代谢途径。在培养温度为32℃、以1%的甲醇作为碳源、pH值为8.0的培养条件下,其甲醇降解率可达75%。
甲基杆菌;WGM16;鉴定;甲醇降解率
甲基营养菌是一类能够利用包含一个碳原子,或包含多个碳原子但碳原子之间却没有碳碳键的化合物作为唯一碳源和能源生长的微生物[1]。它们能够利用大多数生物不能够利用的一类物质,如甲醇、甲醛、甲胺、甲酸。甲基杆菌属是粉红色的、需氧的、革兰阴性杆状的兼性甲基营养菌[2]。甲基杆菌属除了能利用上述单碳化合物作为唯一碳源和能源进行生长外,也能够利用一系列广泛的多碳化合物作为底物生长。甲基杆菌在自然界中普遍存在,在各种环境中(如土壤、灰尘、淡水、湖泥、叶表、根瘤、稻谷、医院环境)都有存在[3]。它们能够代谢存在于植物碎屑中的微细产物。因此,甲基杆菌在自然界碳循环中起到重要的作用。甲醇、甲醛对人体和各种微生物都有毒性。甲基杆菌可通过其一碳代谢途径将甲醇、甲醛等进行代谢转化,因此可以利用其进行甲醇废水的处理。在利用单碳化合物作为碳源和能源生长的同时,其会代谢产生多种有益的副产物,如甲醇蛋白、多种辅酶、维生素B12、聚β羟基丁酸盐、各种氨基酸(L-丝氨酸、L-苯丙氨酸、L-赖氨酸、L-苏氨酸、L-谷氨酸)等[4]。本研究从水稻根部通过富集培养分离到了1株甲基杆菌WGM16,丰富了甲基营养菌的物种资源,可为研究甲基杆菌的一碳代谢途径提供材料。
1 材料与方法
1.1 材料
培养基①完全培养基:蛋白胨10 g/L,牛肉膏3 g/L,葡萄糖4 g/L,NaCl 5 g/L,pH 7.0;②基本培养基:(NH4)2HPO43 g/L,K2HPO42 g/L,NaCl 1 g/L,烟酸20 μg/L,VB110 μg/L,VB220 μg/L,泛酸钙20 μg/L,吡哆醇20 μg/L,生物素10 μg/L,对氨基苯甲酸10 μg/L,MgSO4·7H2O 0.2 g/L,FeSO4·7H2O 10 mg/L,MnSO4·4~6H2O 5 mg/L。
1.2 方法
1.2.1 菌株的分离及纯化取水稻根部附近1 g土样,用100 mL无菌水进行稀释,取1 mL稀释液加入到100 mL含1%无水甲醇的完全培养基中30℃富集3~4 d,然后涂布到以1%的无水甲醇为唯一碳源和能源的基本培养基的平板上,放入30℃恒温箱中培养3~4 d,挑选长势较好的菌株反复划线纯化。
1.2.2 菌株的鉴定①菌株形态特征及生理生化特征测定:见参考文献[5];②16S rRNA基因序列、mxaF基因序列及系统发育分析:用购自BioFlux的基因组DNA提取试剂盒提取纯化菌株的基因组DNA作为模板,用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')扩增该菌株的16S rRNA。用mxaF-f(5'-GCGGCACCAACTGGGGCTGGT-3')和mxaF-r(5'-GGGCAGCATGAAGGGCTCCC-3')扩增该菌株的mxaF基因。PCR产物电泳后用BioFlux公司的凝胶回收试剂盒纯化后送上海生工进行测序。测序结果在NCBI数据库中用BLAST进行比对,并用MEGA 4.0版本进行系统进化树分析。
1.2.3 菌株生长条件的优化以空白培养基为对照,将对数期生长的菌液(OD600=0.8)按1%的接种量接入到100 mL的三角瓶中,检测菌株在不同甲醇浓度、温度、pH下OD600的吸收值。
1.2.4 甲醇残余量检测用气相色谱法检测菌株对甲醇的利用情况。岛津GC-14C型气相色谱,FID检测器,高纯氮气为载气,固定液:OV-1701,担体:Chromosorb WAW DMCS。柱温:60℃,进样器:180℃,检测器:210℃。
2 结果与分析
2.1 WGM16的形态及生理特征鉴定
WGM16在固体基本培养基中,菌落圆形,不透明,粉红色,表面光滑,边缘整齐。光学显微镜下观察,细胞杆状。革兰阴性,有类脂粒(聚-β-羟基丁酸盐颗粒)。电镜下观察WGM16具有鞭毛(见图1)。WGM16具有Nm、Amp、Cb抗性。

图1 菌株WGM16在透射电镜下的照片Fig.1Transmission electron microscopy micrograph of strain WGM16
2.2 WGM16的分子生物学分析鉴定
2.2.1 16S rRNAPCR扩增WGM16的16S rRNA,连载体后送生工测序,得到1446 bp的片段。在NCBI中进行Blast比对发现与M.lusitanum MP2的16S rRNA有99%的序列相似性。
2.2.2 mxaF基因PCR扩增WGM16的mxaF基因连载体后测序得到530 bp的片段。在NCBI中进行Blast比对与Methylobacterium lusitanum strain MP2 methanol dehydrogenase有98%的序列相似性。
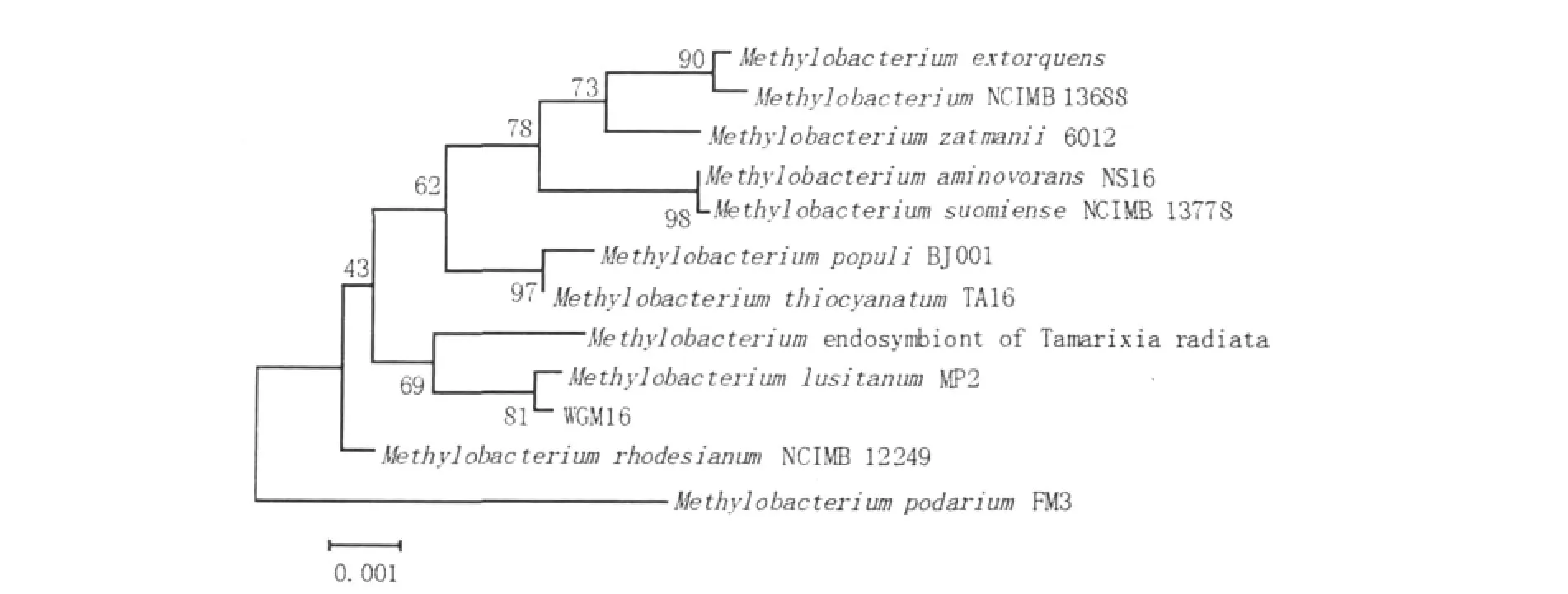
图2 根据16S rRNA序列构建的WGM16和甲基杆菌属其他相关菌株的进化树Fig.2Phylogenetic dendrogram obtained by 16S rRNA gene sequences,showing the position of strain WGM16 among its phylogenetic neighbours
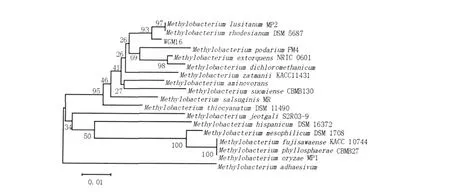
图3 根据mxaF基因序列构建的WGM16和其他相关菌株的系统发育树Fig.3Phylogenetic dendrogram obtained by distance-matrix analysis of mxaF gene sequences,showing the position of strain WGM16 among its phylogenetic neighbours
2.3 生理生化鉴定
根据细菌鉴定手册中鉴定甲基杆菌属的主要生理生化指标进行鉴定,如表1。结果发现菌株WGM16与甲基杆菌属主要指标都相符。表明WGM16为甲基杆菌属。
2.4 WGM16对碳源的利用情况
用Biolog公司的细菌鉴定仪对菌株WGM16做碳源情况分析,发现WGM16能利用D-麦芽糖、D-海藻糖、蔗糖、D-松二糖、棉子糖、N-乙酰-D-葡糖胺、α-D-葡萄糖、D-果糖、1%乳酸钠、D-丝氨酸、L-谷氨酸、L-焦谷氨酸、盐酸胍、L-乳酸、柠檬酸、D-苹果酸、溴-丁二酸、氯化锂、萘啶酮酸、亚碲酸钾、β-羟基-L-丁酸、丙酸、乙酸、氨曲南、丁酸钠。根据WGM16在进化树分支中的位置,比较WGM16与Methylobacterium lusitanum[6]、Methylobacterium thiocyanatum[7]、Methylobacterium rhodesianum[8]、Methylobacterium populi[9]对不同碳源的利用情况,如表2所示。
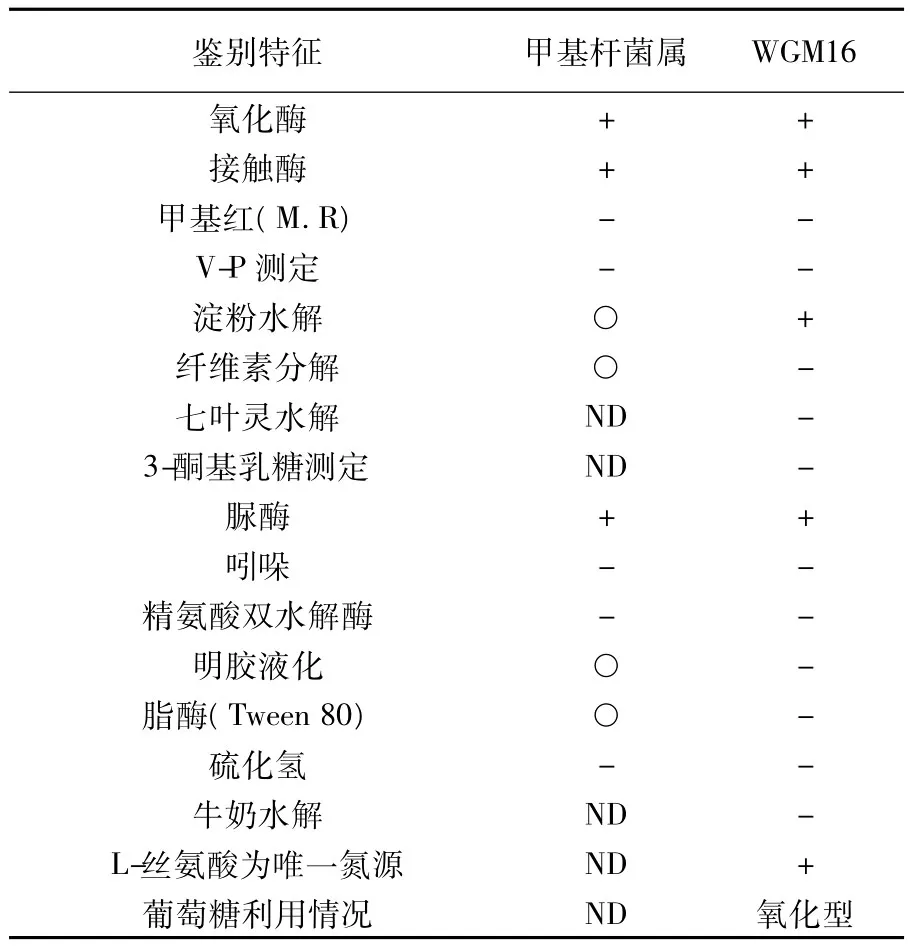
表1 WGM16和甲基杆菌属生理生化性质的比较Table 1Comparation of the physiological and biochemical of WGM16 with related Methylobacterium sp.members
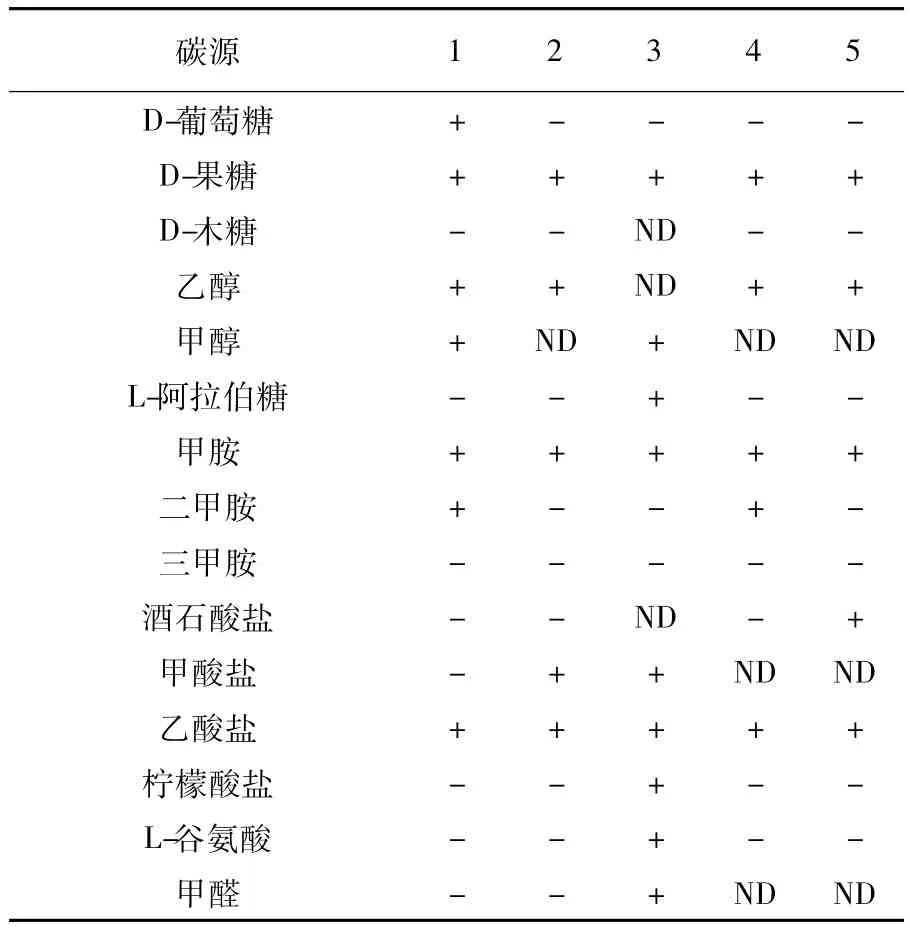
表2 甲基杆菌属对不同碳源底物的利用情况Table 2Differential carbon-substrate utilization among Methylobacterium species
2.5 甲醇降解的最佳培养条件
2.5.1 不同甲醇浓度对WGM16生长的影响
将WGM16接种于甲醇含量为1%、2%、3%为唯一碳源和能源的基本培养基上,pH 7.0,32℃摇床培养,每隔6 h测定菌株OD600。由图4可知,菌株WGM16在甲醇浓度为1%时长势较好。

图4 WGM16在不同甲醇浓度下的生长曲线Fig.4The growth curve of WGM16 on different content of methanol
2.5.2 不同pH对WGM16生长的影响将WGM16接种于1%的甲醇为唯一碳源和能源、pH分别为5、6、7、8、9的基本培养基中,32℃摇床培养,每隔6 h测定菌株OD600。菌株WGM16在pH 8.0时明显比其他pH时长势好,在pH 5.0及pH 6.0时基本不长,见图5。

图5 WGM16在不同pH下的生长曲线Fig.5The growth curve of WGM16 on different pH
2.5.3 不同温度对WGM16生长的影响将WGM16接种于1%的甲醇为唯一碳源和能源,pH 8.0的基本培养基上,分别放入28、30、32、37℃摇床中,每隔6 h测定菌株OD600。由图6可知,菌株WGM16在温度为32℃时长势明显比其他温度要好。

图6 WGM16在不同温度下的生长曲线Fig.6The growth curve of WGM16 on different temperature
2.6 WGM16的耐盐性分析
将WGM16接种于1%的甲醇为唯一碳源和能源,pH 8.0,NaCl浓度分别为1%、2%、5%、7%、10%的基本培养基中,32℃摇床培养,每隔6 h测定菌株OD600。由图7可知,菌株WGM16具有较高的耐盐性。
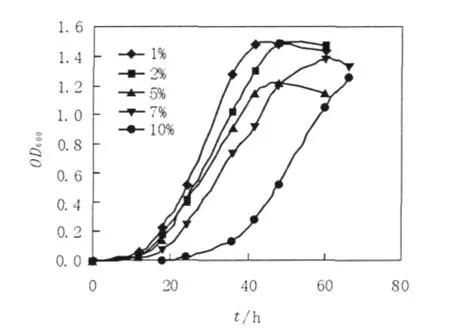
图7 WGM16在不同NaCl浓度的生长曲线Fig.7The growth curve of WGM16 on different content of NaCl
2.7 WGM16在不同时间对甲醇的降解情况
将WGM16按1%的接种量接种到1%的甲醇为唯一碳源和能源,pH 8.0的基本培养基中,32℃摇床培养,以空白培养基为对照,检测菌株WGM16在生长过程中甲醇的降解情况,发现最终可降解75%的甲醇,见图8。
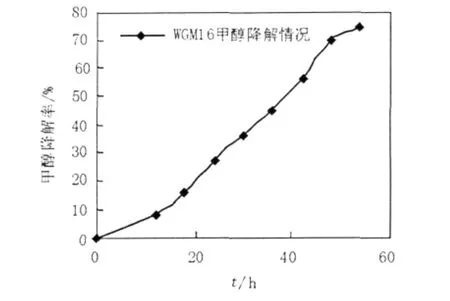
图8 WGM16在不同时间内的甲醇降解率Fig.8The degradation curve of methanol during the growth of WGM16
3 讨论
本研究从水稻根部土壤中筛选到1株产粉红色色素的兼性甲基营养菌。分析菌株16S rRNA序列和其在进化树中的位置以及与甲基杆菌属各项生理生化特征的比较,表明菌株WGM16属于甲基杆菌属。菌株WGM16在进化树中的位置与M.lusitanum最近,但是与M.lusitanum不同的是WGM16能够利用葡萄糖和二甲胺,而M.lusitanum却不能利用,WGM6不能够利用甲酸,M.lusitanum却能够利用。表明菌株WGM16可能是甲基杆菌属中的一个新种。PCR扩增到菌株WGM16编码甲醇脱氢酶α-亚基的mxaF基因,表明菌株WGM16中存在甲基营养代谢途径。菌株WGM16为微嗜碱性菌株,在pH为5.0和6.0时基本不长。在4℃和37℃时都不能生长。菌株WGM16有很高的耐盐性,1%≤NaCl浓度≤10%时都能生长。在1%的甲醇为碳源、pH 8.0、32℃时菌株WGM16长势最好。在此条件下对甲醇的降解率可达到75%。菌株WGM16能产生β-羟基丁酸盐颗粒,可为研究一碳代谢途径中PHB的循环奠定基础。同时该菌能够生产L-丝氨酸,但也能够利用L-丝氨酸作为氮源生长,对研究微生物发酵生产L-丝氨酸具有应用价值。
[1]Anthony,C.The biochemistry of methylotrophs[M].Academic Press,London,United Kingdom,1982,2.
[2]Green,p.N.The genus Methylobacterium[M].In The Pro-karyotes(2ndedn).New York:Springer,1999:2342-2349.
[3]Corpe,W.A.&Rheem,S.Ecology of the methylotrophic bacteria on living leaf surfaces[J].FEMS Microbiol Ecol,1989,(62):243-250.
[4]Green,P.N.Methylobacterium[J].Prokaryotes,2006,(5): 257-265.
[5]东秀珠,蔡妙英,等.常见细菌系统鉴定手册[M].北京:科学出版社,2001:353-398.
[6]Doronina,N V.Trotsenko,Y A.Tourova,T P,et al.Methylobacterium suomiense sp.nov.and Methylobacterium Lusitanum so.nov.,aerobic,pink-pigmented,facultativelymethylotrophic bacteria[J].Int J Syst Evol Microbiol,2002,(52):773-776.
[7]Ann P W,Donovan P K,Ian P M,et al.A novel pink-pigmented facultative methylotroph,Methylobacterium thiocyanatum sp.nov.,capable of growth on thiocyanate or cyanate as sole nitrogen sources[J].Arch Microbiol,1998,(169):148-158.
[8]Rock,J S.Goldberg,I.Ben-Bassat,A.et al.Isolation and characterization of two methanol-utilizing bacteria[J].Agric Biol Chem,1976,(40):2129-2135.
[9]Van Aken,B.Peres,C M.Lafferty Doty,S.et al.Methylobacterium populi sp.nov.a novel aerobic,pink-pigmented,facultatively methylotrophic,methane-utilizing bacterium isolated from poplar trees[J].Int J Syst Evol Microbiol,2004,(54):1191-1196.
Identification of a Methylobacterium sp.Strain WGM16 and Its Optimal Culture Conditions to Degrade Methanol
TIAN Dan-dan1,2,3,SONG Xiu-peng1,2,3,JIANG Cheng-jian1,2,3,GU Heng-sen1,2,3,LI Jun-fang1,2,3,WU Bo2,3,4
(1.Coll.of Life Sci.&Technol.,Guangxi Uni.,Nanning 530005; 2.Key Lab.of Microbial&Plant Gen.Engin.of Min.of Educ.,Nanning 530005; 3.Key Lab.of Subtrop.Bio-Res.Conserv.&Util.of Guangxi,Nanning 530005; 4.Coll.of Chem.and Ecol.Engin.,Guangxi Uni.for Nationalities,Nanning 530007)
A pink,aerobic,and facultative methylotrophic bacterium strain WGM16,was isolated and screened from rice’s root soil.It was Gram-negative rod.Comparison analysis of 16S rRNA gene sequence and physiological and biochemical characteristics combined with routine morphological,physiological and biochemical characteristics identification,the strain WGM16 was identified as a member of the genus Methylobacterium sp.PCR amplification showed the gene coding for the α-sub-radical of methanol dehydrogenase(mxaF)present in the strain WGM16,indicating there existed a methylotrophic metabolism.Under the conditions of temperature at 32℃,with 1%of methanol as carbon source,pH 8.0,the methanol degradation rate was as high as 75%.
Methylobacterium;WGM16;identification;methanol degradation rate
S154.3
A
1005-7021(2011)01-0028-06
广西青年科学基金资助项目(桂科青0832011);广西大学科研基金(X081074)
田丹丹女,硕士研究生。研究方向为分子生物学。
*通讯作者。Tel:0771-3239283,E-mail:wubogxu@yahoo.com.cn
2010-11-22;
2010-01-14
