大黄素甲醚对体外新生大鼠皮质神经元的营养作用
2011-09-14苏钜年赖永长薛小燕林炼峰罗焕敏
苏钜年, 赖永长,皮 婷, 薛小燕, 林炼峰, 罗焕敏,,3*
(1.暨南大学药学院神经药理研究室 广东 广州510632;2.暨南大学医学院药理学系 广东 广州510632;3.暨南大学-香港大学脑功能与健康联合实验室,广东广州510632)
何首乌含有二苯乙烯苷类、蒽醌类化合物等,具有抗氧化、抗衰老、保肝、调节免疫和降血脂等方面的生物学活性[1]。当前何首乌的研究大多都是集中在二苯乙烯苷类化合物的抗氧化和对神经作用的特性上[2],特别是何首乌的其他主要成分是否具有神经方面作用尚未阐明,大黄素甲醚作为何首乌蒽醌类化合物的成分之一,对脑缺血具有保护作用,提示可对大黄素甲醚的神经元营养作用作进一步研究。本研究采用无血清体外培养原代皮质神经元来观察大黄素甲醚对皮质神经元的存活及促突起生长的作用,以阐明其是否具有神经营养作用。
1 材料
1.1 药品与试剂 DMSO(北京鼎国);大黄素甲醚(中国药品生物制品检定所);DMEM/F12(美国Gibco);B27添加剂(美国Gibco);多聚赖氨酸(相对分子量7~15万,美国Sigma);胰蛋白酶(美国Amersco);MTT(美国Sigma);胎牛血清(天津市灏洋生物制品科技);单克隆兔抗大鼠神经元特异性烯醇化酶(NSE,武汉博士德);单克隆小鼠抗大鼠微管相关蛋白2(MAP2,美国Sigma);牛血清白蛋白(BSA)(博大泰克);即用型SABC免疫组化试剂盒(武汉博士德);RT-PCR试剂盒(TaKaRa,批号:DRR019A);DNA Marker(TaKaRa);腺苷受体抑制剂 ZM241385(Tocris Bioscience,批号:13A/100775);酪氨酸激酶抑制剂 K252a(美国 Sigma,批号:BCBB3202),其余试剂、药品均为国产分析纯。
1.2 动物 SPF级健康雌、雄SD大鼠,2~3月龄,体质量约200g,广东省实验动物中心,合格证号2007A003。
1.3 主要仪器 SW-CJ-1F型超净台(苏州净化设备),IX71倒置显微镜(日本奥林巴斯),24孔板、96孔板(美国Corning),培养箱(英国Galaxy S),酶标仪(美国BIO-RAD)。
2 方法
2.1 分离及培养方法 参考 Brewer等的方法[3-5],取12 h内新生大鼠,75%酒精中浸泡消毒20s。超净台内分离出大脑皮质,剥离脑膜并去除海马,D-hanks中浸洗,将其剪成约1 mm3大小,加入0.25%胰蛋白酶后35℃中消化,10min后用含有10%FBS的DMEM/F12培养基终止消化。过滤、离心后取得神经元,含0.4%B27的DMEM/F12培养基吹散细胞后用台盼蓝染色并计数活细胞数目,制成所需细胞浓度的均匀细胞悬浮液,在预先用0.1 mg/mL的多聚赖氨酸处理的孔板中接种神经元。接种后于细胞培养箱中培养。
2.2 神经元的鉴定 神经元培养48 h,加入4%多聚甲醛固定,PBS漂洗后加入30%H2O2与纯甲醇(1∶50)浸泡20 min,PBS漂洗后滴加山羊血清封闭液,孵育20 min,弃去上清液。加入1∶80的一抗PBS液,4℃湿盒内放置12 h。PBS漂洗,用辣根过氧化物酶标记羊抗兔IgG二抗,室温放置20 min,PBS漂洗,加入 SABC,置于湿盒中20 min后用PBS漂洗,再用DAB显色,PBS漂洗后镜下观察并拍照。
2.3 MTT比色法检测细胞活性 0.4%B27的 DMEM/F12培养基制成浓度为8×106细胞/mL的神经元细胞悬液,于预先多聚赖氨酸处理的96孔板中每孔100μL接种,4 h后换液同时加入终质量浓度0.5 μmol/L、1 μmol/L、2 μmol/L、4μmol/L大黄酸甲醚,并设定溶媒对照组和质量浓度10 ng/mL bFGF的阳性对照组。置于培养箱,继续培养96 h后,弃去培养基,每孔加入MTT(5 mg/mL DMEM/F12)100μL,继续培养4 h后弃清培养液,加入200μL二甲基亚砜(DMSO),充分振荡至晶体完全溶解,酶标仪570 nm波长下读取各孔吸光度值(A)[6]。每个组6个复孔,计算其平均值。
2.4 细胞形态学观察 大黄素甲醚溶解于DMSO,作用于神经元,使终浓度为1、2、4μmol/L,另设立溶媒对照组和10 ng/mL bFGF阳性对照组。加药72 h后,在显微镜(×400)下观察各组神经元生长情况,以胞体有光晕、长出突起的神经元为记录对象,每孔随机选取12个视野,每组4个复孔。用Image-pro plus6.0图像分析软件处理照片,测量出每组神经元平均突起长度[7-9]。
2.5 神经元RNA样品的制备 大黄素甲醚溶解于DMSO,作用于神经元,使终浓度为1、2、4μmol/L,另设立溶媒对照组和终浓度10 ng/mL bFGF组。培养4 d后,弃去培养液,每组加1 mL TRIzol裂解,再加200μL三氯甲烷混匀,高速离心(10 000×g,15 min),取其上清液,加等体积异丙醇混匀后离心沉淀(10 000×g,10 min),加入75%乙醇洗涤沉淀,超净台内晾干沉淀,加DEPC水溶解RNA。
2.6 引物的设计与合成 根据Genebank的序列,Primer5.0软件设计大鼠GADPH和MAP-2的引物(见表1),引物均委托英潍捷基(上海)贸易公司合成。

表1 大鼠MAP-2和GADPH的引物序列
2.7 测定 参照试剂盒说明书进行神经元MAP-2、GADPH mRNA量的测定、cDNA合成及PCR扩增。
2.8 神经营养作用机制的初步研究 按如下分组:K252a 100 nmol/L,ZM241385 20 nmol/L,大黄素甲醚 2 μmol/L,K252a 100 nmol/L+大黄素甲醚 2μmol/L,ZM241385 20 nmol/L+大黄素甲醚2μmol/L,溶媒对照组。分别作用于神经元,加药48 h 后按2.4 项方法处理[10-11]。
3 结果
3.1 体外培养大鼠大脑皮层神经元形态学观察和鉴定 新生大鼠大脑皮层神经元刚接种时胞体较小呈圆形,悬浮并均匀散布;接种4 h后开始贴壁,神经元分布均匀,多数神经元为圆形,少量细胞长出微小的突起。有少量的细胞碎片和红细胞,更换培养基的方法除去未贴壁的神经元、红细胞和细胞碎片。培养24 h后有突起的细胞明显增多,胞体变大,突起延长但仍较短小。培养48 h后,细胞胞体明显增大,多数呈梭形或圆梭形,每个细胞有2~4个突起,突起长度明显增加,开始出现神经网格。利用神经元特异性烯醇化酶(NSE)免疫细胞化学鉴定法鉴定接种48h的细胞,结果显示NSE阳性细胞占绝大多数,见图1,表明绝大多数细胞(>97%)是神经元。
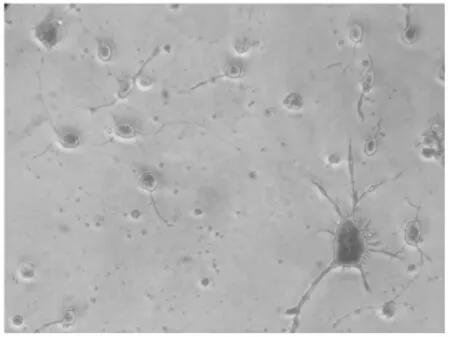
图1 新生大鼠皮质神经元的形态学观察及鉴定
3.2 不同浓度药物干预对神经元存活的影响 MTT法检测显示,在该培养条件下,大黄素甲醚各剂量组均可显著提高细胞活性,表明大黄素甲醚能促进神经元的存活(见表2)。
表2 大黄素甲醚对原代皮质神经元活性的影响 ( ± s,n=6)
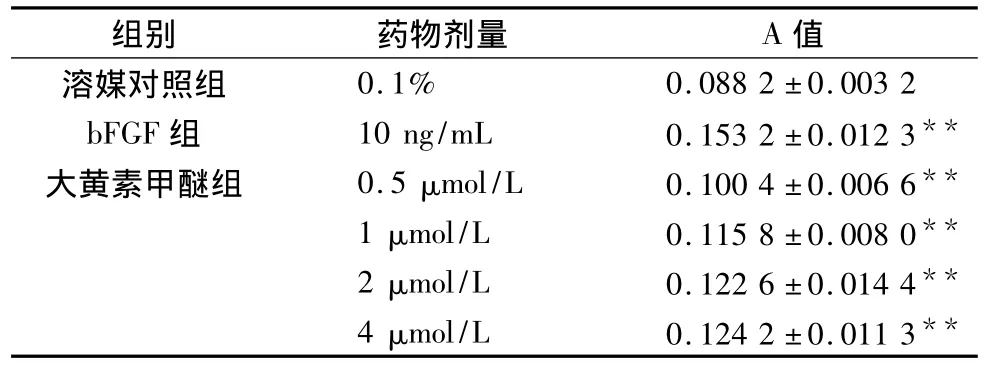
表2 大黄素甲醚对原代皮质神经元活性的影响 ( ± s,n=6)
注:与溶媒组比较,*P <0.05,**P <0.01。
组别 药物剂量 A值溶媒对照组0.1% 0.088 2 ±0.003 2 bFGF 组 10 ng/mL 0.153 2 ±0.012 3**大黄素甲醚组 0.5 μmol/L 0.100 4 ±0.006 6**1 μmol/L 0.115 8 ±0.008 0**2 μmol/L 0.122 6 ±0.014 4**4 μmol/L 0.124 2 ±0.011 3**
3.3 形态学定量分析 加药后72 h后,大黄素甲醚各剂量组突起长度明显增长,与溶媒对照组相比,均有显著性差异(P<0.01),各剂量组与 bFGF组之间无明显差异(P>0.18)。见表3,图2(A ~E)。
表3 大黄素甲醚对培养72 h大鼠大脑皮层神经元突起的影响( ± s,n=4)
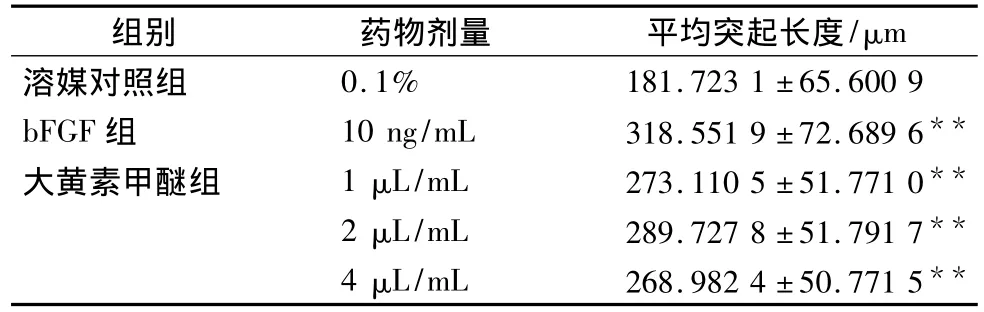
表3 大黄素甲醚对培养72 h大鼠大脑皮层神经元突起的影响( ± s,n=4)
注:与溶媒组比较,*P <0.05,**P <0.01。
组别 药物剂量 平均突起长度/μm溶媒对照组0.1% 181.723 1 ±65.600 9 bFGF 组 10 ng/mL 318.551 9 ±72.689 6**大黄素甲醚组 1 μL/mL 273.110 5±51.771 0**2 μL/mL 289.727 8 ±51.791 7**4 μL/mL 268.982 4 ±50.771 5**
3.4 大黄素甲醚对大脑皮层神经元MAP-2 mRNA表达的影响 从表4和图3中可看出,0.5μmol/L、2μmol/L、4μmol/L大黄素甲醚组MAP-2 mRNA与内参基因GADPH mRNA的含量百分比值较溶媒对照组显著上升(P<0.01)。
3.5 神经营养作用机制的初步研究 从表5中看出,K252a 100 nmol/L组或K252a 100 nmol/L+大黄素甲醚2 μmol/L组与溶媒组比较,突起长度无明显变化(P>0.05);ZM241385 20nmol/L组与溶媒组比较能缩短突起长度(P<0.01);大黄素甲醚2μmol/L组或ZM241385 20 nmol/L+大黄素甲醚2μmol/L组与溶媒组比较,能增加突起长度(P<0.01),且两组之间无统计学差异(P >0.05)。

A.DMSO溶媒对照组 B.大黄素甲醚1μmol/L组 C.大黄素甲醚2μmol/L组D.大黄素甲醚4μmol/L组 E.bFGF 10ng/mL组 标尺为50μmol/L
表4 大黄素甲醚对大鼠大脑皮层神经元MAP2 mRNA量的影响 ( ± s,n=3)

表4 大黄素甲醚对大鼠大脑皮层神经元MAP2 mRNA量的影响 ( ± s,n=3)
注:与溶媒组比较,*P <0.05,**P <0.01
组别 药物剂量 MAP-2/GADPH(%)溶媒对照组0.1% 2.34 ±0.12 bFGF 组 10 ng/mL 36.12 ±3.04**大黄素甲醚组 0.5 μmol/L 23.44 ±1.38**2 μmol/L 28.12 ±1.95**4 μmol/L 30.50 ±2.19**
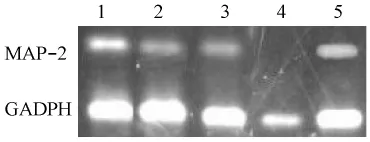
图3 凝胶电泳图片
表5 2种抑制剂对48 h大鼠大脑皮层神经元突起的影响( ± s,n=3)
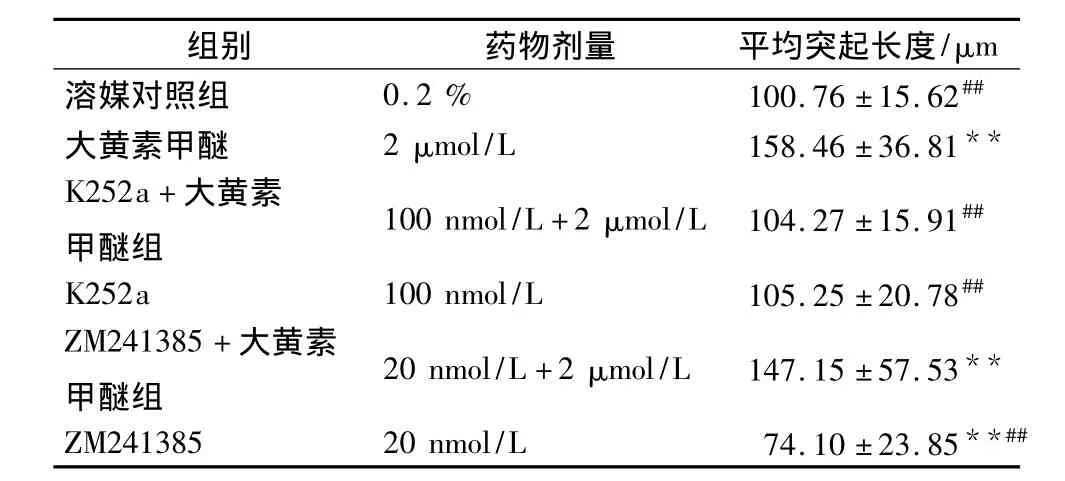
表5 2种抑制剂对48 h大鼠大脑皮层神经元突起的影响( ± s,n=3)
注:与溶媒组比较,*P <0.05,**P <0.01;与大黄素甲醚组比较,#P <0.05,##P <0.01
组别 药物剂量 平均突起长度/μm溶媒对照组 0.2% 100.76 ±15.62##大黄素甲醚 2 μmol/L 158.46±36.81**K252a+大黄素甲醚组100 nmol/L+2 μmol/L 104.27 ±15.91##K252a 100 nmol/L 105.25 ±20.78##ZM241385+大黄素甲醚组20 nmol/L+2 μmol/L 147.15 ±57.53**ZM241385 20 nmol/L 74.10 ±23.85**##
4 讨论
中医认为“肾生髓,脑为髓海”,“肾”与脑功能存在密切的联系。通过补肾添髓可以防治衰老引起的记忆力下降。何首乌味苦、甘、涩,性温。归肝、肾经。《开宝本草》中说其:“益气血,黑髭鬓,悦颜色。久服长筋骨,益精髓延年不老”。具有补益精血、涩精止遗、补益肝肾的作用。自古何首乌就被当成延年益智的药物。大黄素甲醚为何首乌的主要成分之一,本实验观察大黄素甲醚对体外培养的新生大鼠皮质神经元突起生长及存活的影响。形态学定量分析,细胞活性测定和MAP-2mRNA表达量的测定结果显示,与溶媒对照组相比,1~4μmol/L组均可以提高细胞活力、促进神经元突起的生长(P<0.01);bFGF与1~4μmol/L加药组相比,对神经元突起长度的影响无统计学意义(P>0.3);MAP2 mRNA电泳显示,各加药组和bFGF组与溶媒对照组相比,能明显增加MAP-2 mRNA表达的量(P<0.01),表明大黄素甲醚具有神经营养作用。在形态学分析中,可能是由于4μmol/L组存活的细胞较多,每个细胞生长的空间较少,抑制突触的生长,以致4μmol/L组比2μmol/L组的平均突起长度略短。
神经营养作用机制的初步研究中发现,加入腺苷受体抑制剂不能阻断大黄素甲醚促进对神经元突起生长的作用(与大黄素甲醚2μmol/L相比P>0.05);而加入酪氨酸激酶抑制剂能阻断大黄素甲醚促进对神经元突起生长的作用(与大黄素甲醚2μmol/L相比 P<0.01)。提示大黄素甲醚可能是通过直接或间接激活Trk受体起营养作用,而非通过腺苷受体起营养作用。
神经退行性疾病,如阿尔茨海默病、帕金森综合症、亨廷顿病等,都与神经突起和神经元的丢失相关,主要因为神经元缺乏营养或受到有害物质损伤引起。
内源性神经营养因子家族如NGF、BDNF等,在神经元生长、存活、分化,调节突触可塑性方面具有重要[12-13]。但外源性神经营养因子缺点也比较突出,如分子量大、不易透过血脑屏障、易引起疼痛等,致使它们在临床应用过程中受到很多限制。近年研究表明,有神经营养因子类似作用的小分子物质有预防突触丢失、突起损伤的作用,具有治疗神经退行性变的潜力。神经营养作用的小分子物质可以克服神经营养因子的上述缺点,用于治疗神经退行性疾病的潜力。大黄素甲醚为小分子中药单体,脂溶性好,具有一定的神经营养作用,但其作用机制还有待进一步研究。
[1]李秀琼.中药何首乌的研究进展[J].现代医药卫生,2008(24):365-366.
[2]王春英,张兰桐.何首乌中有效成分二苯乙烯苷的研究进展[J].河北医科大学学报,2008,29(1):157-160.
[3]Brewer G J,Torricelli JR,Evege E K,et al.Optimized survival of hippocampal neurons in B27 supplemented neurobasal,a new serum-freemedium combination[J].N eurosciRes,1993,35(5):567-576.
[4]Moriyama M,Huang JM,Fukuyama Y,etal.Structure and neurotrophic activity of novel sesqui-neolignans from the pericarps of Illicium fargesii[J].Tetrahedron,2007,63(40):4243-4249.
[5]Tang W X,Kubo M ,Fukuyama Y,etal.Novel NGF-potentiating diterpenoids from a Brazilian medicinal plant,Ptychopetalum olacoides[J].Bioorg Med Chem Lett,2009,19:882-886.
[6]肖 飞,翁 文,罗焕敏.五味子醇甲对β2淀粉样蛋白损伤PC12细胞的预保护及治疗作用[J].中药材,2010,33(3):397-401.
[7]陈美婉,罗焕敏,肖 飞,等.秋水仙素诱导的神经元突起溃变对Aβ分泌的影响[J].中国药理学通报,2008,24(12):1586-1591.
[8]Zhai H f,Nakatsukasa M,Fukuyama Y,et al.Neurotrophic effects of Talaumidin,a neolignan from aristolochia arcuata,in primary cultured rat cortical neurons[J].Planta Med,2004,70:598-602.
[9]Takaoka S,Takaoka N ,Fukuyama Y,et al.Isolation,synthesis,and neurite outgrowth promoting activity of illicinin A from the flowers of Illicium anisatum[J].Tetrahedron,2009,63(40):8354-8361.
[10]Huang E J,Zang K,Schmidt A,et al.Trk receptors:roles in neuronal signal transduction[J].Annu Rev Biochem,2003,72:609-642.
[11]Lecht S,Arien-Zakay H,Kohan M,et al.Angiostatic effects of K252a,aTrk inhibitor,in murine brain capillaryendothelialcells[J].Mol Cell Biochem,2010,339:201-213.
[12]Hempstead B L .Dissecting the diverse actions of pro-andmature neurotrophins[J]Curr Alzheimer Res,2006,3(1):19-24.
[13]Reichardt L F.Neurotrophin-regulated signalling pathways[J].Philos Trans R Soc Lond B Biol Sci,2006,361(1473):1545-1564.
