黄精低聚糖的分离纯化及理化性质研究
2011-09-14王彦志董晶晶刘富岗
王彦志, 董晶晶, 刘富岗, 杨 云
(河南中医学院药学院,河南郑州450008)
黄精Polygonti Rhizoma是百合科黄精属Polygonatum多种植物的根茎,《中国药典》(2010版)收载了滇黄精Polygonatum kingianum Coll.et Hemsl、黄精 Polygonatum sibiricum Red.或多花黄精Polygonatum cyrtonema Hua.的干燥根茎入药[1],在民间同属其它一些植物的根茎也被当作黄精使用。作为一种传统常用中药,其性平,味甘,入脾、肺、肾经,具有补肾益精、滋阴润燥等功效,临床上多作为滋阴补益药使用。所含化学成分丰富,有黄精多糖、皂苷、生物碱、醌类化合物、强心苷、木脂素、维生素和多种人体必需的氨基酸等化合物[2]。糖类是中药中普遍存在的成分,可分为单糖、低聚糖、多糖及其衍生物。作为构成生命体的最基本物质之一,糖类在生命过程中起着极其重要的作用,它不仅是能量储存和结构物质的存在形式,同时也作为生物信息的载体存在[3]。其中低聚糖因具有低热量、高稳定性、安全无毒等特点,近年来在保健、食品、医药等领域被广泛应用[4],关于低聚糖的研究和应用也越来越受到人们的关注,但是由于自身在组成、连接、衍生化、微观不均一性等方面的高度复杂性及其检测上的困难,致使其分离纯化研究较少[5]。近年来关于黄精低聚糖的分析尚未见报道,本实验首次对其分离纯化方法进行探索性研究,以期为低聚糖的综合开发利用提供科学依据。
1 仪器与试药
1.1 仪器 METTLER AE240电子分析天平(瑞士METTLER TOLEDO公司);DHG-9146A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);旋转蒸发器(上海亚荣生化仪器厂);Revco ULT 1386-3-V39型超低温冰箱(美国Thermo公司);Labconco Free Zone 6L真空冷冻干燥机(美国Labconco公司);UV-2201型紫外可见分光光度计(日本岛津公司)。
1.2 试药 黄精药材采集于河南省洛阳市栾川龙峪湾,经河南中医学院生药教研室董诚明教授鉴定为百合科黄精属植物黄精Polygonatum sibiricum Red.的干燥根茎。将采挖的新鲜黄精除去芦头、须根及泥沙,清蒸1 h后干燥,粉碎,过20目筛,备用。D101大孔吸附树脂(沧州宝恩化工有限公司);活性炭粉末(天津市福晨化学试剂厂);硅藻土(天津市永大试剂化学开发中心);薄层层析硅胶G(青海海洋化工有限公司);Sephadex LH-20(瑞典GE Healthcare公司);茚三酮(上海市灵锦精细化工有限公司);咔唑(国药集团化学试剂有限公司);葡萄糖(天津市科密欧化学试剂开发中心);蔗糖(天津市福晨化学试剂厂);果糖(南京药学院实验药厂);棉子糖(上海化学试剂厂);水苏糖(ACROSORGANICS,生产批号:226085000);其它试剂均为国产分析纯。
2 方法与结果
2.1 黄精中小分子糖的提取 称取黄精药材粉末500 g,加入12倍量80%乙醇,在85℃水浴条件下回流提取3 h,过滤,滤渣加10倍量的80%乙醇85℃水浴回流提取2 h,过滤,合并两次滤液。将滤液用旋转蒸发器浓缩至少量,浓缩液倒至蒸发皿中40℃水浴挥尽乙醇,得黄精小分子糖部位浸膏。
2.2 黄精低聚糖的分离与纯化[6]
2.2.1 D101大孔吸附树脂柱 取市售D101大孔吸附树脂,用95%乙醇浸泡24 h,使其充分溶胀,再依次用0.4 mol/L HCl、0.4 mol/L NaOH 浸泡后,抽滤,蒸馏水洗至中性,湿法装柱,蒸馏水作流动相平衡树脂。称取适量黄精小分子糖部位浸膏,用蒸馏水溶解后上样,完毕以后,少量蒸馏水冲洗柱壁至无样品黏附,保鲜膜封柱口,静置过夜,使树脂尽量将皂苷、黄酮等杂质完全吸附。蒸馏水洗脱,体积流量1 mL/min,洗脱至 Molish反应无紫色环出现为止,合并水洗脱部位溶液,用旋转蒸发器减压浓缩,备用。
2.2.2 活性炭柱层析 取活性炭粉末置于150℃烘箱中干燥2 h,用20%HCl煮沸30 min,趁热抽滤,并用热水洗涤至中性,110℃干燥后备用。活性炭与硅藻土按1∶1.5比例混合,用研钵搅拌均匀,干法装于带砂芯滤板的玻璃柱中,减压抽实。将水洗脱部位浓缩液上活性炭柱,静置过夜,使其充分吸附,蒸馏水洗脱至Molish反应检识呈阴性,试验中采用减压装置增加流量,每250 mL收集一份,合并水洗脱部位溶液并减压浓缩。取活性炭水洗脱部位浸膏适量,用蒸馏水溶解后和单糖标准品溶液,分别点于硅胶G薄层板上,以异丙醇-乙酸乙酯-水(7∶1∶2)进行展开,取出,晾干后,喷苯胺-二苯胺-磷酸,置于85℃烘箱内,显色。由薄层色谱图(图1)可知,水洗脱部位溶液除了可能含有大量的葡萄糖、果糖、蔗糖等小分子糖外,在棉子糖(三糖)下方有斑点出现,推测可能为聚合度大于3的低聚糖。

图1 活性炭水洗脱部位薄层色谱图
2.2.3 Sephadex LH-20凝胶柱层析 取活性炭水洗脱部位浸膏约1 g,少量蒸馏水溶解后,用0.45μm微孔滤膜过滤,注射器吸取滤液沿柱壁绕圈上样,完毕以后用少量蒸馏水冲洗注射器与柱壁至无样品吸附,于室温下用蒸馏水进行洗脱,体积流量为0.5 mL/min,每管收集3 mL,共收集90份。
首先,采用薄层色谱法对洗脱样品进行检识,取样品溶液和单糖标准品溶液,分别点于硅胶G薄层板上,以正丁醇-甲酸-水(4∶6∶1)进行展开,取出,晾干后,喷苯胺-二苯胺-磷酸,置于85℃烘箱内,显色,结果如图2。同时,采用紫外-可见分光光度法对洗脱组份进行检测。苯酚-硫酸法隔管测定其吸收度,即取洗脱液0.4 mL置于具塞试管中,加蒸馏水0.4 mL、5%苯酚溶液1 mL、浓硫酸5 mL,摇匀后室温放置30 min,以蒸馏水作空白对照,于波长490 nm处测定吸收度[7]。以洗脱管数为横坐标,吸收度A为纵坐标,绘制洗脱曲线,如图3。根据薄层色谱图及洗脱曲线显示将13~39合并作为黄精低聚糖样品(RPO-1),40~71合并作为小分子糖部位。将其减压浓缩后-82℃真空冷冻干燥48 h,呈灰白色疏松粉末,密封保存备用。

图2 Sephadex LH-20凝胶柱层析流份薄层色谱图
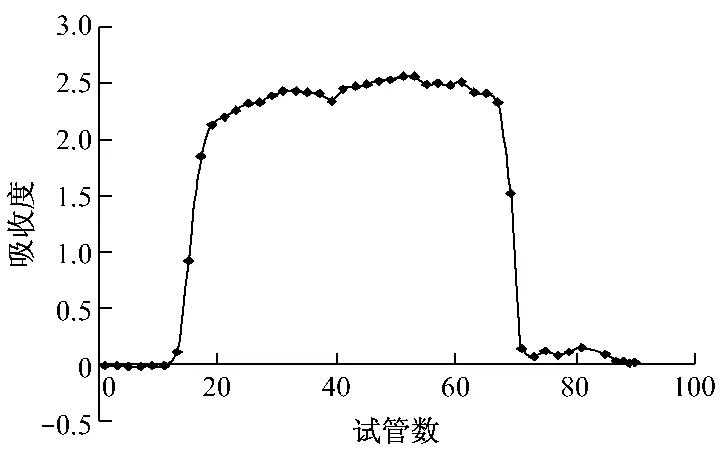
图3 Sephadex LH-20凝胶柱层析洗脱曲线
2.3 RPO-1的理化性质研究
2.3.1 RPO-1 为灰白色疏松粉末,微甜,无臭,易吸湿,水溶性好,极易溶于热水,不溶于丙酮、乙醚、三氯甲烷和苯等有机溶剂,热稳定性较好。
2.3.2 Molish反应 取1 mg/mL样品溶液1mL,加入5%α-萘酚乙醇液1~3滴,摇匀后沿试管壁缓缓加入浓硫酸约2 mL,切勿摇动,观察现象:两液面交界处有紫色环产生,表明此样品为糖类化合物。
2.3.3 FeCl3反应 取1 mg/mL样品溶液1滴,溶于1 mL乙醇中,加入1%FeCl3醇液1~2滴,以蒸馏水为阴性对照,以芦丁为阳性对照,观察现象:样品溶液颜色无变化,呈阴性,表明样品中不含酚类物质。
2.3.4 淀粉试验 取样品溶液少量,加入1滴碘酒,以淀粉溶液作对照。观察现象:样品溶液在加入碘酒后未变蓝色,表明样品中不含淀粉类物质。
2.3.5 硫酸-咔唑反应 取样品3 mg左右,加水稀释至200 μL,然后加咔唑-硫酸试剂1.5 mL,混匀,加塞,置于 100℃烘箱中保温40~45 min,取出冷却至室温,以蒸馏水、棉子糖为阴性对照,以半乳糖醛酸为阳性对照,观察现象:样品溶液为蓝绿色,未显示紫红色,表明样品中不含糖醛酸。
2.3.6 茚三酮试验 取1 mg/mL样品溶液1 mL,加入2%茚三酮试剂1mL,加热煮沸30 s,以蒸馏水为阴性对照,观察现象:样品溶液颜色无变化,表明样品中不含有氨基酸、多肽和蛋白质。
2.3.7 双缩脲试验 试剂 A:NaOH的质量分数为0.1 g/mL的水溶液;试剂B:CuSO4的质量分数为0.01 g/mL的水溶液。取1 mg/mL样品溶液1 mL,加入双缩脲试剂A 2 mL(必须营造碱性环境),再加入双缩脲试剂B 3~4滴,摇荡均匀,静置5 min,以蒸馏水为阴性对照,观察现象:样品溶液颜色无变化,呈阴性,表明样品中不含多肽和蛋白质。
2.4 RPO-1样品总糖的测定
2.4.1 葡萄糖标准品溶液的配制 精密称取干燥至恒质量的无水葡萄糖对照品50.05mg,置于100 mL量瓶中,加水溶解并稀释至刻度,摇匀,即得质量浓度为500.5μg/mL的标准品溶液,备用。
2.4.2 葡萄糖标准曲线的制备 精密吸取葡萄糖对照品溶液 1.0、1.5、2.0、2.5、3.0、3.5 mL 于 25 mL 量瓶中,蒸馏水定容,摇匀,得质量浓度分别为 20.02、30.03、40.04、50.05、60.06、70.07 μg/mL的葡萄糖标准溶液,分别吸取上述葡萄糖标准溶液2.0 mL置于具塞试管中,加5%苯酚溶液1 mL,再加浓硫酸5 mL,摇匀后室温放置40 min,以蒸馏水作空白对照,在波长490 nm处测定吸收度。以吸收度A为纵坐标,葡萄糖标准品溶液浓度为横坐标,绘制标准曲线,回归方程为 y=0.015 6x+0.017 6(r=0.999 5),葡萄糖质量浓度在20.02~70.07μg/mL范围内时,与吸收度呈良好的线性关系。
2.4.3 测定结果 精密称取RPO-1样品适量,置于100 mL量瓶中,加水溶解并稀释至刻度,摇匀,吸取溶液2.0 mL置于具塞试管中,加5%苯酚溶液1 mL,再加浓硫酸5 mL,摇匀后,室温放置40min,以蒸馏水作空白对照,在波长490 nm处测定吸收度,将其代入回归方程计算,结果见表1。
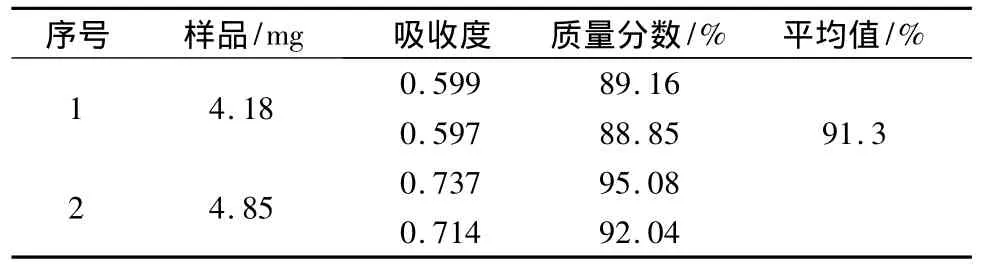
表1 RPO-1样品总糖测定结果
3 讨论
3.1 本实验建立了简单方便的黄精低聚糖分离纯化工艺,并对其理化性质进行了研究,发现样品中不含酚类物质、淀粉、糖醛酸、大分子蛋白质、多肽和核酸,为今后进一步研究其单糖组成、化学结构和生物活性等提供理论参考。
3.2 苯酚-硫酸比色法测定黄精低聚糖的原理[8]是低聚糖在浓硫酸的作用下,先水解为单糖,迅速脱水形成糠醛衍生物,然后与苯酚缩合为有色化合物,在490 nm处有特征吸收。本实验在测定总糖时用80%乙醇处理样品,消除了干扰成分,结果可靠;同时采用苯酚-硫酸法,简单快速、显色稳定、灵敏度高、重现性好,生成的颜色持久[9]。通过此法测得其样品总糖质量分数为91.3%,但是由于糖类物质水解为单糖难易程度不同,故水解条件不同。水解不够,单糖不能充分释放出来;水解条件过度,释放的单糖或有关的糖醛衍生物部分可能会被破坏。因此要严格掌握好实验的操作条件[10]。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:288.
[2]王冬梅,朱 玮,张存莉,等.黄精化学成分及其生物活性[J].西北林学院学报,2006,21(2):142-145.
[3]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999.
[4]郭丽民,张汝学,贾正平,等.寡糖的药理作用和机制研究进展[J].中成药,2006,28(9):1353-1355.
[5]郝林华,王晓滨,陈靠山,等.功能性寡糖的研究进展与应用[J].饲料工业,2005,26(12):54-59.
[6]杨明河,于德全.黄精多糖和低聚糖的研究[J].药学通报,1980,15(7):44-45.
[7]郝林华,陈 磊,仲 娜,等.牛蒡寡糖的分离纯化及结构研究[J].高等学校化学学报,2005,7(26):1242-1247.
[8]邱蓉丽,李 璘.女贞子多糖的提取工艺研究[J].中成药,2008,30(4):612-614.
[9]司梁宏,张 梅,马丹华,等.苯酚-硫酸显色法测定枸杞益肾胶囊中多糖的含量[J].中国医院药学杂志,2007,27(6):836-837.
[10]唐丽琴,刘 圣,陈礼明,等.蒽酮-硫酸比色法测定麦冬多糖的含量[J].安徽医药,2003,7(1):39-40.
