ADM和ADT对肺动脉平滑肌细胞胶原合成及磷酸化ERK1/2表达的影响*
2011-09-14赵翠芬李福海
张 磊, 赵翠芬△, 李福海, 王 荣, 夏 伟
(山东大学1齐鲁医院儿科,2卫生部教育部心血管功能重塑与功能研究重点实验室,山东济南250012)
肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)肥大、增殖,胶原等细胞外间质在肺血管壁沉积导致肺血管壁增厚、管腔狭窄是肺血管重构主要的病理生理改变之一[1]。肾上腺髓质素(adrenomedullin,ADM)是一种血管活性多肽,ADM前体(proadrenomedullin,proADM)在体内经内源性肽酶的作用可以降解产生4个不同的活性肽段,各肽段在肺内的分布和作用不同[2],其中ADM可扩血管、抑制平滑肌细胞增殖和迁移,肾上腺加压素(adrenotensin,ADT)可收缩血管、升高血压和促进血管平滑肌细胞增殖和迁移[3]。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是各种刺激引起细胞增殖的细胞内信息传递的共同通路,研究发现细胞外信号调节激酶(extracellular signalregulated kinase,ERK)参与了高肺血流大鼠肺血管重构的形成过程[4]。本研究探讨ADM和ADT对培养的Wistar大鼠PASMCsⅠ、Ⅲ型胶原合成及磷酸化ERK1/2(p-ERK1/2)表达的影响,揭示ADM和ADT调节PASMCs增殖的可能机制。
材料和方法
1 材料
1.1 仪器和试剂 4周龄雄性Wistar大鼠(重约100 g),购自山东大学医学院实验动物中心。山羊抗小鼠-TRITC和山羊抗小鼠-FITC(Sigma),小鼠抗人平滑肌α-actin单克隆抗体(R&D),ADM和ADT(北京中杉),兔抗大鼠Ⅰ型、Ⅲ型胶原抗体和兔抗大鼠p-ERK1/2抗体(北京博奥森)。实验用仪器、设备及其它试剂均由山东大学教育部和卫生部心血管重构与功能研究重点实验室提供。
1.2 试剂配制 D-Hanks平衡盐溶液:称取 KCl 0.4 g、KH2PO40.06 g、NaCl 8.0 g、NaHCO30.35 g、Na2HPO4·12H2O 0.134 g和酚红0.01 g溶解于三蒸水1 000 mL中,调pH值至7.2-7.4,过滤除菌,分装后4℃保存。PBS缓冲液:称取8.0 g NaCl、0.2 g KCl、1.15 g Na2HPO4·7H2O 和 0.2 g KH2PO4溶解于1 000 mL三蒸水中,调pH值至7.3,过滤除菌,分装后4℃保存。以上试剂经0.22 μm滤膜过滤除菌。培养基:80%高糖D MEM和10%FBS、10%G418过滤除菌。
2 方法
2.1 大鼠PASMCs分离及培养 采用组织贴块法培养雄性Wistar大鼠PASMCs,2%戊巴比妥麻醉(40 mg/kg),75%乙醇浸泡3 min,开胸取心肺,PBS冲洗2遍;在超净台内用显微剪及显微镊循肺动脉主干逐级追入肺实质,取肺动脉2级以下分支,冷PBS清洗2遍。冷PBS液中剥除外膜纤维脂肪层,纵向剪开血管,内面朝上弯头小镊子自上而下刮除内膜,留中膜平滑肌层。用眼科剪将中膜剪成约1 mm×1 mm×1 mm的小块;用弯头吸管将小组织块移入50 mL培养瓶中,并均匀铺于培养瓶底,每瓶25-30个组织块;小心加入含20%FBS的高糖DMEM培养基5 mL,倒置于CO2孵箱中3-6 h,待组织块贴壁牢固后,翻正培养瓶使组织块完全浸泡于培养液中;放入CO2孵箱(37℃、5%CO2、95%空气,保持一定湿度)继续培养4-7 d后,于倒置显微镜下观察细胞生长情况。待原代细胞生长至汇合状态、铺满瓶壁的80%以上时,进行传代。实验用4-7代平滑肌细胞。
2.2 PASMCs免疫荧光鉴定 采用平滑肌α-actin单克隆抗体对培养的细胞进行鉴定。将第4代的细胞消化后移入6孔板,在37℃、5%CO2培养箱中静止培养。按说明书进行操作,分别加入小鼠抗人血管平滑肌细胞单克隆抗体(1∶500),0.01 mol/L PBS作阴性对照,滴加TRITC标记山羊抗小鼠IgG(1∶500)孵育30 min 37℃ 湿盒;DAPI染细胞核1-2 min;防淬灭封片,镜下观察。
2.3 免疫荧光检测ADM和ADT对大鼠PASMCsⅠ、Ⅲ型胶原及p-ERK1/2表达的影响 取4-7代PASMCs,酸处理盖玻片放入6孔板内做细胞爬片,分别加入:10-7mol/L ADM或ADT和兔抗Ⅰ型胶原抗体(1∶200);10-7mol/L ADM或ADT和兔抗Ⅲ型胶原抗体(1∶200);10-7mol/L ADM或ADT和兔抗p-ERK1/2抗体(1∶100);10-7mol/L ADM 或 ADT和0.01 mol/L PBS作阴性对照。滴加FITC标记的山羊抗小鼠IgG(1∶100),37℃孵育30 min。每组10孔,培养72 h,4%多聚甲醛固定,作免疫荧光分析,每张爬片在荧光显微镜下(×400)随机选取5个视野拍照,观察细胞浆出现绿色颗粒者为阳性细胞。采用Image-Pro Plus 5.0图像处理软件对结果进行图像分析处理,分析相同曝光时间下的吸光度(absorbance,A)值。
2.4 细胞总蛋白提取和免疫印迹 采用Western blotting检测不同浓度的ADM和ADT对培养细胞之p-ERK1/2蛋白表达的影响:以下操作均在冰上或4°C进行,所有液体预先致冷。分别加入 10-7mol/L、10-8mol/L 和 10-9mol/L ADM或ADT,培养到规定时点收集细胞(贴壁细胞胰酶消化),用PBS洗涤细胞2次,并转移入EP管,1 000 r/min离心5 min弃尽上清液;将细胞沉淀重悬于细胞裂解液,冰浴40 min;18 000 r/min离心10 min,收集上清,即为细胞总蛋白。取20 μL总蛋白先经12%SDS-PAGE分离,再电转移至硝酸纤维素膜 (Amersham Pharmacia)上,用含0.05%Tween-20、5%脱脂奶粉的Tris缓冲液(TBS-T,5%non-fat milk)将膜室温封闭2 h后,加入相应的第Ⅰ抗体,4℃孵育过夜。用TBS-T洗膜3次,每次10 min。然后,将膜用相应第Ⅱ抗体室温孵育2 h。TBS-T洗膜3次,每次10 min。ECL化学发光系统显色,压片、曝光、显影、定影后晾干保存。采用Image-Pro Plus 5.0图像处理软件对结果进行图像分析处理,分析相同曝光时间下的A值。
3 统计学处理
结 果
1 培养大鼠远端PASMCs鉴定
细胞培养3-5 d后,用相差显微镜观察见细胞呈梭形或长梭形排列,然后细胞呈放射性生长,多为两极,胞浆均匀,可见圆形细胞核及分裂相。培养至7-10 d出现局部成束的细胞平行排列,部分区域细胞重叠,部分区域高低起伏呈“峰-谷”状生长。用小鼠抗人α-actin抗体及TRITC标记的山羊抗小鼠抗体鉴定为平滑肌细胞,见图1。细胞质发红色荧光(A1),细胞核发蓝色荧光(A2),A3为A1和A2合成图。细胞纯度平均达97%以上。

Figure 1.Immunofluorescence identification of rat PASMCs(inverted phase-contrast microscope,×200).A1:cell cytoplasm was stained with TRITC shown in red;A2:cell nuclei were stained with DAPI shown in blue;A3:overlap of A1 and A2.图1 大鼠PASMCs免疫荧光
2 免疫荧光检测ADM和ADT对大鼠PASMCsⅠ、Ⅲ型胶原及p-ERK1/2表达的影响
2.1 10-7mol/L ADM和ADT对PASMCsⅠ型胶原表达的影响 图2中细胞质图B1发暗绿色、图C1发亮绿色荧光,细胞核(B2、C2)发蓝色荧光,B3、C3为合成图。这提示:ADM可抑制培养 PASMCsⅠ型胶原的表达。而 ADT可增强PASMCsⅠ型胶原表达。
2.2 10-7mol/L ADM和ADT对PASMCsⅢ型胶原表达的影响 图3中细胞质图D1发暗绿色荧光、图E1发亮绿色荧光,细胞核(D2、E2)发蓝色荧光,D3、E3为合成图。这提示:ADM可抑制PASMCsⅢ型胶原的表达;ADT可增强培养PASMCsⅢ型胶原的表达。
2.3 10-7mol/L ADM 和 ADT对 PASMCs p-ERK1/2表达的影响 图4中细胞质图F1发暗绿色荧光、图G1发亮绿色荧光,细胞核(F2、G2)发蓝色荧光,F3、G3为合成图。这提示:ADM可抑制PASMCs p-ERK1/2的表达,而ADT可增强培养PASMCs之p-ERK1/2的表达。
2.4 吸光度比值分析 10-7mol/L ADM和 ADT对大鼠PASMCsⅠ、Ⅲ型胶原及p-ERK1/2表达的影响 从表1中看出:吸光度比值显示ADM可抑制培养PASMCsⅠ、Ⅲ型胶原及p-ERK1/2表达(P<0.05,P<0.01),而 ADT可增强PASMCsⅠ、Ⅲ型胶原及 p-ERK1/2表达(P<0.05,P<0.01)。这提示 ADM对PASMCs胶原合成有促进作用,而ADT可抑制PASMCs胶原合成。
3 Western blotting检测ADM和ADT对PASMCs p-ERK1/2蛋白表达的影响
ADM可呈剂量依赖性抑制PASMCs p-ERK1/2蛋白表达(P<0.01,P<0.05);ADT也呈剂量依赖性促进PASMCs p-ERK1/2蛋白表达(P<0.01,P<0.05),见图5。这提示p-ERK1/2在PASMCs增殖过程中被激活,ADM和ADT可能通过ERK通路调节PASMCs增殖。
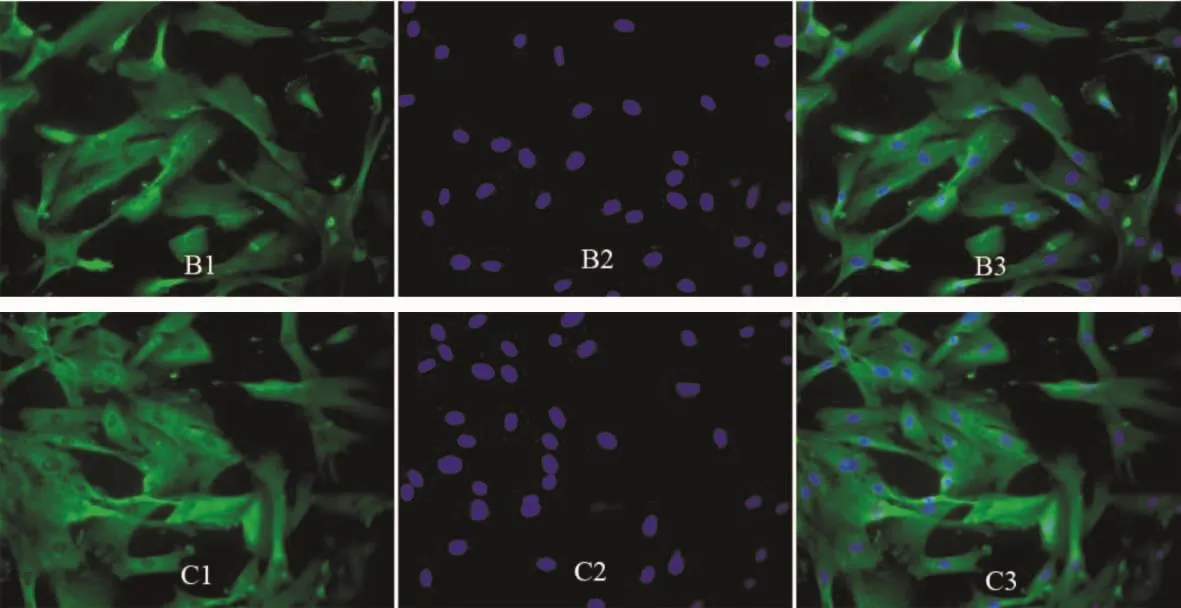
Figure 2.The effects of 10-7mol/L ADM(B1-3)and 10-7mol/L ADT(C1-3)on the expression of collagen typeⅠin cultured PASMCs(immunofluorescence staining,×400).B1 and C1:cell cytoplasm was stained with FITC shown in green;B2 and C2:cell nuclei were stained with DAPI shown in blue;B3:overlap of B1 and B2;C3:overlap of C1 and C2.图2 10-7mol/L ADM和ADT对培养PASMCsⅠ型胶原表达的影响
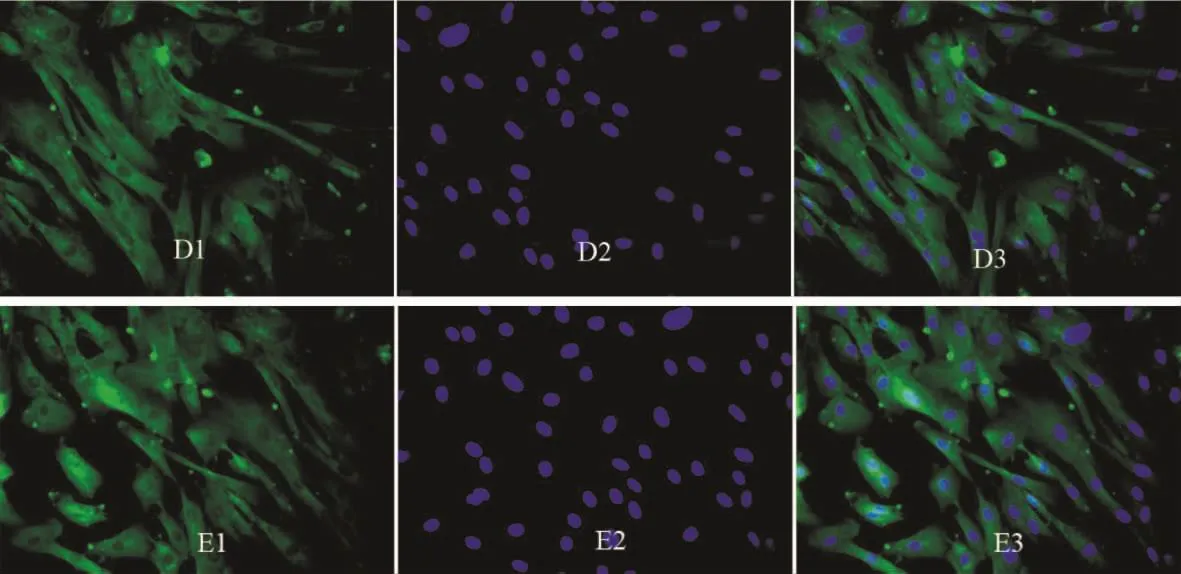
Figure 3.The effects of 10-7mol/L ADM(D1-3)and 10-7mol/L ADT(E1-3)on the expression of collagen typeⅢ in cultured PASMCs(immunofluorescence staining,×400).D1 and E1:cell cytoplasm was stained with FITC shown in green;D2 and E2:cell nuclei were stained with DAPI shown in blue;D3:overlap of D1 and D2;E3:overlap of E1 and D2.图3 10-7mol/L ADM和ADT对培养PASMCsⅢ型胶原表达的影响
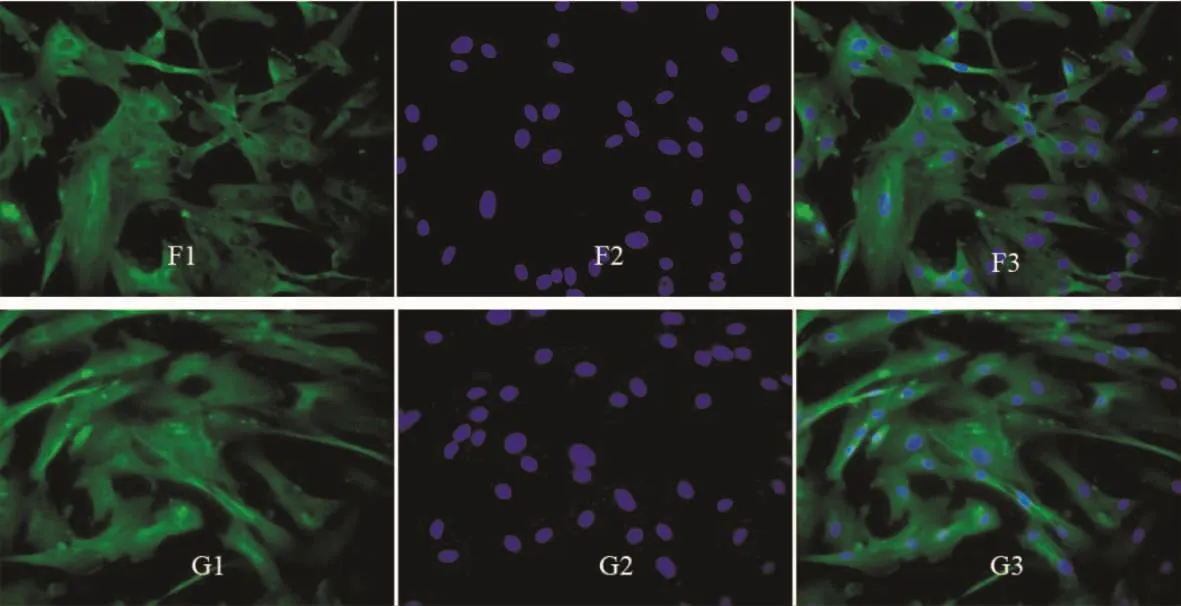
Figure 4.The effects of 10-7mol/L ADM(F1-3)and 10-7mol/L ADT(G1-3)on the expression of p-ERK1/2 in cultured PASMCs(immunofluorescence staining,×400).F1 and G1:cell cytoplasm was stained with FITC shown in green;F2 and G2:cell nuclei were stained with DAPI shown in blue;F3:overlap of F1 and F2;G3:overlap of G1 and G2.图4 10-7mol/L ADM和ADT对培养PASMCs p-ERK1/2表达的影响
表1 10-7mol/L ADM和ADT对培养PASMCsⅠ型和Ⅲ型胶原和p-ERK1/2表达的影响Table 1.The effects of 10-7mol/L ADM and ADT on the expression of collagen typeⅠ,Ⅲ and p-ERK1/2 in cultured PASMCs(A.±s.n=10)
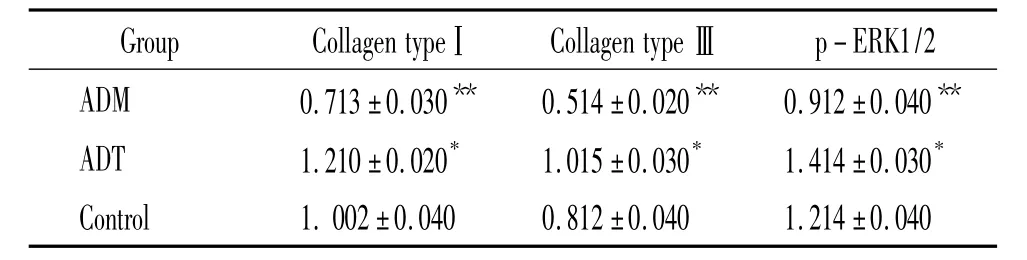
表1 10-7mol/L ADM和ADT对培养PASMCsⅠ型和Ⅲ型胶原和p-ERK1/2表达的影响Table 1.The effects of 10-7mol/L ADM and ADT on the expression of collagen typeⅠ,Ⅲ and p-ERK1/2 in cultured PASMCs(A.±s.n=10)
*P <0.05,**P <0.01 vs control.
Group Collagen typeⅠ Collagen typeⅢp-ERK1/2 ADM 0.713±0.030** 0.514±0.020** 0.912±0.040**ADT 1.210±0.020* 1.015±0.030* 1.414±0.030*Control 1.002±0.040 0.812±0.040 1.214±0.040
讨 论
胶原是细胞外基质的主要成分,血管壁主要存在Ⅰ、Ⅲ型胶原,Ⅰ型胶原与血管壁抗张力有关,Ⅲ型胶原与血管壁弹性有关。细胞外基质增加是肺动脉高压和肺血管重构的重要病理生理改变之一,血管壁中胶原蛋白堆积可导致肺动脉管壁增厚、管腔缩小,从而在缺氧性肺血管结构重构形成中起着十分重要的作用[5]。
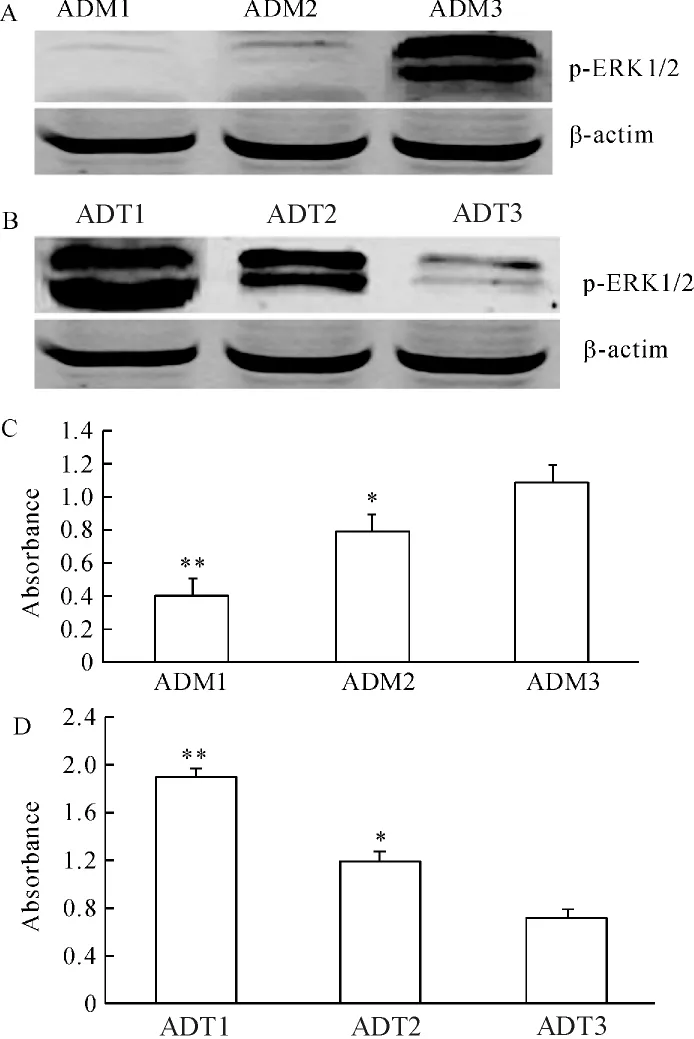
Figure 5.Western blotting detected the effects of different concentrations of ADM(A)or ADT(B)on the protein expression of p-ERK1/2 in cultured rat PASMCs.β - actin served as internal control.Absorbance data were shown in C and D,respectively.ADM1,ADM2 and ADM3:10 -7mol/L,10 -8mol/L and 10 -9mol/L ADM;ADT1,ADT2 and ADT3:10-7mol/L,10-8mol/L and 10-9mol/L ADT.±s.n=6.*P<0.05,**P <0.01 vs control.图5 Western blotting检测不同浓度的ADM或ADT对大鼠PASMCs p-ERK1/2蛋白表达的影响
本研究采用贴块法原代体外培养大鼠远端PASMCs[6],虽然培养周期较长,但方法简单、经济,生长状态良好,经传代后可获得较多的细胞数量,经小鼠抗人平滑肌α-actin单克隆抗体对培养细胞进行鉴定其细胞纯度达97%。幼龄大鼠原代培养成功率高,但血管小,血管壁薄,细胞分离难度大,而老龄大鼠的细胞活力弱,生长缓慢,不适合细胞传代生长,故实验选择4周龄、健康雄性大鼠。肺血管重构主要发生于远端肺小动脉,表现为肺小动脉平滑肌细胞增殖、中膜增厚、无肌型肺小动脉肌化、微血栓形成、管腔狭窄等,故本研究选择大鼠远端PASMCs进行培养。
ADM是具有扩血管、抗细胞增殖和迁移作用的血管活性多肽,以旁分泌和自分泌形式参与许多生理和病理过程。ADT可抑制ADM的血管活性,显示缩血管和促进血管平滑肌细胞增殖作用。研究证实ADM与ADT均参与了缺氧性肺血管重构过程[7]。新近动物实验研究发现ADM既可延缓肺血管重构,又能逆转肺血管重构,显示了令人鼓舞的实验效果[8]。
本研究结果显示培养的PASMCs给予ADM刺激后,其胞浆中Ⅰ、Ⅲ型胶原表达较对照组均减弱,而给予ADT刺激后PASMCs胞浆中Ⅰ、Ⅲ型胶原表达较对照组增强。提示ADM可抑制培养的 PASMCsⅠ、Ⅲ型胶原的合成。推测ADM可能通过抑制PASMCs增殖,使细胞数量减少;从基因转录水平上抑制了PASMCsⅠ、Ⅲ型胶原mRNA的表达,下调了每个PASMCsⅠ、Ⅲ型胶原蛋白合成的水平,导致胶原合成减少。胶原纤维是细胞质的基质成分之一,研究发现在培养平滑肌细胞中加入ADM可降低细胞迁移,抑制微管过度聚集,对抗胞质骨架过度稳定,从而延缓或抑制SMCs的肥大、增殖和迁移[9]。ADM还可能通过对PASMCs细胞质基质的表达和蛋白合成的调节作用来降低细胞浆中Ⅰ、Ⅲ型胶原表达。另外ADM可激活平滑肌细胞阳离子通道而使细胞超极化,细胞内钙水平降低;同时可活化磷脂酰肌醇3激酶(PI3K)和蛋白激酶B/Akt,使eNOS磷酸化而使其活性增强,PASMCs收缩力降低,延缓细胞肥大,减少胶原等细胞基质分泌[10]。ADM基因修饰的内皮祖细胞转录到肺动脉高压大鼠肺组织中可明显降低肺动脉压力,抑制平滑肌细胞重构[11]。研究还证实ADM吸入或静脉注射均能降低肺动脉高压病人的肺动脉压力和肺血管阻力,逆转肺血管肥厚[12]。ADT则可能从基因转录水平上增强Ⅰ、Ⅲ型胶原mRNA的表达,上调了每个细胞Ⅰ、Ⅲ型胶原蛋白合成水平,减缓了PASMCsⅠ、Ⅲ型胶原蛋白的降解,从而使培养的大鼠PASMCs内Ⅰ、Ⅲ型胶原含量增加。
MAPKs通路为多种细胞外信号从细胞表面受体传向细胞内的一条重要信号转导通路。已被完全证实的转导通路有3条:应力活化蛋白激酶(SAPK)、ERK和甘油高渗性激酶(HOG1)[13]。ERK与细胞增殖反应有关,许多促增殖活性物质,分别通过激活受体酪氨酸激酶和G蛋白途径,相继引起Ras、MAPK激酶激活,后者激活转录因子、刺激与细胞增殖有关的基因转录,促进细胞的生长、分化与增殖[14]。研究已证实MAPK在VSMCs增殖、分化、凋亡、细胞骨架等重构及细胞周期中起着非常重要的作用,MAPK可激活转录因子,增加PASMCs的DNA合成,促进细胞增殖和迁移[15]。
本研究结果显示ADM可抑制培养的PASMCs p-ERK1/2表达;而 ADT促进培养的 PASMCs内p-ERK1/2表达,二者均随浓度增加作用增强。提示ERK/MAPK途径在PASMCs增殖中被激活,激活的p-ERK1/2可通过核转位,启动并上调PASMCs增殖基因,最终导致PASMC增殖。ADM具有抑制细胞增殖作用,ADM可以与特异性受体相结合引起细胞内cAMP升高,通过cAMP或cGMP的介导而抑制细胞增殖[16];ADM还可能通过直接抑制 ERK/MAPK信号通路,切断信号通路下游与增殖有关的激酶,抑制转录因子功能,从而抑制细胞分化、增殖[17]。ADT可能通过激活ERK/MAPK信号通路,激活信号通路下游与增殖有关的激酶,增强转录因子功能,增强细胞分化与增殖。
总之,本研究通过原代培养Wistar大鼠PASMCs,检测ADM和ADT对PASMCsⅠ型和Ⅲ型胶原合成及p-ERK1/2表达的影响,研究结果发现ADM可促进PASMCsⅠ、Ⅲ型胶原及p-ERK1/2的表达,而ADT可抑制PASMCsⅠ、Ⅲ型胶原及p-ERK1/2的表达。推测ERK信号途径在PASMCs增殖过程中被激活,ADM和ADT可能通过ERK途径调节PASMCs增殖。ADM或ADT拮抗剂估计可延缓或阻抑肺动脉高压和肺血管重构的形成和发展。
[1]Rabinovitch M.Molecular pathogenesis of pulmonary arterial hypertension [J].J Clin Invest,2008,118(7):2372-2379.
[2]赵翠芬,王丽娟,王志宇,等.肾上腺髓质素前体不同活性肽段在肺动脉高压大鼠肺内的分布[J].中国病理生理杂志,2008,24(4):655 -660.
[3]Kitamura K,Kangawa K,Kawamoto M,et al.Adrenomedullin:A novel hypotensive peptide isolated from human pheochromocytoma[J].Biochem Biophys Res Commun,1993,192(2):553 -560.
[4]赵翠芬,王丽娟,高 莉,等.肾上腺髓质素和升压素在左向右分流肺血管重构中的变化及作用途径研究[J].中华儿科杂志,2008,46(8):585 -590.
[5]Du J,Yan H,Wei B,et al.Effect of L-arginine on collagen of high flow-induced pulmonary arterial remodeling[J].Circ J,2005,69(5):603 -608.
[6]洪 城,王 健,李 冰,等.大鼠远端肺动脉平滑肌细胞分离与原代培养[J].中华生物医学工程杂志,2007,13(3):176 -179.
[7]Nakanishi K,Osads M,Uenoyama F,et al.Expression of adrenomedullin mRNA and protein in rats with hypobaric hypoxia-induced pulmonary hypertension[J].Am J Physiol Heart Cir Physiol,2004,286(6):H2159 -H2168.
[8]Stenmark KR,Rabinovitch M.Emerging therapies for the treatment of pulmonary hypertension[J].Pediatr Crit Care Med,2010,11(2 Suppl):S85 - S90.
[9]Sackett DL,Ozbun L,Zudaire E,et al.Intracellular proadrenomedullin-derived peptide decorate the microtubules and contribute to cytoskeleton function[J].Endocrinology,2008,149(6):2888 -2898.
[10]Murakami S,Kimura H,Kangawa K,et al.Physiological significance and therapeutic potential of adrenomedullin in pulmonary hypertension[J].Cardiovasc Hematol Disord Drug Targets,2006,6(2):125 -132.
[11]Zhao YD,Courtman DW,Deng Y,et al.Rescue of monocrotaline-induced pulmonary arterial hypertension using bone marrow-derived endothelial-like progenitor cells:efficacy of combined cell and eNOS gene therapy in established disease[J].Circ Res,2005,96(4):442 -450.
[12]Nagaya N,Kyotani S,Uematsu M,et al.Effects of adrenomedullin inhalation on hemodynamics and exercise capacity in patients with idiopathic pulmonary arterial hypertension[J].Circulation,2004,109(3):351 -356.
[13]Yang X,Lee PJ,Long L,et al.BMP4 induced HO -1 via a Smad-independent,p38MAPK-dependent pathway in pulmonary artery myocytes[J].Am J Respir Cell Mol Biol,2007,37(5):598 -607.
[14]Nagaya N,Kangawa K.Adrenomedullin in the treatment of pulmonary hypertension [J].Peptides,2004,25(11):2013-2018.
[15]Roberts PJ,Der CJ.Targeting the Raf-MEK -ERK mitogen-activated protein kinase cascade for the treatment of cancer[J].Oncogene,2007,26(22):3291 -3310.
[16]Zhao C,Wang L,Gao L,et al.Changes and distributions of peptides derived from proadrenomedullin in left to right shunt pulmonary hypertension of rats[J].Circ J,2008,72(3):476 -481.
[17]Zeng Z,Li Y,Jiang Z,et al.The extracellular signalregulated kinase is involved in the effects of sildenafil on pulmonary vascular remodeling [J].Cardiovasc Ther,2010,28(1):23-29.
