慢性间断性缺氧对帕金森病模型小鼠纹状体氧化应激的影响
2011-09-12张子彦徐江涛宋永斌许永华余伍忠刘海林李景春
张子彦 徐江涛 宋永斌 杨 俊 许永华 余伍忠 刘海林 李景春
(新疆医科大学研究生院,新疆 乌鲁木齐 830001)
帕金森病(PD)是以震颤、肌强直、运动减少和姿势异常为特征的慢性神经系统变性疾病,多发生于中老年人。病理上以选择性中脑黑质多巴胺(DA)能神经元丧失、纹状体DA含量显著减少为其特点。氧化应激反应是PD的发病机制之一〔1〕。PD易导致气道及肺部异常,从而增加患睡眠呼吸暂停综合征(SAS)的风险〔2〕。SAS主要病理生理改变是慢性间断性缺氧(CIH)〔3〕。其特征性缺氧在氧合过程中可产生大量氧自由基,使全身多个器官产生氧化应激反应,脑组织易受到自由基的攻击而发生变性〔4〕。我们已在前期实验中观察到CIH可加重PD模型小鼠行为学异常并使纹状体DA含量显著减少和中脑黑质的病理损害〔5,6〕,本实验主要观察CIH对百草枯(PQ)致PD小鼠模型纹状体的氧化应激反应的影响。
1 材料与方法
1.1 材料和试剂 自制间断缺氧箱和对照箱;双光束UV-8500型分光光度计(上海天美科技仪器有限公司);高效液相色谱仪(日本岛津);色谱柱(Waters Symmetry shield TM RP 18)。PQ(美国Sigma公司);DA标准品(中国药品生物制品检定所);超氧化物歧化酶(SOD)检测试剂盒、谷胱甘肽(GSH)检测试剂盒、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒、丙二醛(MDA)检测试剂盒、考马斯亮蓝蛋白浓度检测试剂盒(南京建成生物工程有限公司)。
1.2 实验动物与分组 6周龄SPF级C57BL/6雄性小鼠,体重18~22 g(新疆维吾尔自治区疾病控制中心);将44只小鼠随机分为4组,每组11只。①PQ组:参照文献〔6〕方法制作PD模型,按照0.025 ml/g体重腹腔注射0.4 mg/ml PQ溶液,每周2次,连续6 w,后4 w放入对照箱,每天8 h(10:00~18:00),观察小鼠行为变化。根据小鼠是否出现特征性PD表现判断模型成功与否。②CIH组:腹腔注射生理盐水0.025 ml/g体重,每周2次,连续6 w,后4 w按文献〔6〕方法给予CIH处理,将实验箱密闭时小鼠呼吸箱内有限的氧气造成低氧,然后实验箱开启,室内空气迅速进入箱内形成复氧,每次循环150 s:关闭120 s,开启30 s,每天8 h(10:00~18:00)。③PQ+CIH组:建立 PQ诱导的PD模型,同时后4 w给予CIH处理;④对照组:腹腔注射生理盐水0.025 ml/g体重,每周2次,连续6 w。后4 w放入对照箱,每天8 h(10:00~18:00)。
1.3 小鼠行为学评价 观察小鼠自主活动行为,经PQ处理出现活动明显减少、爬行较缓慢、反应迟钝、弓背状姿势、不自主竖毛、并有轻微震颤等PD自发特征性表现即造模成功。
1.4 纹状体DA含量,SOD和GSH-Px活性、GSH和MDA含量测定
1.4.1 纹状体的取材 试验终点将小鼠断头取脑标本,将小鼠脑组织迅速于冰皿上取出纹状体部分,-80℃保存。
1.4.2 DA含量测定 将小鼠纹状体称重,加5倍量0.1 mol/L高氯酸制成匀浆。置于低温离心机10 000 r/min,4℃离心20 min,取上清液进行色谱分析。色谱条件为:高效液相色谱仪;色谱柱;流动相甲醇;0.05 mol磷酸氢二钠;0.02 mol柠檬酸(2∶72∶24),pH=6.0;流速为 1.0 ml/min,检测波长280 nm,柱温 30℃;进样量:20 μl。
1.4.3 SOD和GSH-Px活性以及GSH和MDA含量测定 测定方法按南京建成生物工程有限公司的试剂盒方法检测。
1.5 统计学处理 应用SPSS16.0统计软件处理,采用±s表示,组间比较采用单因素方差分析。进一步两两比较采用LSD-t检验。
2 结果
2.1 动物的行为表现 小鼠在经PQ处理4 w时自发性活动减少,6 w时小鼠的活动明显减少、爬行较缓慢、反应迟钝、弓背状姿势和不自主竖毛,并有轻微震颤等PD特征性表现。
2.2 各组间纹状体DA含量比较 CIH组与对照组差异无统计学意义(P=0.10),PQ组和PQ+CIH组与对照组及CIH组比较均减少,差异有统计学意义(P=0.000),PQ+CIH组与PQ组比较则明显减少(P=0.000)。见表1。
2.3 各组间纹状体SOD和GSH-Px活性,GSH和MDA含量比较 PQ组、CIH组和PQ+CIH组分别与对照组比较,纹状体SOD和GSH-Px活性显著降低,GSH含量亦显著降低,MDA含量显著增高(P<0.05);PQ+CIH组与PQ组和CIH组比较,纹状体SOD和GSH-Px活性显著降低,GSH含量亦显著降低,MDA含量显著增高(P<0.01);PQ组与CIH组比较,SOD和GSH-Px活性以及GSH和MDA含量无差异。见表1。
表1 小鼠纹状体DA含量及SOD和GSH-Px活力,GSH和MDA含量的比较(± s,n=44)
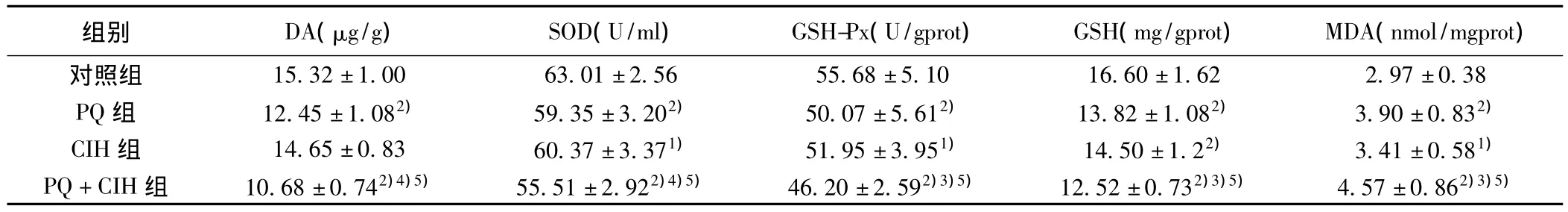
表1 小鼠纹状体DA含量及SOD和GSH-Px活力,GSH和MDA含量的比较(± s,n=44)
与对照组比较:1)P<0.05,2)P<0.01;与PQ组比较:3)P<0.05,4)P<0.01;与CIH组比较:5)P<0.01
组别 DA(μg/g) SOD(U/ml) GSH-Px(U/gprot) GSH(mg/gprot) MDA(nmol/mgprot)对照组 15.32±1.00 63.01±2.56 55.68±5.10 16.60±1.622.97±0.38 PQ组 12.45±1.082) 59.35±3.202) 50.07±5.612) 13.82±1.082) 3.90±0.832)CIH组 14.65±0.83 60.37±3.371) 51.95±3.951) 14.50±1.22) 3.41±0.581)PQ+CIH组 10.68±0.742)4)5) 55.51±2.922)4)5) 46.20±2.592)3)5) 12.52±0.732)3)5) 4.57±0.862)3)5)
3 讨论
PQ 与神经毒素 1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methy-4-phenyl-1,2,3,6-tetrahy-dropyridine,MPTP)的活性代谢产物 1-甲基-4-苯基-四氢吡啶离子(1-methyl-4-phenyl-1,2,3,6-tetrahydro-pyridine,MPP+)极为相似,能够透过血脑屏障,作用于多巴胺能神经元,致使其发生氧化还原反应,从而使黑质纹状体部位活性氧(ROS)清除减少,氧化应激反应增强,最终造成多巴胺能神经元的凋亡〔7〕。本实验中,给予PQ注射的小鼠均出现PD特征性表现、纹状体内DA含量减少,且纹状体内氧化应激反应增强,说明造模成功。CIH可引起全身氧化应激反应。目前证实在发生间断性缺氧时,可使SOD生成不足,活性降低,致使组织氧自由基清除减少,从而发生氧化应激〔8〕。本实验中,我们通过对PD模型鼠进行CIH处理,发现小鼠纹状体亦有氧化应激反应增强。但单独CIH处理并未引起纹状体DA含量降低,PD模型给予CIH处理后可见纹状体氧化应激反应进一步增强,DA含量较之单纯PQ组进一步下降。
脑组织是机体氧化代谢最活跃的器官,且含有大量易氧化的不饱和脂肪酸;但脑组织内抗氧化相关酶的活性及抗氧化小分子谷胱甘肽的含量较低;特别是在纹状体和黑质内含有大量的多巴胺,多巴胺在自发的或经酶催化的代谢过程中产生氧自由基、过氧化氢等神经毒性物质〔9〕。PQ使DA能神经元烟酰胺腺嘌呤二核苷磷酸(NADPH)耗竭和氧化应激ROS的产生,NADPH减少使氧化型谷胱甘肽(GSSG)不能由谷胱甘肽还原酶催化还原为GSH,从而导致纹状体部位ROS清除减少,脂质过氧化反应增强,最终造成DA能神经元的凋亡〔10〕。CIH可使线粒体呼吸链复合体Ⅲ、Ⅳ耗氧量下降,过氧化物等氧化应激相关指数在电子传递到线粒体呼吸链复合体Ⅳ时增加〔11〕,也使组织内ROS含量增加,线粒体不仅是细胞中ROS的主要产生场所,也是对氧化损伤非常敏感的区域,超过正常水平的ROS,会使线粒体膜电位和线粒体活性急剧降低,导致细胞ATP产生障碍,能量供应不足,破坏细胞正常生理功能,导致细胞坏死。同时线粒体也与细胞凋亡紧密相关,氧化压力激活线粒体通透性转换孔道(mtPTP),从而打开连通线粒体内外膜的通道使细胞色素 C、caspase-2,3,9前体、凋亡诱导因子(apoptosis-inducing factor,AIF)以及caspase激活的DNase释放到细胞质中。细胞色素C和胞质中的人凋亡蛋白酶激活因子1(apoptotic protease activating factor 1,Apaf-1)结合激活 caspase,AIF和 caspase激活的DNase转移到细胞核中启动凋亡〔9〕。PD模型鼠给予CIH处理后,可使纹状体内两条不同的氧化应激通路同时激活,从而产生叠加损害,加剧PD模型小鼠抗自由基损伤的能力。而我们也在前期实验中观察到CIH可加重PQ致PD模型小鼠的行为学、中脑黑质的病理损害以及加剧纹状体DA含量减少〔5,6〕,与上述推论相吻合。
综上,CIH引起小鼠纹状体氧化应激反应,并使PD模型鼠纹状体氧化应激反应加重,同时进一步加重小鼠纹状体DA含量减少。
1 Rego AC,Oliveira CR.Mitochondrial dysfunction and reactive oxygen species in excitotoxicity and apoptosis:implications for the pathogenesis of neurodegenerative diseases〔J〕.Neurochem Res,2003;28(10):1563-74.
2 Herer B,Arnulf I,Housset B.Effects of levodopa on pulmonary function in Parkinson's disease〔J〕.Chest,2001;119(2):387-93.
3 Xu W,Chi L,Row BW,et al.Increased oxidative stress is associated with chronic intermittent hypoxia-mediated brain cortical neuronal cell apoptosis in a mouse model of sleep apnea〔J〕.Neuroscience,2004;3(2):313-23.
4 David G,Deepti N,Aviv D.Physical activity attenuates intermittent hypoxia-induced spatial learning deficits and oxidative stress〔J〕.Care Med,2010;182(1):1001-8.
5 郭云云,徐江涛,宋永斌,等.慢性间断性缺氧对帕金森病模型小鼠行为学及纹状体多巴胺含量的影响〔J〕.现代生物医学进展,2008;8(127):2217-20.
6 李景春,徐江涛,宋永斌,等.慢性间断性缺氧对帕金森病模型小鼠行为学及黑质病理改变的影响〔J〕.中国临床神经科学,2010;18(3):231-5.
7 Chun HS,Gibson GE,DeGiorgio LA,et al.Dopaminergic cell death induced by MPP(+),oxidant and specific neuro toxicants shares the common molecular mechanism〔J〕.Neurochem,2001;76(4):1010-21.
8 Jayasri N,Wang N,Yuan GX,et al.Intermittent hypoxia degrades HIF-2 via calpains resulting in oxidative stress:Implications for recurrent apnea-induced morbidities〔J〕.PNAS,2009;106(4):1199-204.
9 Zhao DL,Zou LB,Lin S,et al.Anti-apoptotic effect of esculin on dopamine-induced cytotoxicity in the human neuroblastoma SH-SY5Y cell line〔J〕.Neuropharmacology,2007;53(6):724-32.
10 Liu X,Kin CN,Yang J,et al.Induction of apoptotic program in cell-free extracts:requirement for dATP and cytochromec〔J〕.Cell,1996;86(1):147-57.
11 Douglas RM,Ryu J,Kanaan A,et al.Neuronal death during combined intermittent hypoxia/hypercapnia is due to mitochondrial dysfunction〔J〕.Cell Physiol,2010;298(6):1594-602.
