睡眠剥夺对老龄大鼠学习记忆及磷酸化p38MAPK信号、Aβ表达的影响
2011-09-12赵雅宁陈长香陈桂芝李淑杏李建民河北联合大学河北唐山063000
赵雅宁 郭 霞 陈长香 陈桂芝 李淑杏 李建民 (河北联合大学,河北 唐山 063000)
睡眠不足 (部分睡眠剥夺)是常态老年人常见现象。研究发现睡眠不足与老年人认知功能减退密切相关,可导致导致学习、记忆能力下降,反应迟钝,注意力分散,定向障碍,出现幻觉等〔1〕;但其具体的神经生物学机制尚未完全阐明。p38丝裂原蛋白激酶 (MAPK)是一真核细胞广泛表达的丝氨酸-苏氨酸蛋白激酶,活化后通过调控底物如炎症因子,凋亡蛋白等表达,参与Alzheimer病认知障碍、血管性痴呆等疾病病理损伤过程〔2,3〕。β 淀粉样肽 (Aβ)是前体蛋白 (APP)通过蛋白酶解途径裂解成的长度为39~43个氨基酸的片段,是神经细胞和胶质细胞正常代谢的产物。但如果Aβ表达增加,作用时间延长,则可在海马、及新皮质等部位沉淀、堆积,并对神经细胞产生毒性作用。本实验通过观察不同睡眠剥夺 (SD)时间对老龄大鼠海马区磷酸化P38MAPK蛋白和Aβ表达的影响,并应用P38MAPK蛋白抑制剂SB203580进行干预,为进一步阐明SD损害认知功能的可能机制提供实验依据。
1 材料与方法
1.1 动物分组和模型制备 雄性SD老龄大鼠90只〔北京维通利华公司,合格证:SCXK(京)2002-003〕,12~14月龄,体质量(330±20)g,随机分为对照组、模型组、SB203580干预组,每组又随机平均分为SD1 d、3 d、5 d 3个亚组。采用改良多平台法制备快速动眼SD模型。睡眠剥夺箱大小30 cm×30 cm×150 cm,其中央放置一径为6 cm,高8 cm的平台。剥夺箱内注有水,水面低于平台2 cm,水温保在(20±2)℃。大鼠可以在平台上自由摄取食物和水,但当进入睡眠时骨骼肌的松弛使大鼠掉入水中而惊醒,造成 SD。对照组除平台增大为直径13 cm,其余因素与SD组一致,大鼠在大平台上可以部分活动,并可以进入睡眠。
1.2 脑组织形态结构观察(HE染色) 各组动物在规定时间点以戊巴比妥钠麻醉(40 mg/kg),用40 g/L多聚甲醛经左心室灌注固定后取脑,后固定24 h,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片,片厚5 μm。切片二经甲苯脱蜡,梯度乙醇降至水,HE染色。每只鼠连续3张冠状背侧海马切片,采用图像分析仪(美国Bio-Rad公司)计数正常神经元,取均值。
1.3 磷酸化P38MAPK和Aβ免疫组化 切片常规脱蜡至水,枸橼酸盐微波修复,分别滴加磷酸化P38MAPK抗体(1∶200)、Aβ抗体(1∶150),湿盒中4℃过夜,IgG抗体-HRP多聚体(PV二步法),37℃温箱30 min,DAB显色,苏木素复染,脱水、透明、封片。以PBS代替一抗作阴性对照。镜下观察并摄片,阳性率的定量分析:每个标本取5张切片,400倍光镜下每张切片在海马随机选取4个视野,用计算机图像分析系统(Bio-Rad)对各组阳性细胞进行吸光度(absorbance,A)分析。
1.4 免疫印迹法测定磷酸化P38MAPK和Aβ 大鼠致死后,迅速取双侧海马区组织,称量0.6 g,4℃PBS充分洗涤,加入3倍体积的4℃全细胞裂解液,冰浴中匀浆,4℃离心5 min,12 000 r/min,取上清。考马斯亮蓝法测各样本的蛋白含量,样本贮存于-80℃备用。检测步骤:蛋白样品40 μg与等体积上样缓冲液混合,煮沸10 min,100 g/L十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,封闭液室温下震荡2~3 h,加入抗体(磷酸化 P38MAPK,1∶2 000;Aβ,1∶1 500),4℃孵育过夜,TBST洗膜,标记的二抗,37℃孵育1 h,TBST洗膜,ECL显色,用图像分析仪测定光密度,作定量分析。
1.5 学习和记忆功能检测 按照 Smith等〔4〕的方法,采用Morris水迷宫进行检测,上午、下午各一次,记录各组老龄大鼠搜索安全岛(即平台)潜伏期时间(单位时间:s);和撤去平台后动物穿越原平台位置的次数,取检测记录的总均值。
1.6 统计学处理 应用SPSS统计分析软件对数据进行统计分析数据以±s表示,进行方差分析和t检验。
2 结果
2.1 病理结果 对照组海马神经细胞形态结构正常,排列整齐致密,可见少数变性坏死的神经元;模型组中,海马神经元结构在1 d即出现形态结构改变,表现为细胞变性水中,随时间延长至3 d、5 d,经细胞结构损伤明显,视野内可见有死亡形态改变的神经细胞,表现为细胞周围空隙增宽、胞核皱缩浓染等,存活神经元密度明显减少(P<0.05);SB203580干预后形态结构损伤减轻,存活神经元密度均增加(P<0.05)。见表1、图1。
2.2 磷酸化P38MAPK和Aβ免疫组化结果 磷酸化p38MAPK阳性表达主要位于细胞核,少量表达在细胞浆;Aβ阳性表达主要位于细胞质。阳性细胞的胞质可见细小的棕黄色颗粒。对照组大鼠海马区有少量磷酸化p38MAPK和Aβ的阳性细胞,染色较淡。SD后1 d、3 d、5 d,磷酸化P38MAPK和Aβ均呈不同程度地表达,二者阳性细胞主要分布在海马敏感区CA1区、其次在CA2、CA3区,齿状回也少量有分布。磷酸化p38MAPK阳性反应SD后1 d开始逐渐增强,5 d达高峰,此时显色最深。Aβ在SD后1 d逐步增高,5 d达高峰,显色最深。SB20358干预组中P38MAPK和Aβ阳性细胞数目和阳性反应灰度值减弱。见图2、图3,表2、表3。
表1 各组海马区的神经元密度比较(± s,n=10)

表1 各组海马区的神经元密度比较(± s,n=10)
1)与对照组比较,2)与模型组比较:P<0.05,下表同
模型组 17.85±3.921) 15.65±3.181) 12.12±2.981)SB203580 20.63±3.461)2) 18.86±3.071)2) 17.63±3.281)2)
表2 海马磷酸化p38MAPK蛋白的吸光度比较(± s,n=10)

表2 海马磷酸化p38MAPK蛋白的吸光度比较(± s,n=10)
组别1 d 3 d 5 d对照组1.96±0.58 1.88±0.62 1.98±0.64模型组 4.28±1.251) 8.60±3.201) 12.68±4.591)SB203580组 2.98±1.002) 4.86±2.282) 8.48±3.682)
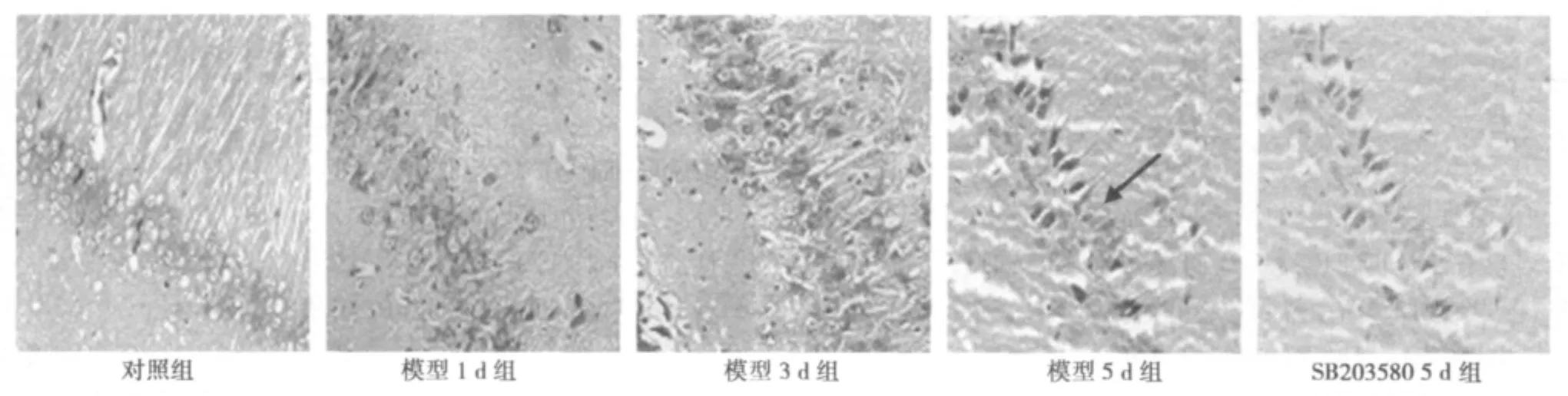
图1 各组神经元形态变化(箭头示坏死神经细胞)(HE,×200)
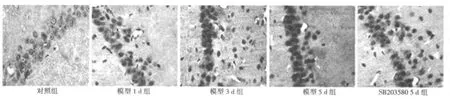
图2 各组磷酸化p38MAPK的表达(DAB,×400)
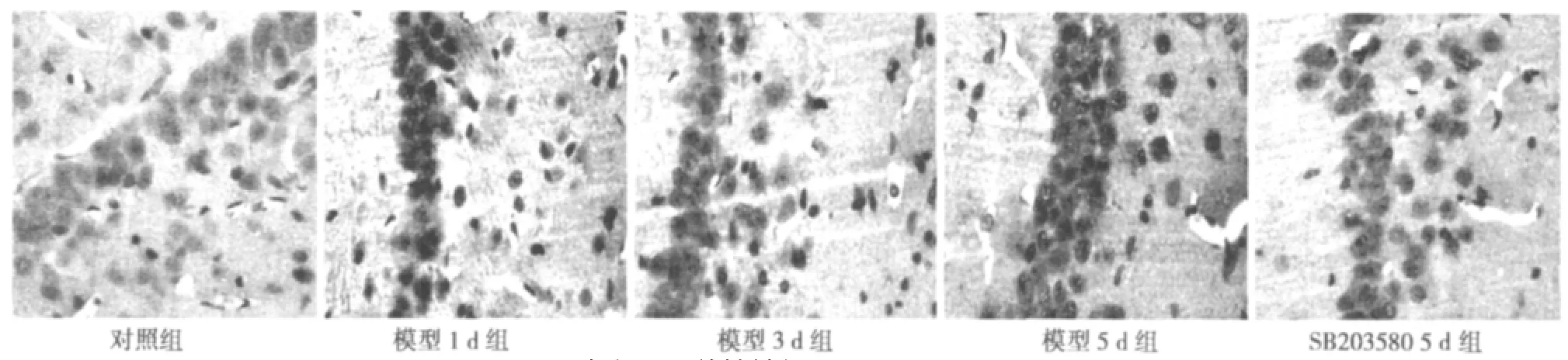
图3 各组Aβ养性神经元(DAB,×400)
2.3 磷酸化P38MAPK和Aβ免疫印迹法分析结果 与对照组比较,模型组中磷酸化p38MAPK、Aβ蛋白水平在SD 1 d、3 d、5 d时间点表达上调。SB20358干预组中磷酸化p38MAPK、Aβ蛋白水平下降。见表4、表5。
表3 海马Aβ蛋白的吸光度比较(± s,n=10)

表3 海马Aβ蛋白的吸光度比较(± s,n=10)
组别1 d 3 d 5 d对照组1.40±0.37 1.52±0.55 1.48±0.52模型组 4.78±2.011) 7.98±3.291) 10.68±4.261)SB203580组 2.54±1.162) 4.16±2.082) 6.48±3.282)
2.4 学习记忆功能结果 与对照组比较,模型组老龄大鼠搜索安全岛潜伏期为明显延长、穿越原平台位置的次数减少(P<0.05);SB20358干预可缩短老龄大鼠搜索安全岛潜伏期时间、增多穿越原平台位置的次数(P<0.05),见表6。
表4 海马磷酸化p38MAPK蛋白表达水平比较(± s,n=10)
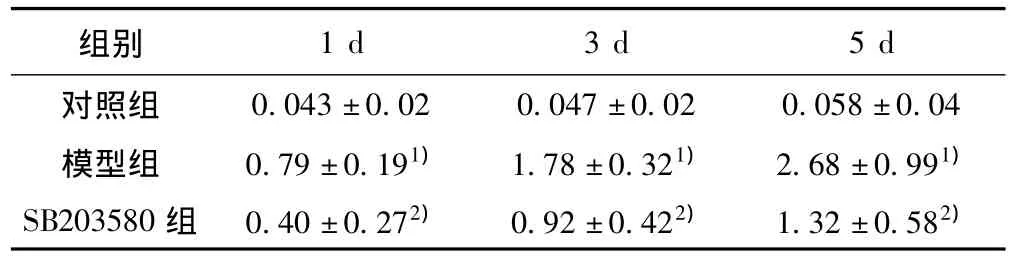
表4 海马磷酸化p38MAPK蛋白表达水平比较(± s,n=10)
?
表5 海马Aβ蛋白表达水平比较(± s,n=10)
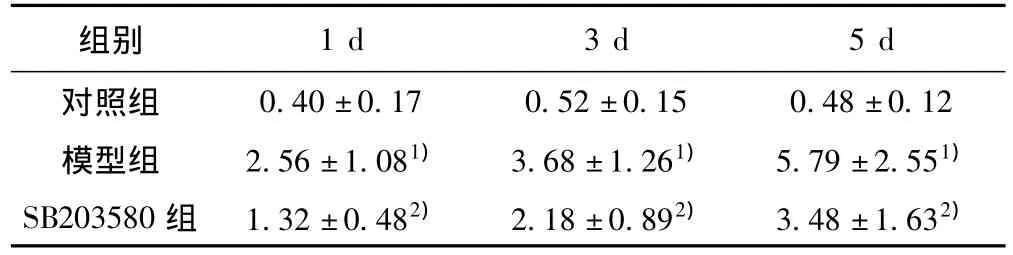
表5 海马Aβ蛋白表达水平比较(± s,n=10)
?
表6 各组大鼠水迷宫检测结果(± s,n=10)

表6 各组大鼠水迷宫检测结果(± s,n=10)
组别 潜伏期(s)1 d 3 d 5 d穿越平台次数(次)1 d 3 d 5 d对照组 65.5±8.5 64.7±6.8 65.8±8.5 9.20±1.52 9.25±1.62 9.31±1.58模型组 98.5±21.81) 115.6±24.51) 128.8±28.01) 6.48±1.111) 4.88±1.261) 2.28±1.101)SB203580组 78.0±18.71)2) 80.5±25.71)2) 96.8±24.81)2) 7.98±1.321)2) 6.68±1.121)2) 4.17± 1.151)2)
3 讨论
本实验采用“改良多平台睡眠剥夺法”建立动物模型,对老龄大鼠进行不同时间的SD,结果显示,与对照组比较,随SD时间延长,模型组中老龄鼠搜索安全岛潜伏期为明显延长、穿越原平台位置的次数减少,说明SD可降低老龄鼠学习记忆功能。
海马是大脑的重要结构,在学习和记忆功能以及调节神经内分泌和自主神经活动中起重要作用。研究显示损毁双侧海马可大大妨碍动物视觉分辨学习,使大鼠Y迷宫分辨学习和防御条件反应的保持遭到严重的破坏〔5〕。本实验结果,随睡眠剥夺时间延长,模型组动物海马区神经细胞形态结构发生改变,在第3、5天可见明显坏死细胞,说明睡眠剥夺可造成海马结构损伤。近期研究显示在Alzheimer's病(AD)、老年性痴呆等认知功能障碍等病变中,均有海马区信号转导系统发生紊乱〔2,3〕。MAPKs信号通路是连接大多数细胞外信号与膜受体、转录因子和各基因调节的中央信号通路,其家族成员包括细胞外信号调节激酶(ERK)、C-Jun氨基末端激酶(JNK)和p38 MAPK等。研究认为P38MAPK信号的活化对中枢神经系的影响主要表现为负性调节作用,其活化后通过介导了许多炎性因子和致病因素,直接对海马神经突触可塑性产生损伤,导致长时程增强(LTP)的损伤从而致空间学习能力受损〔6,7〕。胡亚卓等〔8〕发现多奈哌齐可改善血管痴呆模型动物的学习记忆成绩,而这与抑制海马区P38MAPK活化有关。本研究结果,随SD时间延长,海马区磷酸化p38MAPK明显增高,给予SB2035806干预后,海马区神经细胞形态结构损害减轻、磷酸化p38MAPK表达下降、动物学习记忆得到改善,这说明P38MAPK信号活化参与了睡眠剥夺导致认知功能损伤的病理过程,并在该进程中具有关键作用。
Aβ来源于它的前体物质淀粉样前体蛋白APP通过β-分泌酶和γ-分泌酶剪切而产生〔9〕,具有神经毒性,包括:介导氧化应激损伤、炎症反应、损伤胆碱能神经系统、诱导神经细胞凋亡等。已有研究表明:APP和学习记忆密切相关,APP缺陷的小鼠出现年龄依赖性的认知功能的障碍,大脑神经元突触密度下降〔10〕。在AD的动物模型实验中,Aβ疫苗可以抑制Aβ斑的形成,阻止认知能力的衰退〔11〕。本研究结果显示,模型组中大鼠海马区Aβ浓度明显增加,提示SD导致认知功能损伤与Aβ有关。同时,我们发现SB2035806组海马区Aβ表达减少,说明SD过程中,P38MAPK信号活化与Aβ产生有关。结合文献〔12〕推测SD后活化的P38MAPK信号通过介导炎性因子IL-1β及TNF-α形成,促进Aβ的沉积,从而导致神经细胞损伤,神经功能缺失。SD后P38MAPK信号转导与Aβ之间的确切机制尚需进一步研究。
1 刘小平,陈长香,李建民,等.改善睡眠质量对老年人记忆功能的影响〔J〕.中国老年学杂志,2010;30(8):1119-20.
2 Lennmyr F,Karlsson S,Gerwins P,et al.Activation of mitogen-activated protein kinases in experimental cerebral ischemia〔J〕.Acta Neurol scand,2002,106(6):333-340.
3 Swatton JE,Sellers LA,Faull RL,et al.Increased MAP kinase activity in Alzheimer's and Down syndrome but not in schizophrenia human brain〔J〕.Eur J Neurosci,2004;19(10):2711-9.
4 Smith DH,Okiyama K,Thomas MJ,et al.Evaluation of memory dysfunction following experimental brain injury using the Morris water maze〔J〕.Neurotrauma,1991;8(4):259-69.
5 Deller T,Nitseh R.Associational and commissural afferents of parvdlbumin-immunoreactive neurons in the rat hippocampus:a combined immunocytochemical and PHA-L study〔J〕.ComP Neurol,1994;350(4):612-22.
6 袁 辉,杨 胜,周文霞,等.MAPK级联信号通路与长时程增强〔J〕.中国药理学通报,2006;22(7):769-74.
7 Berkeley JL,Comeza J,Wess J,et al.1M1 muscarinic acctylcholine receptors activate extracellular signial regulated kinase in CA1 pyram idal neurons in mouse hippocampal slices〔J〕.Mol Cell Neurosci,2001;18(5):512-24.
8 胡亚卓,王雪笠,吕佩源.血管性痴呆小鼠海马p38丝裂原活化蛋白激酶免疫组织化学表达及多奈哌齐的干预作用〔J〕.中国老年学杂志,2009;29(23):3074-6.
9 Blennow K,Deleon MJ,Zetterberg H.Alzheimer's disease〔J〕.Lancet,2006;368(9533):387-403.
10 Dawson GR,Seabrook GR,Zheng H,et al.Age-related cognitive deficits,impaired long-term potentiation an reduction in synaptic marker density in mice lacking the β-amyloid precursor protein〔J〕.Neuroscience,1999;90(1):1-13.
11 Liu Y,Walter S,Cherny D,et al.LPS receptor(CD14):a receptor for phagocytosis of Alzheimer's amyloid peptide〔J〕.Brain,2005;128(8):1778-89.
12 Li Y,Liu L,Kang J,et al.Neuronal-glial interactions mediated by interleukin-1 enhance neuronal acetylcholinesterase activity and mRNA expression〔J〕.Neurosci,2000;20(1):149-55.
