四嗪二甲酰胺对 K562和 K562/Adr的 作用及其与 NF-κB信号分子的关系
2011-09-11张玉霞周永列邱莲女
张玉霞 周永列 徐 菲 邱莲女
慢性粒细胞白血病(CML)的分子病因是由 9号染色体和 22号染色体易位所形成的费城染色体(philadelphia chromosome,Ph+)。这一易位形成的BCR/Abl融合基因编码一个具有促进细胞增殖功能的 p210 BCR/Abl融合蛋白。这种蛋白还存在于约一半 Ph+的成人急性淋巴细胞白血病(ALL)中[1,2]。在髓系白血病中,p210 BCR/Abl可激活核因子 κB(nuclear factor kappa B,NF-κB),引起更多的 NF-κB进核,并提高 NF-κB的转录活性[3],研究发现,NF-κB异常的激活与白血病细胞的耐药及抗凋亡基因的异常表达密切相关,这些耐药或抗凋亡因子是白血病复发或难治的重要原因[4~6]。因此选择性地调控NF-κB的活性,阻断 NF-κB信号传导通路,下调耐药或凋亡抑制蛋白的异常表达,有望成为以一种新的治疗途径。
四嗪二甲酰胺(ZGDHu-1)是一种新的四嗪类化合物(图1),该化合物以乙醛和四合肼为原料,由胡惟孝教授等经过十多年的努力设计合成,已获国家专利,具有较强的抗肿瘤作用[7~9]。ZGDHu-1对耐药细胞株 K562/Adr(K562-R)的研究还未见报道。故本研究将采用体外实验法探讨 ZGDHu-1对慢性粒细胞白血病细胞株 K562(K 562-S)及其耐药细胞株 K 562/Adr(K562-R)NF-κB的表达及细胞凋亡的影响。
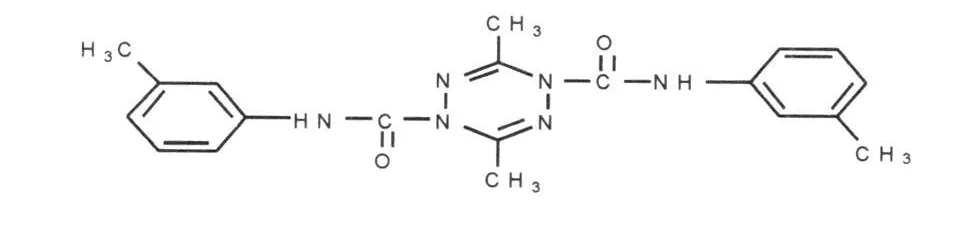
图1 ZGDHu-1的分子结构
材料与方法
1.材料:ZGDHu-1由浙江工业大学药学院制药工程研究所合成,系白色片状结晶。贮存液(1mg/ml)用二甲亚砜溶解,应用液用含 10%小牛血清的RPMI 1640(Gibco公司产品)配制。二甲亚砜、噻唑蓝(MTT)、蛋白酶 K为 Sigma公司产品;鼠抗人 Abl、 PARP-1、NF-κB/p65、兔抗人 β -actin及LaminA/C单克隆抗体,LaminA/C抗体为美国Santa Cruz公司产品,,膜联蛋白 V(Annexin V)/异硫氰酸荧光素(FITC)试剂盒购自美国 Bender公司。DNA-Prepkit为美国 Beckman-Coulter公司产品。
2.细胞培养:K562细胞(K562-S)用含 10%小牛血清的RPMI 1640培养液在 37℃、5%CO2条件下培养。耐药细胞株K 562/Adr(K562-R)为阿霉素诱导 K 562细胞建立的耐药型细胞株,由浙江大学肿瘤研究所提供。2~3天换液 1次,实验时取对数生长期细胞,以无药物的无血清培养液静置6h后,计数活细胞数在 90%以上时分组,加药干预,实验重复 3次。
3.MTT法测定 ZGDHu-1对 K 562细胞生长的影响:调整细胞浓度为 5×104/m l,接种于 96孔培养板中,每孔 200μl。计算抑制率,求出 ZGDHu-1对K 562细胞的半数抑制浓度(IC50)。
4.Hoechst 33258荧光染色检测细胞凋亡:收集 ZGDHu-1作用 48h后的细胞,涂片后用固定液(甲醇∶冰醋酸为3∶1)4℃固定 5m in,蒸馏水冲洗后加 5mg/L Hoechst 33258荧光染色 10m in,用蒸馏水冲洗后封片在荧光显微镜下观察拍照。
5.G0/G1期细胞分析:收集 ZGDHu-1(0.25μg/m l)作用48h后的细胞悬液,用冷 PBS各洗涤 1次,加 50μl DNAPrepkit透膜液,放置 1min,然后加碘化丙锭染液(PI)200μl作用 15m in后,在 EPICS-XL型流式细胞仪(Beckman-Coluter产品)上分析,检测分析至少 104个以上细胞。
6.细胞克隆形成分析:用 PBS配制 1%琼脂糖凝胶,微波炉中融化置于 40℃水浴中,将平衡好的琼脂糖胶和 2×1640培养基1∶1混合,快速倒入六孔板中,每孔 3ml,然后配制0.7%的琼脂糖凝胶,将细胞浓度调为 1×103个/孔,分别加入相应浓度 ZGDHu-1,与 0.7%的琼脂糖凝胶1∶1混合,并快速加入到第一层凝胶上,将培养板置 37℃培养箱中培养。培养 7天后观察结果。
7.Western blot印迹定量分析 NF-κB/p65、p 210 BCR/Abl及 PARP-1蛋白的表达:药物作用后的细胞经离心收集,4℃预冷的 PBS洗涤细胞 2次,加入 100μl细胞裂解液冰浴30min,4℃14000g离心 15m in,收集上清液,采用 Pierce BCA Protein Assay Kit进行蛋白定量。取 50μg蛋白按比例加入 5×SDS上样缓冲液,沸水浴 5m in变性蛋白质,以 50μg/泳道上样,采用 15%十二烷基硫酸钠 -聚丙烯酰胺凝胶(SDS.PAGE)电泳 50min,移至硝酸纤维素膜上,含 5%脱脂奶粉的TBST室温封闭 60m in,分别加入 NF-κB/p 65、Ab l、PARP-1及 β-actin一抗(稀释浓度为1∶1000~1∶500),4℃孵育过夜,用含 0.05%Tween20的 TBS洗涤后,加入1∶2000二抗室温孵育 2h,ECL底物孵育,曝光洗片后数码照相保存。图像以GDS 8000图像分析系统分析,以相应蛋白条带的平均光密度值与β-actin平均光密度值的比值表示各组蛋白表达水平。
8.统计学处理:所有的数据均用 SPSS 12.0 for windows软件包进行处理,数据用±+s表示,两组间比较采用 t检验,以 P<0.05为差异有统计学意义。
结 果
1.ZGDHu-1抑制 K562-S及 K562-R细胞增殖的效应:MTT比色法利用活细胞线粒体中的琥珀酸脱氢酶能使外源性 MTT还原为难溶性的蓝紫色结晶物并沉积在细胞中的原理,用于检测细胞活性。不同浓度的 ZGDHu-1对 K562-S细胞均有增殖抑制作用,呈现剂量 -时间依赖关系。ZGDHu-1处理48h和 72h时的 IC50值分别为 0.25μg/ml、0.08μg/ml(图2)。
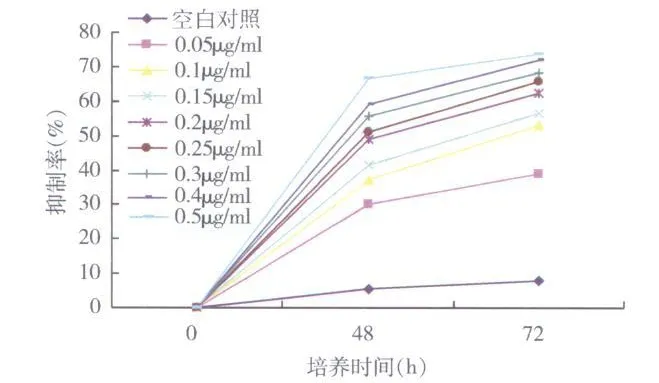
图2 不同浓度ZGDHu-1处理不同时间对K 562-S细胞增殖抑制作用
2 ZGDHu-1诱导 K562-S及 K562-R细胞凋亡的检测结果:ZGDHu-1作用 48h后,光镜下可观察到 K562-S及 K 562-R细胞染色质固缩、胞核碎裂等典型的凋亡形态,经过 Hoechst 33258荧光染色后,在荧光显微镜(×400)可见凋亡细胞的细胞核或细胞质内浓染致密的颗粒荧光(图3)。
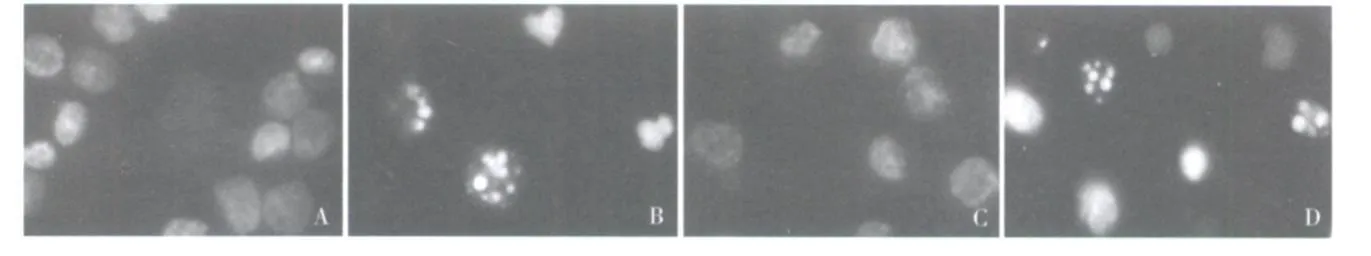
图3 K 562-S及 K 562-R细胞的凋亡
3.细胞克隆实验的结果:为了判断 ZGDHu-1是否对白血病干细胞具有增殖抑制作用,我们在体外应用了细胞克隆形成实验。在 ZGDHu-1作用 7天后,K562-S及 K562-R细胞克隆形成被完全的抑制(图4),这一结果暗示了 ZGDHu-1可能有诱导白血病干细胞凋亡的作用。既然白血病干细胞通常存在于细胞周期的静止期,我们进一步用流式细胞仪分析了 G0/G1期细胞数的变化,K562-S及 K562-R细胞在 G0/G1期的细胞数分别 41.27%±0.81%、42.68%±0.78%,当 ZGDHu-1作用 48h后,分别减少为 21.65%±0.95%、29.32%±1.21%,这一结果提示 ZGDHu-1可能作用于静止期的白血病干细胞[10]。

图4 ZGDHu-1抑制 K 562-S及 K 562-R细胞克隆形成
4.ZGDHu-1作用后 K562-S及 K562-R细胞PARP-1、p210 BCR/Abl及 NF-κB/p65蛋白的表达的变化:Western blot实验结果表明,与对照组比较,ZGDHu-1处理 K562-S及 K562-R细胞 48h后,均使聚腺苷酸二磷酸核糖转移酶[poly(ADP-ribose)polymerase,PARP]裂解,诱发细胞凋亡。与对照组相比,细胞内的 p210 BCR/Abl、c-Ab l及 NF-κB/p65的表达均明显减少,差异具有统计学意义。表明 ZGDHu-1能够下调 K562-R细胞 p210 BCR/Abl及 c-Abl的表达,抑制 K562-S及 K562-R细胞胞质内 NF-κB/p65的表达 (图5、表1)。
讨 论
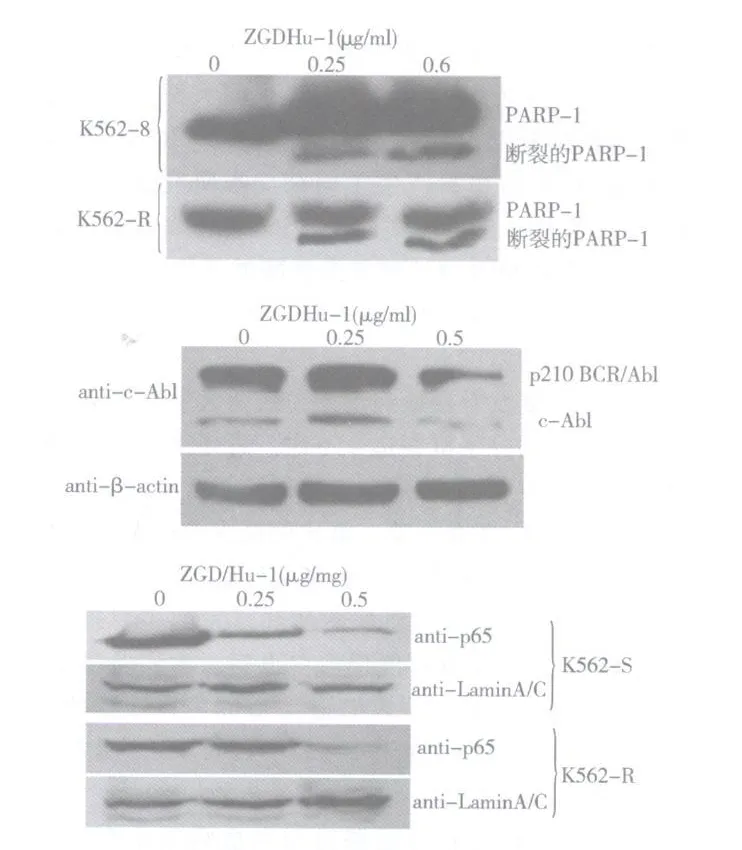
图5 ZGDHu-1作用后 K 562-S及 K 562-R细胞PARP-1、p 210Bcr/Abl及 NF-κB/p65蛋白的表达
表1 ZGDHu-1对 K 562-S及 K 562-R细胞 p210Bcr/Abl及 NF-κB/p 65蛋白表达的影响(比值,±+s)

表1 ZGDHu-1对 K 562-S及 K 562-R细胞 p210Bcr/Abl及 NF-κB/p 65蛋白表达的影响(比值,±+s)
*P<0.05,与对照组相比具有显著性差异
组别 K 562-S细胞NF-κB/p65/β-actin K 562-R细胞p 210BCR/Abl/β-actin c-Abl/β -actin NF-κB/p65/β -actin对照组 1.65±0.150 1.12±0.211 0.34±0.092 1.92±0.121 0.25μg/m l组 0.97±0.110* 0.99±0.101* 0.23±0.031* 1.21±0.130*0.5μg/m l组 0.56±0.083* 0.56±0.110* 0.11±0.023* 0.43±0.091*
寻找既能抑制肿瘤生长,又具高效低毒的抗癌药物,是目前抗肿瘤药物研究的主要方向。研究结果表明 ZGDHu-1能有效地抑制 K562-S及 K562-R细胞的增殖,呈现剂量 -时间依赖效应,并能使聚腺苷酸二磷酸核糖转移酶[poly(ADP-ribose)polymerase,PARP]裂解,PARP是存在于真核细胞中催化聚ADP核糖化的细胞核酶,而在 PARP家族成员中以PARP-1结构最典型,其相对分子质量为 116kDa。在细胞凋亡过程中,半胱 -天冬蛋白酶casepase-7和 casepase-3可以通过识别 PARP-1核定位信号(NLS)的 DEVD模序,促使 DNA结合域与催化域分离导致 PARP-1分裂成 p89和 p24两个片段,后者可不可逆结合于 DNA缺口,抑制 PARP-1与 DNA缺口结合能力,导致 PARP-1损伤修复作用丧失,诱发凋亡[11]。另外,PARP-1在凋亡诱导因子(AIF)介导的半胱 -天冬蛋白酶非依赖型的细胞凋亡中发挥重要作用[12]。可见 PARP-1的裂解在凋亡机制中发挥着重要作用。本研究发现,ZGDHu-1作用K562-S及 K562-R细胞 48h后 PARP-1发生裂解,诱导细胞凋亡。
BCR/Abl已被证明是造成白血病的癌基因,BCR/Abl激酶可以将磷酸盐从 APT上转到各种底物的酪氨酸残基上面引发慢性粒细胞性白血病(CML),可见 BCR/Abl激酶在 CML发生、发展中发挥了关键性的作用,因此,Abl蛋白酪氨酸激酶的抑制剂应该能有效地选择性地治疗 CML和其他 BCR/Abl阳性的白血病[13~15]。然而,目前大部分使用酪胺酸激酶抑制剂治疗的病人,由于其 BCR/Abl激酶的突变,对此药物都产生了耐药。本研究证实,ZGDHu-1在体外能抑制耐药型 K562细胞的增殖的同时,有效抑制 BCR/Abl酪氨酸激酶的活性,下调包括p210BCR/Abl及 c-Abl的表达。这为其靶向性治疗打下了重要的基础。
耐药与复发是白血病治疗失败两大主要原因,但其病因与确切分子机制迄今不详。近年来,已有越来越多的研究表明,白血病患者体内除了含有大量幼稚白血病细胞外,还存在着一群比例极少的白血病干细胞(LSCs)。这些肿瘤性干细胞对目前常用的化疗药物不敏感,被认为是白血病耐药和复发的主要根源,只有清除 LSCs才有可能根治白血病。本实验显示,ZGDHu-1在对 k562-S细胞及 k562-R细胞的克隆形成均有一定的抑制作用,表明其对 LSCs具有一定的影响,其具体的机制有待进一步的研究。
NF-κB信号传导通路是与白血病发生有关的重要途径。NF-κB家族主要的二聚体是 RelA(p65)/NF-κB1(p50)异源二聚体,但只有 p65的末端含有反式激活结构域,具有激活基因转录的作用,是 NF-κB活性形式的主要成分,因此实验中常常检测 NF-κBp65代表NF-κB的活性。研究表明,NF-κB持续激活与白血病的发生、发展关系密切,许多因素可以诱导 NF-κB激活,启动基因的异常转录活动,NF-κB是一种细胞凋亡相关因子,可诱导多种细胞因子(IL-2,3,6,12,GM-CSF)产生,从而抑制细胞凋亡,其对细胞凋亡的抑制在肿瘤细胞多重耐药机制的形成中起一定作用。NF-κB的不适当激活与细胞耐药有密切关系,对 NF-κB进行调控已成为目前抗肿瘤治疗的热点。本实验结果显示,ZGDHu-1本身对 K562-S及 K562-R细胞有生长抑制作用,同时 ZGDHu-1可以抑制 K562-S及K562-R细胞的 NF-κB的活性。综上所述,ZGDHu-1有望成为一种治疗慢性白血病的新药,尤其对于耐药型白血病的治疗具有广泛的应用价值。
1 FaderlS,Talpaz M,Estrov Z,etal.The biology of chronicmyeloid leukem ia.N Engl JMed,1999,341(3):164-172
2 Deininger M,Goldam J,Melo J.Themolecular biology of chronicmyeloid leukem ia.Blood,2000,96(10):3343-3356
3 陈为志,刘传芳,李丽珍,等,选择性抑制转录核因子 κB活性对白血病 K 562细胞生存素表达的影响.中华医学杂志,2007,87(10):714-716
4 Pomm ier Y,Sordet O,Antony S,et al.Apoptosis defects and chemotherapy resistance:Molecular interaction maps and networks.Oncogene,2004,23(16):2934-2949
5 CilloniD,Martinelli G,Messa F,etal.Nuclear factor kB asa target for new drug development in myeloidmalignsncies.Haematologica,2007,92(9):1224-1229
6 Meteoglu I,Erdogdu IH,Meydan N,et al.NF-KappaB expression correlateswith apoptosisand angiogenesis in clear cell renal cell carcinoma tissues.JExp Clin Cancer Res,2008,27(1):53
7 胡惟孝,杨忠愚,周茂,等.新型抗癌药 3,6-二甲基 -1,4-二氢-S-四嗪 -1,4-二甲基酰胺类化合物及其制造方法.中国发明专利,证书号第 159831号
8 周永列,吕亚萍,胡惟孝,等.四嗪二甲酰胺体外抑制HL-60细胞增殖诱导凋亡分化作用研究.中华血液学杂志,2006,27(11):770-773
9 周永列,吕亚萍,胡惟孝,等.四嗪二甲酰胺诱导白血病细胞株SHI-1凋亡及其分子机制研究.中国实验血液学杂志,2007,15(3):483-489
10 Holtz MS,Forman SJ,Bhatia R.Nonproliferating CML CD 34+progenitors are resistant to apoptosis induced by a wide range of proapoptotic stimuli.Leukem ia,2005,19(6):1034-1041
11 Koh DW,Dawson TM,Dawson VL.Mediation of cell death by poly(ADP-ribose)polymerase-1.Pharmacol Res,2005,52(1):5-14
12 Yu SW,Wang H,PoitrasMF,et al.Mediation of poly(ADP-ribose)polymerase-1-dependent cell death by apoptosis-inducing factor.Science,2002,297(5579):259-263
13 Ren R.Mechanisms of BCR-ABL in the pathogenesis of chronicmyelogenous leukaemia.Nat Rev Cancer,2005,5(3):172-183
14 Sawyers CL.Opportunitiesand challenges in the development of kinase inhibitor therapy for cancer.Genes Dev,2003,17(24):2998-3010
15 Melo JV,Deininger MW.Biology of chronic myelogenous leukemiasignaling pathwaysof initiation and transformation.Hematol OncolClin North Am,2004,18(3):545-568
