应用荧光原位杂交技术检测停育胚胎或绒毛染色体数目异常
2011-09-07张宁闫素文郝冬梅徐斌
张宁,闫素文,郝冬梅,徐斌
(解放军沈阳202医院全军计划生育优生优育技术研究所,辽宁 沈阳 110003)
近年来胚胎停育的发生率日益增高,成为临床的常见病和多发病。胚胎停育是指妊娠早期因某种原因所致胚胎发育停止,胚胎停育不同于孕中期和孕晚期的流产和过期流产,也有别于早期流产,它是在胎儿尚未形成的时候就停止了发育。主要通过B超监测妊娠囊、胎心和血β-HCG进行诊断。遗传因素是导致胚胎停育的重要原因,而指导临床查找遗传因素最常见的方法是绒毛培养染色体分析[1,2]。停育胚胎绒毛大多已坏死无法达到新鲜、无菌要求,培养的失败率较高。本文应用荧光原位杂交技术 (fluorescence in situ hybridization,FISH)对停育胚胎绒毛染色体数目异常进行快速检测并评估其临床应用价值,对研究胚胎停育提供一个新的检测手段。
1 资料与方法
1.1 资料 选取2010年4月至2011年4月到解放军第202医院全军计划生育优生优育技术研究所门诊就诊的66例胚胎停育患者,患者年龄20~40岁,孕周6~12周,符合胚胎停育诊断指征:当孕周≥6周无妊娠囊,妊娠囊已≥4 cm超声看不到胎芽,胎芽的头臂长度≥1.5 cm无胎心搏动。
1.2 试剂 产前染色体数目检测试剂盒为北京金菩嘉医疗科技有限公司出品,国食药监械 (准)字2009第3400010号。试剂盒包含两组DNA探针,一组探针为 GLP 13(DLEU2)/GLP 21(DSCR2),另一组为探针为CSP 18/CSP X/CSP Y。
1.3 绒毛标本处理及玻片制备 取绒毛约5mg,用生理盐水将样本洗净,无菌剪刀或镊子去掉蜕膜组织选取绒毛,尽可能剪碎并注意避免母体细胞的污染,将不能剪碎的标本去除,该操作可在显微镜下进行。加入5 ml预热至37℃的0.075 M KCl溶液,37℃低渗20 min,期间轻轻吹打悬浮细胞2~3次,弃上清。缓慢加入2 ml固定液 (甲醇∶冰乙酸=3∶1)进行预固定,轻轻吹打混匀后1 500 rpm,离心10 min。去上清,加入5 ml固定液,混匀固定,静置10 min,期间吹打 1次,1 500 rpm。离心10 min,反复固定2次。去上清,加1 ml冰醋酸消化约1 min,加3 ml甲醇终止消化。离心,去上清,根据细胞量加适量固定液混匀后滴片。室温下过夜或56℃烤片至少2 h使玻片老化。室温干燥保存。
1.4 FISH杂交 室温下于2XSSC(pH 7.0)溶液中漂洗玻片5 min。37℃下终浓度0.08 mg/ml胃蛋白酶工作液中消化5 min,可根据实际情况进行调整,室温下于2XSSC(pH 7.0)溶液中漂洗5 min。将玻片依次置于 70%乙醇、85%乙醇、100%乙醇中各3min脱水,自然干燥。
甲酰胺变性杂交:将探针混合物置于73℃水浴锅中变性5 min后迅速置于45~50℃水浴锅中,杂交前取出。将玻片在 (73±1)℃的变性液中浸泡5min,依次置于预冷的70%乙醇、85%乙醇和100%乙醇中各3 min进行梯度脱水。玻片自然干燥后,置于45~50℃ 烤片机上预热2~5 min后与探针杂交。若以下探针混合物尚未完成变性,玻片可置于45~50℃烤片机上较长时间预热。将10 μl变性后的探针混合物滴于玻片杂交区域,立即加盖盖玻片,用橡皮胶封边。将玻片置于预热的湿盒中,42℃保温箱中过夜杂交。
移除盖玻片,立即放入46℃水浴锅2×SSC溶液中,漂洗10 min,振荡1~3 s;将玻片置于46℃水浴锅0.1%NP-40/2×SSC溶液中,漂洗5 min,振荡1~3 s;然后将玻片室温浸泡在70%乙醇中,漂洗3 min,自然干燥。将玻片室温浸泡在70%乙醇中,漂洗3 min,暗处自然干燥玻片。将15 μl DAPI复染剂加至目标区域,立即盖上盖玻片。暗处放置10~20 min后观察。
1.5 13/18/21/X/Y染色体异常 FISH结果判读
探针组CSP18/CSPX/CSPY:探针在正常男性细胞核中显示1个红色信号,1个绿色信号和2个蓝色信号,在正常女性细胞核中显示2个绿色信号和2个蓝色信号;探针组GLP13/GLP21:在正常细胞核中显示2个红色信号、2个绿色信号;
每组探针计数至少100个细胞;单独判断每种指标,正常细胞比例大于90%,提示该指标无异常;某指标异常细胞比例大于60%,提示该指标异常;单个指标异常细胞比例均小于10%,提示为正常结果;某种指标异常比例介于10%~60%之间,加大观测样本细胞数目,如实记录异常细胞比例 (如:30%细胞GLP 21 FISH结果显示三个信号点),低于判断非嵌合体状态的异常标准 (60%),出现这种异常的原因可能有胎儿染色体异常嵌合体,胎盘特异性染色体异常嵌合体,母体细胞污染等,建议遗传咨询。
1.6 统计学方法 应用卡方检验。
2 结果
2.1 停育胚胎绒毛染色体核型分类 在66例绒毛样本中,13、18、21、X 和 Y 数目异常 20例,占46.97%。正常例数35例,其中男性19例,女性16例。间异例数11例,即10% <异常率<60%者。正常率53.0%,异常率30.3%,间异率16.7%。20例异常分析结果中异常类型所占百分比列于表1。
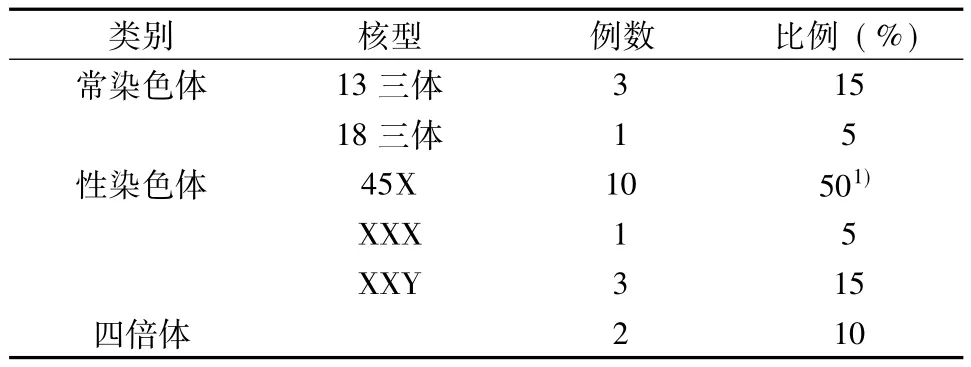
表1 20例异常绒毛染色体分析
2.2 停育胚胎绒毛染色体FISH图 (图1~4)
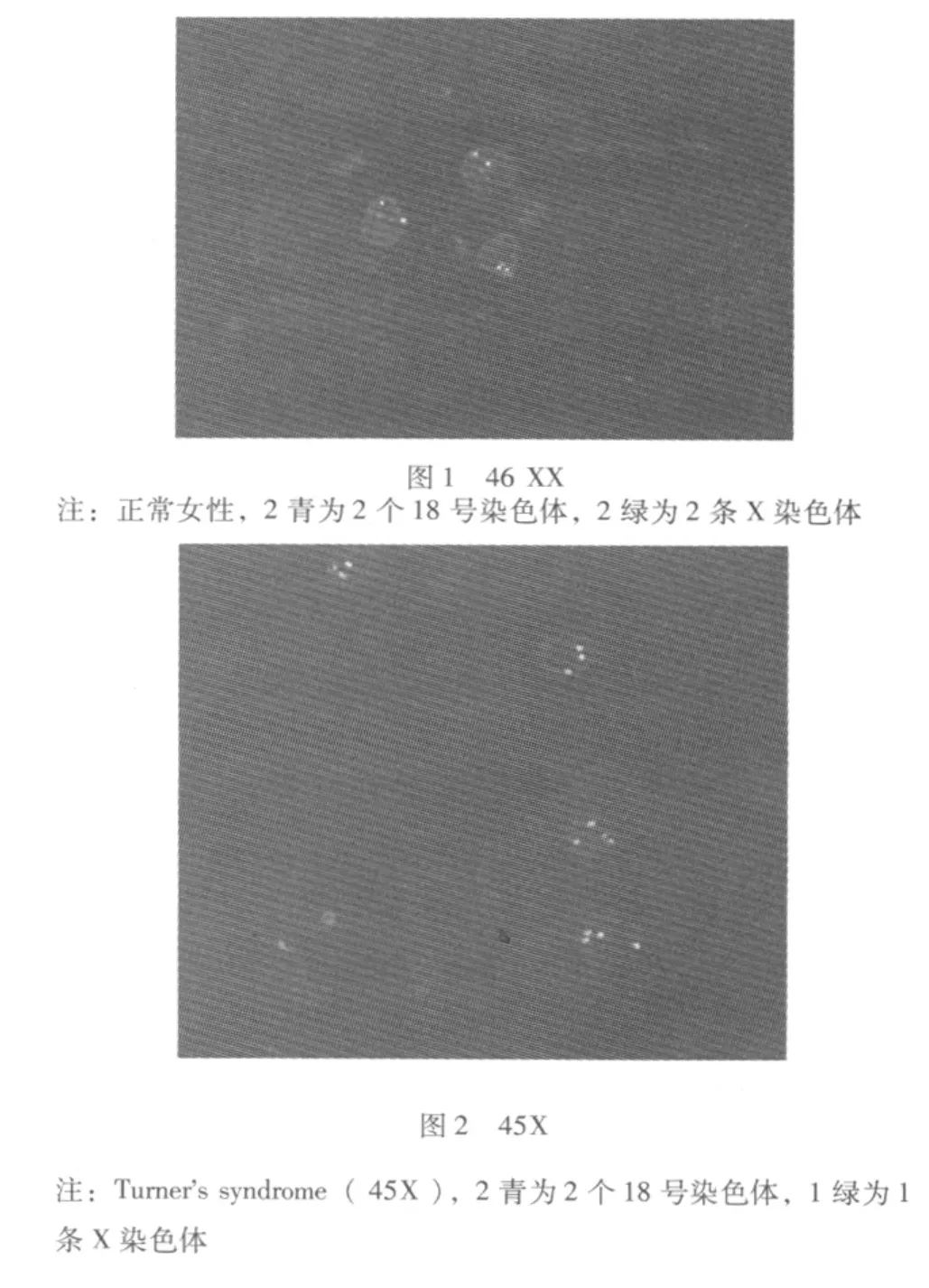
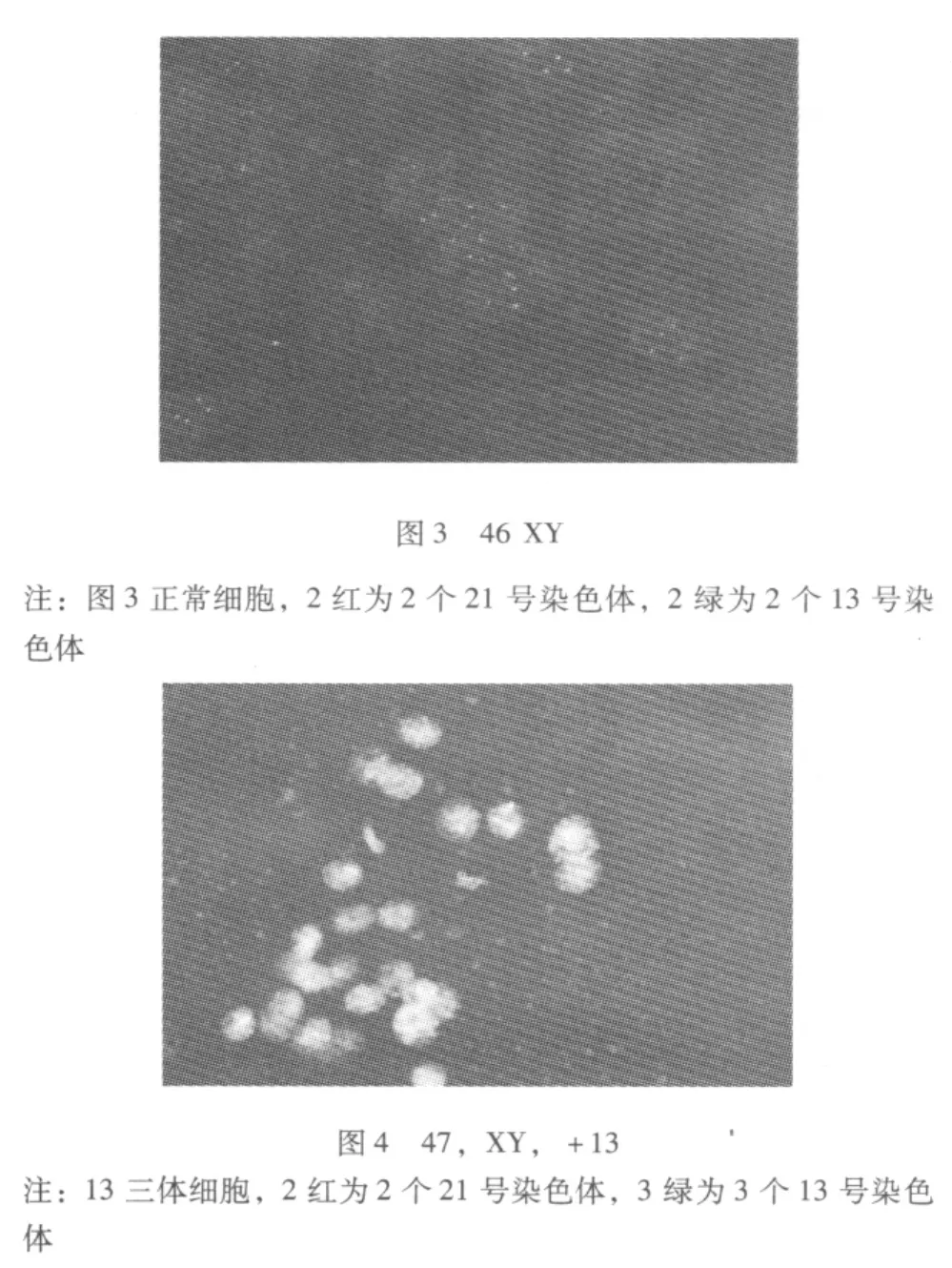
2.3 停育胚胎性别和异常染色体核型关系 66例停育胚胎中,女性胚胎34例 (51.5%),男性胚胎32例 (48.5%);31例染色体异常的胚胎中,女性18例 (58.1%),男性13例 (41.9%)。无论是在流产胚胎或异常核型胚胎中,女性胚胎发生停育和染色体异常的比例均高于男性胚胎。
3 讨论
由表1所见,在所有异常胚胎中性染色体异常占75%,其中Turner's syndrome 45X(TS 45X)所占比例最高与其他任何一种异常的发生率相比差异显著 (P<0.05)。45X是人类最多的染色体异常疾病之一,占出生女婴的1/2500,受精卵染色体为45X的占2%,是最常见的不正常受精卵,其能发育并出生的不到1%,流产胎儿7%为45X。纯型TS的产生是因为卵子或精子形成时减数分裂性染色体不分离的结果。嵌合型TS(45X /46XX,45X/46XX/47XXX)是因为在受精卵形成后,胚胎细胞分裂时染色体不分离的结果。
Iyer等[3]在对 TS胎儿的回顾性研究中发现,纯型TS(45,X)占74%,其余为嵌合型。表1结果显示,停育胚胎染色体核型均为纯型TS(45,X)。目前,卵母细胞和精原细胞究竟哪个在减数分裂时染色体不分离原因尚不清楚。大部分研究认为,TS的X染色体的大部分 (60% ~80%)是来源于母亲,Uematsu等[4]采用高多态标记的PCR技术分析雄激素受体基因甲基化状态,检测了50个具有各种核型状态的TS(45,X)患者正常染色体的父源性,数据显示大多数TS核型是父亲减数分裂错误产生不正常的性染色体,在有丝分裂时丢失,最终形成母亲染色体占主导地位45X细胞。Martínez-Pasarell等[5]曾采用 PCR 扩增和三色荧光原位杂交技术对5个X染色体多态和3个Y染色体片段进行了分析,共测定了来自TS4个患者父亲45 299和8个正常对照组的85 423个精子核,结果显示,这四个患者父亲表现出XY精子的比例显著增加 (平均0.22%,0.20% ~0.22%),对照 (平均0.11%,0.06% ~0.18%),减数分裂不分离错误增加,而性染色体精子减少。因此,停育胚胎中TS(45,X)占绝大多数的主要原因是男性精子细胞染色体发生了畸变,而这种畸变多为环境影响所致。这也可能是近年来胚胎停育发生率持续上升的重要原因。
通过FISH检测了停育胚胎绒毛染色体数目异常,不仅帮助胚胎停育夫妇了解疾病发生的原因,而且有效地指导孕妇成功妊娠并减轻其心理负担。研究结果对指导临床进一步从环境干扰物对配子和胚胎发育的影响,指明了一条新途径-精子染色质的损伤,对防止出生缺陷尤其是潜在的出生缺陷具有重要意义。FISH技术简单、快速和准确,对检测像胚胎停育这种以性染色体数目异常为主的疾病具有独到之处。但是由于它只能提供有限的染色体数目异常信息,不能检出染色体的结构异常,因此不适于产前诊断。
[1]周从容.自然流产儿的细胞遗传学研究[J].中华妇产科杂志,1990,25(2):89.
[2]李丽莎.57例自然流产胚胎染色体分析[J].中华医学遗传学杂志,1992,9(6):367.
[3]Iyer NP,Tucker DF,Roberts SH,et al.Outcome of fetuses with Turner syndrome:a 10-year congenital anomaly register based study[J].J Matern Fetal Neonatal Med,2011 [Epub ahead of print]
[4]Uematsu A,Yorifuji T,Muroi J,et al.Parental origin of normal X chromosomes in Turner syndrome patients with various karyotypes:implications for the mechanism leading to generation of a 45,X karyotype[J].Am J Med Genet,2002,111(2):134 -139.
[5]Martínez-Pasarell O,Nogués C,Bosch M,et al.Analysis of sex chromosome aneuploidy in sperm from fathers of Turner syndrome patients[J].Hum Genet,1999,104(4):345 -349.
