GnRH激动剂曲普瑞林对卵巢癌细胞OVCAR3生长的抑制作用及对GnRHⅠ受体、GnRHⅡ受体表达的影响
2011-09-06张艳赏张明明
李 敏,张艳赏,张明明,闫 萍
已有研究表明卵巢癌组织中有促性腺激素释放激素 (Gn-RH)Ⅰ、GnRHⅡ及其受体的表达[1],显示人卵巢癌细胞具有合成和分泌GnRH的功能。目前国内关于GnRH激动剂对卵巢癌细胞系作用的报道较少,本研究以GnRH受体阳性的人卵巢低分化浆液性乳头状癌细胞株OVCAR3为研究对象,使用Gn-RH激动剂曲普瑞林作用于OVCAR3细胞,观察其在体外水平对卵巢癌细胞生长的抑制作用及对GnRHⅠ受体和GnRHⅡ受体的影响,初步探讨曲普瑞林抗肿瘤作用的可能机制。
1 材料与方法
1.1 细胞株 人卵巢低分化浆液性乳头状癌细胞株OVCAR3由河北医科大学第四医院科研中心保存。
1.2 实验仪器 相差显微镜 (LH50A型,日本OLYMPUS公司),低温超速离心机 (UNIVERSAL-30RF型,德国Hettich公司),-80℃超速低温冰箱 (MDF-382型,日本SANYO公司),-152℃超低温冰柜 (MDF-1152 ATN型,日本SANYO公司),紫外分光光度计 (756型,上海光学仪器厂),PCR仪 (GeneAmp 9600型,美国PE珀金-埃尔默公司),高速低温离心机 (RS-28型,德国Hettich公司),UVP凝胶扫描系统 (GelDoc-It TS型,美国UVP公司),双恒定时电泳仪 (DYZ-22A型,北京市六一仪器厂),桥式电泳仪 (DYY-Ⅲ型,北京市六一仪器厂)。
1.3 主要试剂 RPMI-1640干粉 (美国GIBCO公司),胎牛血清 (美国 GIBCO公司),胰蛋白酶 (美国 Sigma公司)。MTT粉 (Sigma公司),DMSO试剂 (成都化学试剂厂),曲普瑞林 (辉凌制药生产,由河北医科大学第二医院生殖中心提供)RT-PCR使用的试剂:Trizol Reagent(为Invitrogen公司产品),氯仿,异丙醇,焦磷酸二乙酯DEPC(天根生化科技有限责任公司),反转录酶 (AMV-RT,美国Promega公司),核糖核酸酶抑制剂 (RNase Inhibitor,美国 Promega公司),dNTP mix(美国 Promega公司),PCR mix(美国 Promega公司),随机引物 (Random primers,美国Promega公司),琼脂糖 (agarose,美国Promega公司),Oligo dT 15(北京天根生化科技有限责任公司提供),DNA Marker-D(北京赛百盛基因技术有限责任公司)。
1.4 实验方法
1.4.1 细胞培养 复苏:从-152℃超速低温冰箱里取出所用肿瘤细胞的冻存管,放入37℃水浴箱中迅速解冻,1 000 r/min,离心5 min,弃去上清,加入新鲜培养基洗两遍,移至培养瓶中,放置培养箱中培养,次日换液。肿瘤细胞用含10%胎牛血清的1640培养基,在37℃、5%CO2、饱和湿度条件下常规培养,1~2 d换液1次。消化传代:贴壁细胞铺满90%以上时需要传代,加入消化液适量,倒置显微镜下观察,看见细胞收缩变圆,细胞间隙变大时弃去消化液,加入适量的培养基,吸管吹打成单细胞悬液,1 000 r/min,离心5 min;弃上清,加培养液,分至2~3个培养瓶,放置于37℃、5%CO2条件下,1~2 d换液1次。细胞计数:用95%乙醇洗净计数板,擦干,取干净盖玻片覆于计数板上,将细胞悬液于一侧滴加到盖玻片中,在显微镜下用10倍物镜观察计数四角大方格中的细胞数,计算计数盘周边四大格的细胞数,压线者仅计数左侧及上方。有2个以上细胞构成的细胞团按单个细胞计算,细胞团占10%以上时说明分散不充分,应重新制备细胞悬液后再进行计算。带入下式得出每毫升原液中的细胞数:细胞数/ml=(4大格细胞总数/4) ×104×稀释倍数,根据细胞总数决定如何稀释成所需要的细胞浓度。
1.4.2 MTT法测细胞抑制率
1.4.2.1 实验分组 卵巢浆液性囊腺癌细胞系OVCAR3表达2种GnRH受体[2],故采用OVCAR3细胞来检测促性腺激素释放激素类似物 (GnRH-a)对细胞生长的影响。将6种浓度的 GnRH-a,即 10-2mol/L,10-3mol/l,10-4mol/L,10-5mol/L,10-6mol/L及10-7mol/L的GnRH-a作用于细胞影响其生长,时间分别为24 h,设5个复孔,找出最适浓度;对细胞生长抑制率最高的浓度作用24 h、48 h、72 h,比较最适作用时间。
1.4.2.2 操作步骤 收集对数期的人卵巢癌细胞用胰蛋白酶消化,用含10%胎牛血清的1640调整细胞悬液浓度,每孔加入180 μl,约计细胞1×103个,96孔板周边各孔不加细胞仅用培养液填充。本实验共设置6个GnRH-a浓度处理组,浓度范围10-7mol/L~10-2mol/L。5%CO2、37℃孵育,至细胞单层铺满孔底 (96孔平底板),加入浓度梯度的药物,浓度分别为 10-1mol/L、10-2mol/L、10-3mol/L、10-4mol/L、10-5mol/L 和10-6mol/L,每孔20 μl,设5 个复孔。生存对照孔则加0.9%氯化钠溶液20 μl。5%CO2、37℃孵育24 h,倒置显微镜下观察。每孔加入20 μl MTT溶液 (5 mg/ml,即0.5%MTT),继续培养4 h。每孔加入150 μlDMSD,置脱色摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的吸光值 (OD)。每次样本测定均在30 min内完成,实验重复3次。根据以上做出的剂量-效应关系,选择一个最佳GnRH-a剂量进行时间-效应关系的观察,在用药后24 h、48 h、72 h进行MTT检测,具体方法同上。细胞抑制率=1-(OD实验组/OD对照组) ×100%。
1.5 GnRHⅠ受体和GnRHⅡ受体的测定
1.5.1 RT-PCR检测GnRHⅠ受体、GnRHⅡ受体的表达
1.5.1.1 主要试剂的配制 GnRH-a药物的配制:将药物用0.9%的氯化钠溶液溶解,配制成为10-3mol/L、10-4mol/L和10-5mol/L。
1.5.1.2 目的基因的合成 GAPDH上游引物:5'-ACCACAGTCCATGCCATCAC-3',下游引物:5'-TCCACCACCCTGTTGCTG-3'。GnRHⅠ受体上游引物:5'-GAAAAGCAACAGCAAAGTCGG-3',下游引物:5'-AGGGAGTCCAGCAGACAGTA-3'。GnRHⅡ受体上游引物:5'-GGACTTAGTTTCCTGCTTGCC-3',下游引物:5'-GATGGCTGGGTCAAATGGTATT-3',引物序列依据文献报道设计,由上海生物工程公司合成。
1.5.1.3 实验分组 将细胞分为对照组和实验组,第1组为对照组,不加药物;第2、3、4、5、6、7组为实验组,为加药物的细胞,浓度为 10-6mol/L、10-5mol/L和 10-4mol/L,分别培养24 h(2、3、4组)和48 h(5、6、7组);收集细胞检测GnRHⅠ受体、GnRHⅡ受体的表达,并进行比较。
1.5.2 RT-PCR的实验步骤
1.5.2.1 细胞培养 收集对数期的细胞,调整细胞悬液浓度,使用6孔板,每孔加入5×105个细胞,加新的培养基270 μl。在倒置显微镜下观察,待细胞完全贴壁后加药,每孔30 μl,浓度为10-4mol/L、10-5mol/L和10-6mol/L,有一对照孔不加药。置于5%CO2、37℃孵育24 h、48 h。每个样品重复5组。
1.5.2.2 提取RNA 收集细胞,倒去培养基,用PBS液冲洗3遍,每孔细胞加1 ml的Trizol,用枪头反复吹打使细胞完全裂解,加入200 μl氯仿,剧烈振荡混匀30 s,在台式离心机上,12 000 r/min,4℃离心20 min。将上清液小心转移到Rnase-free的1.5 ml离心管里,加入等体积的异丙醇,-20℃下放置过夜。台式离心机上12 000 r/min,4℃离心20 min,弃去上清液,用70%乙醇洗涤2次,每次900 μl,12 000 r/min,4℃离心5 min。干燥3~5 min,沉淀用20 μl DEPCH2O溶解。
1.5.2.3 提取RNA的完整性检测 将RNA提取液4 μl与上样缓冲液2 μl混合,1%琼脂糖凝胶 (含EB),电泳缓冲液1×TBE,120 V电泳5 min,凝胶成像系统观察。
1.5.2.4 提取RNA的定量 用756型紫外分光光度计测量OD260/OD280比值,可检测RNA的纯度和含量,选用OD260/OD280比值为1.8~2.0的RNA用作反转录。
1.5.2.5 cDNA第一链合成 第一步:加入RNA原液3 μl,Oligo dT 15 1 μl,Nucleasr-Free Water 6 μl,共10 μl反应液,70℃水浴10 min后,迅速置于冰上。第二步:加入5×R.T.buffer×5 μl,dNTP 1 μl(原液 10 M),RNasin 1 μl(原液20 U),M-MLV 1 μl(原液 5 U)Nucleasr-Free Water 7 μl,共15 μl反应液。42℃反应3 h后-20℃冻存备用。
1.5.2.6 PCR 配置PCR反应液完成后放入PCR仪,扩增条件94℃ 1 min,55℃45 s,72℃ 45s(5个循环),在进行94℃ 45 s,55℃ 45 s,72℃ 1 min(25个循环),72℃ 延伸10 min。
1.5.2.7 RT-PCR产物半定量 取RT-PCR产物8 μl,加上样缓冲液2 μl,在1%琼脂糖凝胶 (含EB)上电泳,120 V,10 min,用UVP凝胶图像成像系统拍摄并打印实验结果,用凝胶图像分析系统 (Gel-Pro Analyzer Version 3.0)分析结果。
1.6 统计学方法 应用SPSS 13.0统计软件进行统计学处理,计量资料采用 (±s)表示,所得结果行方差齐性检验、单因素方差分析,两两比较采用SNK-q检验,以α=0.05为检验水准,当P<0.05为差异有统计学意义。
2 结果
2.1 曲普瑞林对卵巢癌细胞OVCAR3生长的影响 MTT测定结果,10-7mol/L浓度的曲普瑞林作用细胞24 h后,其细胞抑制率为 (41.07±0.43)%,随着浓度梯度的不断增高,10-6mol/L、10-5mol/L、10-4mol/L、10-3mol/L、10-2mol/L 细胞抑制率分别为 (50.56±0.76)%、(69.86±1.05)%、(65.43±0.87)%、(62.09±1.24)%、(58.69±0.87)%;10-5mol/L浓度的曲普瑞林抑制率最高,差异有统计学意义 (P<0.05);以10-5mol/L浓度的曲普瑞林作用于细胞24 h、48 h、72 h后,细胞抑制率分别是 (69.86±1.08)%、 (58.69±0.98)%、(48.56±1.02)%,最终是作用时间在24 h时细胞的抑制率最高,差异有统计学意义 (P<0.05,见图1)。
2.2 GnRHⅠ受体和GnRHⅡ受体的表达 RT-PCR测定曲普瑞林作用于细胞后,GnRHⅠ受体的表达:10-6mol/L、10-5mol/L、10-4mol/L曲普瑞林作用于 OVCAR3 24 h时,10-5mol/L GnRHⅠ受体表达高。10-5mol/L曲普瑞林作用于OVCAR3 24 h时较48 h时GnRHⅠ受体表达增高 (见图2)。GnRHⅡ 受体的表达:10-6mol/L 、10-5mol/L、10-4mol/L曲普瑞林作用于 OVCAR3 24 h时,在10-5mol/L GnRHⅡ受体表达高,10-5mol/L曲普瑞林作用于OVCAR3 24 h时较48 h时GnRHⅡ受体表达量高 (见图3)。
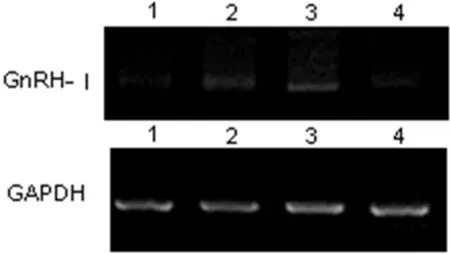
图1 不同浓度曲普瑞林作用24 h GnRHⅠ受体电泳图Figure1 Electropherogram of PCR product of GnRHⅠR and GAPDH;Compared with expressions of GnRHⅠR between different groups
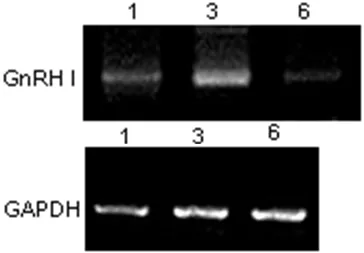
图2 10-5mol/L相同浓度曲普瑞林作用不同时间GnRHⅠ受体表达Figure2 Electropherogram of PCR product of GnRHⅠR and GAPDH;Compared with expressions of GnRHⅠR between different groups
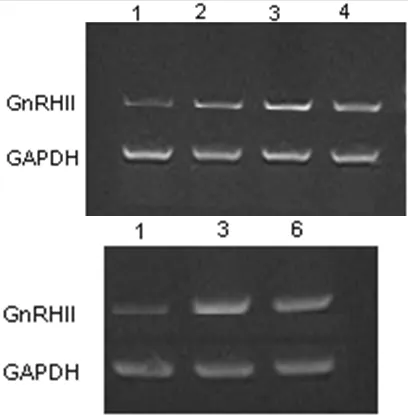
图3 10-5mol/L浓度曲普瑞林作用不同时间GnRHⅡ受体表达Figure3 Electropherogram of PCR product of GnRHⅡR and GAPDH;Compared with expressions of GnRHⅡR between different groups
3 讨论
GnRH存在多种亚型,主要调节性腺内受体形成和激素功能。已从脊椎动物和原索动物的神经组织中分离出24种不同的GnRH,它们组成了一个神经肽家族,研究显示只有GnRHⅠ (哺乳动物GnRH)与GnRHⅡ (鸡GnRH)基因出现在人类基因组。其相应受体GnRHⅠ受体和GnRHⅡ受体的基因也在人类基因组中被发现[3-4]。GnRH高表达于激素依赖性肿瘤,并对其生长发挥重要的调控作用。现有研究表明GnRH及其受体不仅对生殖系统良性肿瘤有调节作用,而且对生殖系统恶性肿瘤也有同样的作用。有证据表明GnRH-α对某些激素敏感的肿瘤具有直接抑制其癌细胞分裂增殖的作用[5]。GnRH-a能降低促性腺激素水平,因此,可以通过此种途径起间接抗肿瘤作用。
常用的GnRH激动剂是人工合成的九肽类似物。如国产的LRH-A3和国外的Buserelin、Triptorelin等。Triptorelin即曲普瑞林。有资料表明曲普瑞林对多种肿瘤有一定的治疗作用。Borroni等[6]所研究的GnRH拮抗剂醋酸亮丙瑞林抑制体外异位内膜细胞的增殖,发现药物在10-9~10-5mol/L浓度时,有明显的抗细胞增殖作用,而且在10-5mol/L浓度时,出现最大的抑制效应。我们推测同样作为性激素依赖性疾病的卵巢肿瘤应用GnRH类似物治疗会有一定意义。
国外研究表明,在卵巢癌及卵巢癌细胞株中有两种形式GnRH及GnRHmRNA的存在[7-8]。因而认为卵巢癌局部有Gn-RH自分泌系统的存在。GnRH-α对肿瘤的直接作用也可能存在于卵巢癌。近年来研究GnRH-α用于性激素依赖性疾病的治疗表明,GnRH-α对表达GnRH受体的人前列腺癌细胞系生长有明显抑制作用[9]。Emons等[10]进行了Ⅱ期临床试验探讨应用GnRH激动剂AESZ-108靶向治疗LHRH受体阳性的肿瘤的耐受剂量。Chianese等[11]研究显示AEA一种GnRH拮抗剂也对林蛙GnRHⅠ、GnRHⅡ表达产生影响。
本实验将不同浓度的曲普瑞林 (10-2~10-7mol/L)作用于卵巢癌细胞培养24 h,在低浓度10-7mol/L时即对细胞有抑制作用,且随浓度的增高,在曲普瑞林为10-5mol/L时,抑制率最高,成时间-剂量依赖效应。这与Borroni等[6]的实验结果相一致,推测在运用曲普瑞林治疗卵巢癌的作用机制中,至少有部分是以旁分泌或自分泌形式作用于靶组织。研究结果显示,GnRH激动剂对人OVCAR3细胞有显著的抑制作用。
GnRHⅠ受体的表达:RT-PCR测定不同浓度triptorelin作用于OVCAR3 48 h时,在10-5mol/L GnRHⅠ受体表达高。当曲普瑞林浓度为10-5mol/L,作用24 h时细胞GnRHⅡ受体表达最高。GnRHⅡ受体的表达结果与GnRHⅠ受体相似。显示GnRHⅠ受体和GnRHⅡ受体的表达变化与抑制肿瘤细胞生长作用有关。但目前有关GnRH及其类似物抑制卵巢癌细胞增殖的机制尚不十分明确,国内外研究仍无定论,还需要进一步研究。
从本研究结果可以进一步推测,在体外实验中,GnRH激动剂曲普瑞林抑制GnRH受体阳性的人卵巢癌OVCAR3细胞增殖的作用机制,是通过首先激活GnRHⅠ受体和GnRHⅡ受体的表达完成的,以上结果仍有待于体内实验进一步证实。可以设想应用GnRH-α及其他细胞毒性药物制成联合制剂,通过GnRH受体的介导在抑制肿瘤细胞增殖的同时杀死癌细胞,所以GnRH-α有可能成为治疗人类卵巢癌的一种切实可行的新型抗肿瘤的生物制剂。这些研究将有助于为抗肿瘤新药的研发提供依据。
1 李敏,吴小华,徐翠清,等.GnRHⅠ,GnRHⅡ及其受体在人卵巢恶性上皮性肿瘤细胞中的表达及意义[J].第四军医大学学报,2008,29(24):2281-2283.
2 Grundlker C,Gunthert AR,Millar RP,et al.Expression of gonadotropin releasing hormoneⅡ (GnRHⅡ)receptor in human endometrial and ovarian cancer cells and effects of GnRH II on tumor cell proliferation[J].J Clin Endacrinol Metab,2002,87(3):1427-1430.
3 Tanriverdi F,Gonzalez-Martinez D,Sileriza LF,et al.Expression of gonadotropin-releasing hormone type-I(GnRH-I)and type-II(GnRH-II)in human peripheral blood mononuclear cells(PMBCs)and regulation of B-lymphoblastoid cell proliferation by GnRH-I and GnRH-II[J].Exp Clin Endocrinol Diabetes,2004,112(10):587-594.
4 Neill JD.GnRH and GnRH receptor genes in the human genome[J].Endocrinology,2002,143(3):737.
5 Imai A,Horibe S,Takagi H,et al.Singal transduction of GnRH receptor in the reproductive tract tumor[J].Endocrinlogy,1996,43:249-260.
6 Borroni R,Di Blasio AM,Gaffuri B,et al.Expression of GnRH receptor gene in human ectopic endomet rial cells and inhibition of their proliferation by leuprolide acetate[J].Mol Cell Endocrinol,2000,159(1-2):37-43.
7 Chien CH,Lee CY,Chang TC,et al.Detection of gonadotropin-releasing hormone receptor and its mRNA in primary human epithelial ovarian cancers[J].Int J Gynecol Cancer,2004,14:451-458.
8 Choi JH,Choi KC,Auersperg N,et al.Differential regulation of two forms of gonadotropin-releasing hormone messenger ribonucleic acid by gonadotropins in human immortalized ovarian surface epithelium and ovarian cancer cells[J].Endocr Relat Cancer,2006,13(2):641-651.
9 Castellón E,Clementi M,Hitschfeld C.Effect of leuprolide and cetrorelix on cell growth,apoptosis,and GnRH receptor expression in primary cell cultures from human prostate carcinoma[J].Cancer Invest,2006,24(3):261-268.
10 Emons G,Kaufmann M,Gorchev G.Dose escalation and pharmacokinetic study of AEZS-108(AN-152),an LHRH agonist linked to doxorubicin,in women with LHRH receptor-positive tumors[J].Gynecol Oncol,2010,119(3):457-461.
11 Chianese R,Ciaramella V,Fasano S.Anandamide modulates the expression of GnRH-II and GnRHRs in frog,Rana esculenta,diencephalon[J].Gen Comp Endocrinol,2011,23:epub ahead of print.
