山东省基本药物增补品种248例不良反应事件分析
2011-09-05李诗梅刘向国王艳敏王鲁豫
李诗梅,刘向国,王艳敏,王鲁豫
(德州市药品不良反应监测中心,山东 德州 253015)
本文采用回顾性研究方法,对2011年1月~3月德州市药品不良反应监测中心收到的248例山东省增补品种的不良反应病例报告进行统计和分析,了解全市增补品种不良反应的发生和分布情况,为临床合理用药提供科学依据,发挥药品不良反应监测工作的指导作用[1]。
1 药品不良反应监测数据统计
对德州市2011年第一季度上报国家ADR中心的248份山东省基本药物增补品种病例报告进行整理,不良反应术语参照WHO药品不良反应术语集进行规范,药品分类依据国家药品不良反应监测中心信息网的分类标准,药品名称按照其活性成分名称进行整理。应用国家药品不良反应监测中心信息网并结合EXCEL软件进行分析和统计。
1.1 报告类型
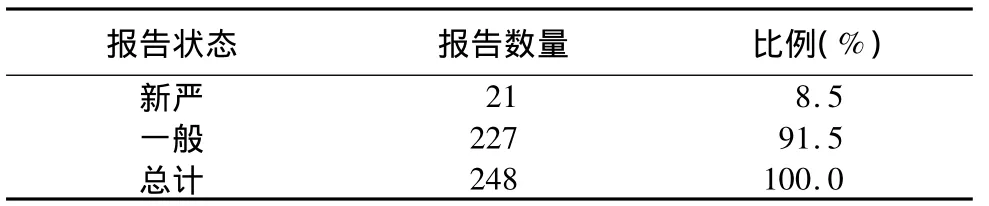
报告状态 报告数量 比例(%)21 8.5一般 227 91.5总计新严248 100.0
1.2 人群分布
1.2.1 性别分布

?
1.2.2 年龄分布

?
1.3 药品剂型和用药途径分布
1.3.1 药品剂型

?
1.3.2 用药途径

用法 汇总 比例(%)
1.4 报告数量前16位的药品
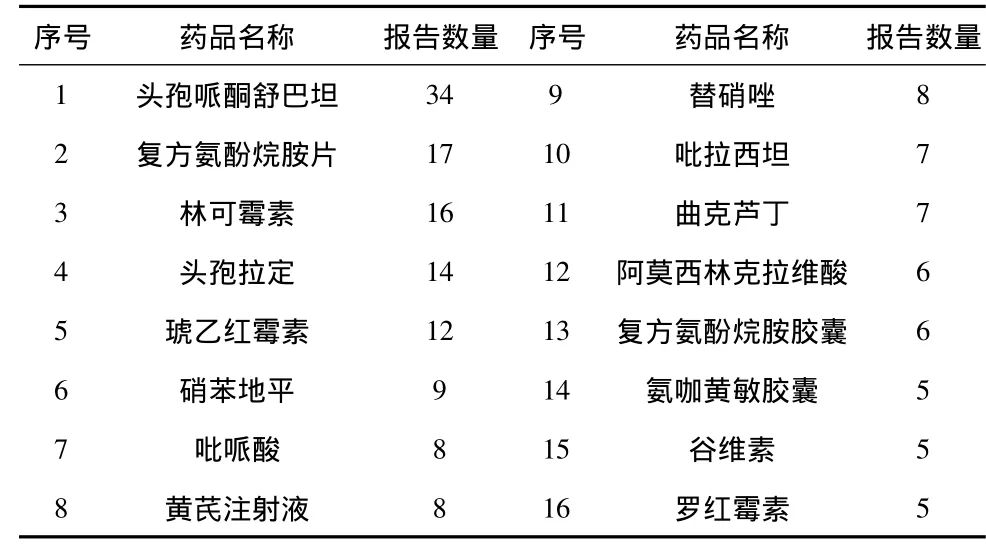
?
1.5 报告严重不良反应的药品
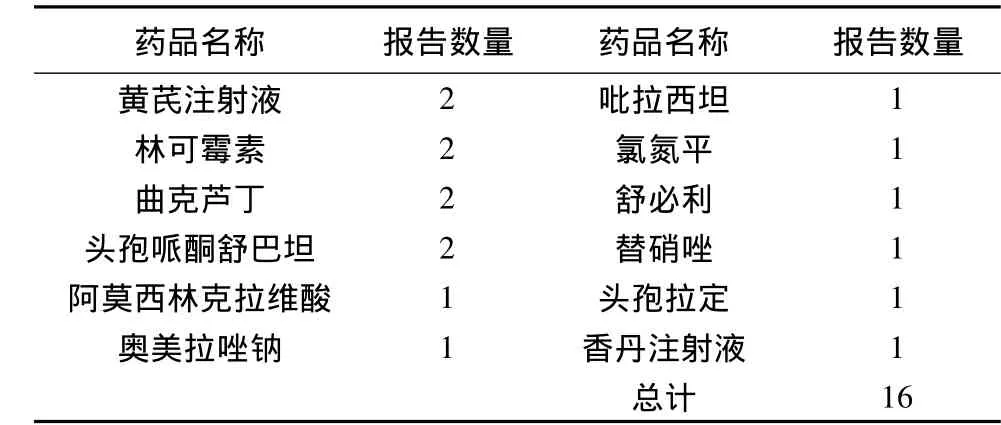
?
1.6 严重不良反应表现

?
1.7 ADR 结果分类
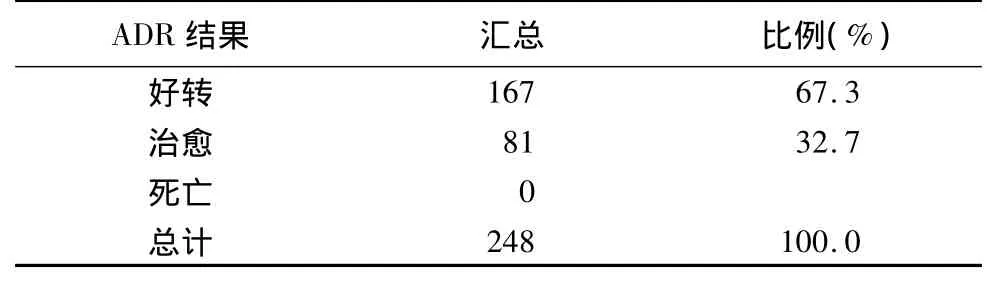
?
1.8 报告单位分布情况
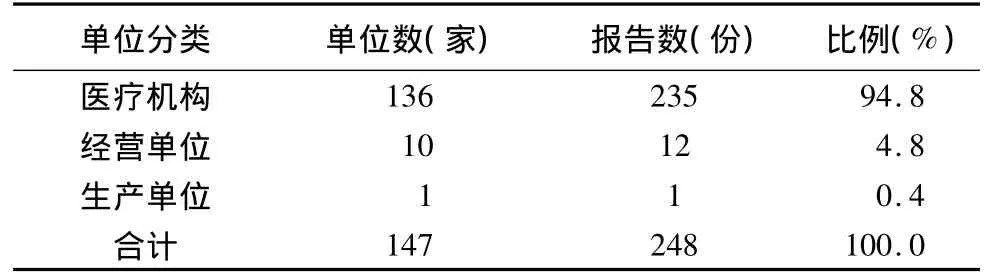
?
1.9 报告人员职业分类
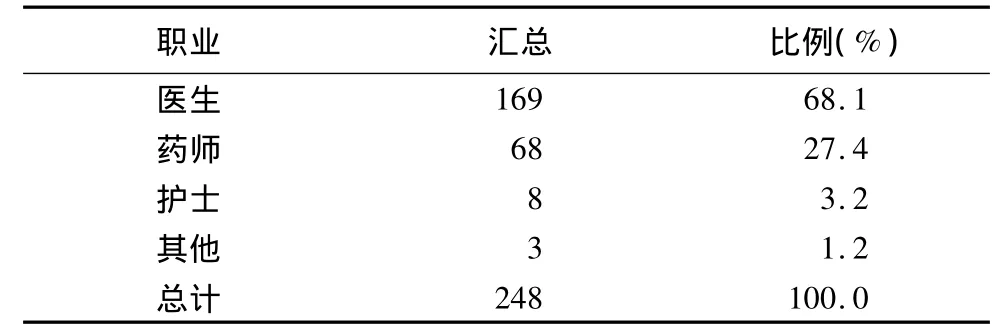
?
2 讨论
2.1 报告类型 山东省增补品种248份,新严21份,占8.5%,新严比例偏低。
2.2 人群分布 性别分布,男57.3%,女42.7%;男女比例为 1.34∶1,高于我市人口男女分布比例(1.02∶1)。年龄分布,0~14岁占6.0%,低于正常人群分布。15~64岁占83.1%,高于正常人群分布。65岁以上占10.9%,高于正常人群分布。(我市0~14岁占全市总人口16.65%,15~64岁占74.47%,65岁以上占8.88%)成年人(15~64岁)ADR 报告比例明显增多(占83.1%),是ADR高发人群,应给予重点关注。
2.3 药品剂型和用药途径分布 注射剂占44.0%,片剂41.9%,胶囊剂10.1%,颗粒剂 2.8%,软膏剂 0.8%。口服55.2%,静脉滴注占41.9%,其他占2.9%。注射剂ADR报告数量最大,风险最高;其中静脉滴注占总报告的40%以上。对注射剂,尤其是静脉滴注用的品种,要重点监测,做好风险防范。口服制剂ADR发生率较高,尤其是片剂占30%以上。对增补品种中的氯氮平、替硝唑、舒必利等重点品种,要加强监测。
2.4 报告数量前5位的药品 头孢哌酮舒巴坦、复方氨酚烷胺片、林可霉素、头孢拉定、琥乙红霉素等,ADR报告数量均超过10份。本次统计,山东省基本药物目录增补品种监测覆盖率27.3%。应逐步扩大增补品种的监测覆盖面。对报告数量较多的品种,及时进行风险预警,重点监测。
2.5 报告严重不良反应的药品 报告严重不良反应的增补品种有,黄芪注射液、林可霉素、曲克芦丁、头孢哌酮舒巴坦、阿莫西林克拉维酸、奥美拉唑钠、吡拉西坦、氯氮平、舒必利、替硝唑、头孢拉定、香丹注射液。
出现严重不良反应的增补品种,发布风险预警,在今后工作中进行重点监测。对于过敏性休克、呼吸困难、紫绀、抽搐、高热等严重不良反应的症状,建议医疗机构制定切实可行的应急预案,以便在最短的时间内,采取有效的治疗抢救措施,保障患者的生命和健康安全。
2.6 ADR结果 好转占67.3%,治愈32.7%,无死亡。
2.7 报告单位分布情况 医疗机构占94.8%,经营单位占4.8%,生产单位0.4%。在ADR报告单位中,医疗机构占主导地位,经营单位和生产单位ADR报告数量太少。监测单位对ADR报告的认识和对工作措施的落实不均衡。应进一步加强对医疗机构,特别是对二级以上医疗机构的培训和指导,争取报告率达到60%以上。通过培训和督导,进一步加强经营单位和生产单位对ADR重要性的认识,指导其采取有效地工作措施,积极开展ADR监测。
2.8 报告人员职业 医生占68.1%,药师占27.4%,护士占 3.2%,其他占 1.2%。
2.9 应进一步关注的风险品种 林可霉素、头孢哌酮舒巴坦、阿莫西林、克拉维酸、替硝唑、头孢拉定、黄芪注射液、香丹注射液。
3 对策与建议
3.1 加强基本药物监测 不断提高基本药物监测覆盖面,全面反映基本药物临床应用的基本情况,重点对严重ADR报告品种和ADR报告较多的品种加强监测。
3.2 数量和质量并重 制订我市评优标准和督导标准,加强市、县二级审核,按照评估标准把好质量关;通过考核报告月均衡度,加强日常监测工作,防止不重视质量,突击上报。
3.3 加强宣传培训 使监测人员掌握药品不良反应技术规范及评价标准,严格按照质量技术要求规范报告内容,保证报告的真实性、规范性、完整性;新严比例争取达到30%以上。扩大社会对ADR的认识和支持力度。
3.4 优化报告单位结构 采取有效措施,提高监测单位的报告覆盖面和报告数量的均衡性,在药品生产企业、药品经营企业、二级以及二级以上医疗卫生机构消灭零报告,转变目前报告单位结构不合理状况,一级和一级以上医疗机构网络覆盖率100%,二级以及二级以上医疗机构报告比例超过60%。
3.5 加强应急处理 及时上报、及时控制、科学判断、维护稳定。建议并督促医疗机构制定切实可行的应急预案,以便在最短的时间内,采取有效的治疗抢救措施,保障患者的生命和健康安全。
3.6 加强分析评价 每季度对基本药物监测报告进行分析评价,找出重点品种,及时发现,及时预警,防范风险,促进临床合理用药,指导药品日常监督抽样,保证基本药物监测质量,保障人民用药安全。
[1]静芸芸,李彦博.454例基本药物致不良反应病例报告数据分析[J].中国药物警戒,2010,7(9):564.
