二氧化碳在咪唑金属-有机骨架化合物中吸附行为的分子模拟研究
2011-08-27黄元杰嵇春红金晓燕
黄元杰,嵇春红,金晓燕
(浙江省桐乡市环境保护监测站,浙江 桐乡 314500)
1 引言
近年来沸石咪唑金属-有机骨架化合物(Zeolitic Imidazolate Frameworks,ZIF)作为一种新型功能性材料受到广泛关注,并且被认为是有望替代分子筛用于气体储存、吸附分离、催化等领域新型微孔材料[1,2]。Yaghi等人合成了多种 ZIFs,并对其吸收CO2性能进行分析,研究表明:ZIFs是一种有效的吸收 CO2的材料[3],Rees B.Rankin等人[4]分别采用实验和分子模拟方法研究了CO2在ZIF-68和ZIF-70中的吸附等温线,研究表明不同的力场获得的结果有所差异,Dreiding力场在不考虑电荷相互作用的情况下与实验具有较好的一致性。仲崇立等人[5]运用巨正则蒙特卡罗方法计算了不同压力下CO2在ZIF-68和ZIF-69中的密度分布概率,结果表明:低压下CO2主要吸附于由nIM(ZIF-68的硝基咪唑)或cbIM(ZIF-69的5-氯苯并咪唑)连接的六边形的小孔中。随着压力的增加,越来越多的CO2分子开始分布在bIM有机配体形成的大孔氯原子周围。通过文献查阅发现目前气体分子在ZIF中的吸附与分离行为研究较少,而CO2在ZIF中的吸附行为主要集中在某一种ZIF结构中,缺少对不同结构种类ZIF的系统、整体研究,对于ZIF拓扑结构对吸附行为的影响基本不了解。因此探讨CO2在具有相同组成不同拓扑结构ZIFs中的吸附行为及吸附机制具有重要意义。
2 模型和模拟细节
2.1 ZIF结构的构建
从剑桥晶体数据库(CCDC)下载ZIF的晶体学数据,将晶体结构进行优化,为消除晶胞单元较小所引起的尺寸效应,分别在x-,y-,z-方向该对该晶胞进行复制,获得2×2×2的ZIF结构。
2.2 力场模型与模拟细节
模拟过程中,CO2分子及ZIF骨架原子相互作用采用全原子(All- Atom AA)法,它们之间的相互作用势采用Lennard-Jones势,CO2的参数取自Potoff[6]的工作,ZIF 骨架原 子参数采 用 Dreiding力场[7]的数据。不同基团之间的相互作用参数由Jorgensen混合规则[8]计算得到,模拟温度设定为298K,截断半径设定为1.38nm,模拟过程中每个状态点都进行5×104次MC循环,其中前2.5×104次用来使系统达到平衡,后2.5×104次循环用于统计平均。
3 结果与分析
3.1 吸附等温线
采用巨正则蒙特卡罗模拟分别计算了CO2在高压及低压范围内其在ZIF-2、-3、-4、-10、-64中的吸附等温线,结果如图1和图2所示。研究结果表明:吸附量随压力的增大而增加,随压力的进一步增加,吸附量逐渐趋于饱和,达到吸附平衡。ZIF-10具有较大吸附量,CO2在其中的饱和吸附量远大于ZIF-2、-3、-4、-64。低压下压力与吸附量成线性关系,孔径较小的ZIF-4及ZIF-64吸附量随压力的变化增加最为显著,而孔径最大的ZIF-10随着压力的增加,吸附量略有上升。这可能是由于孔径较小的ZIF,有机配体与金属原子或有机配体之间相互距离较近,从而导致吸附分子与骨架结构之间相互作用较强,即吸附热较大,该原因使得低压下孔径较小的ZIF结构其吸附量反而越大。
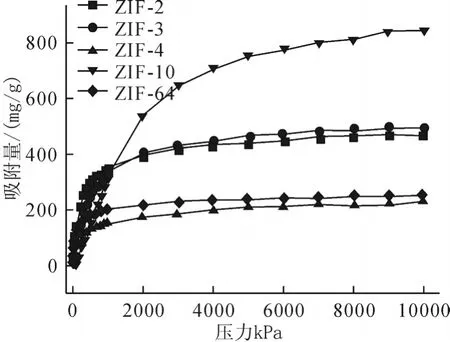
图1 298K时CO2中的吸附等温线
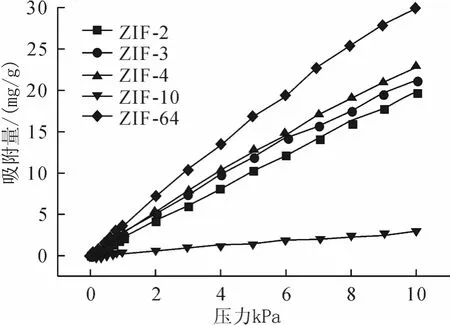
图2 低压下298K时CO2吸附等温线
3.2 孔径对吸附量的影响
为探讨不同压力下孔径对吸附量的影响,分别取低压(10kPa)、中压(500kPa)及高压(3000kPa)时CO2在ZIF-2、-3、-4、-10、-64吸附量,列于表1。将不同压力下CO2的吸附量对ZIF-2、-3、-4、-10、-64的孔径作图。从图3、图4可以看出,低压下孔径与吸附量之间无明显的变化规律,但不难发现低压时孔径越大,吸附量越低,这可能是由于孔径较大,吸附分子与骨架结构之间的相互作用距离较远,从而造成吸附分子与吸附材料之间的相互作用较弱,即吸附热较低。
Snurr[10]等人的研究表明低压下氢气在 MOF中的吸附量主要取决于吸附气体在纳米微孔材料中的吸附热。当压力增加到500kPa时,吸附量与与孔径无明显关系。当压力进一步增加到3000kPa时,如图5所示,随孔径的增加吸附量增大,两者之间存在较好的线性关系,即高压下气体分子在ZIFs中的吸附量主要由其孔径大小是所决定,这与Snurr等人的结论能够很好的吻合[10]。
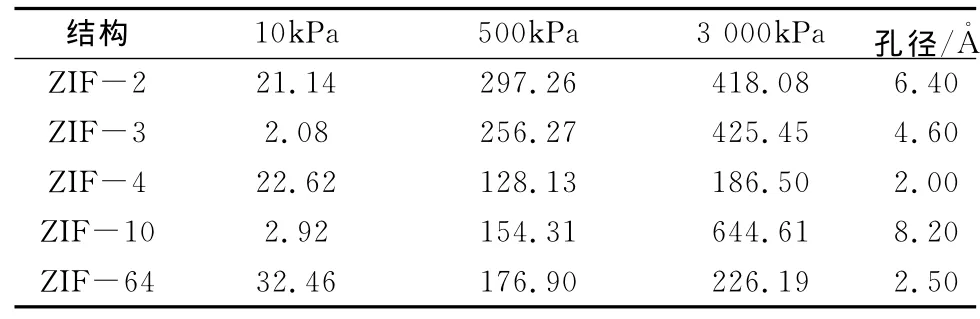
表1 不同压力下CO2的吸附量及ZIF的孔径
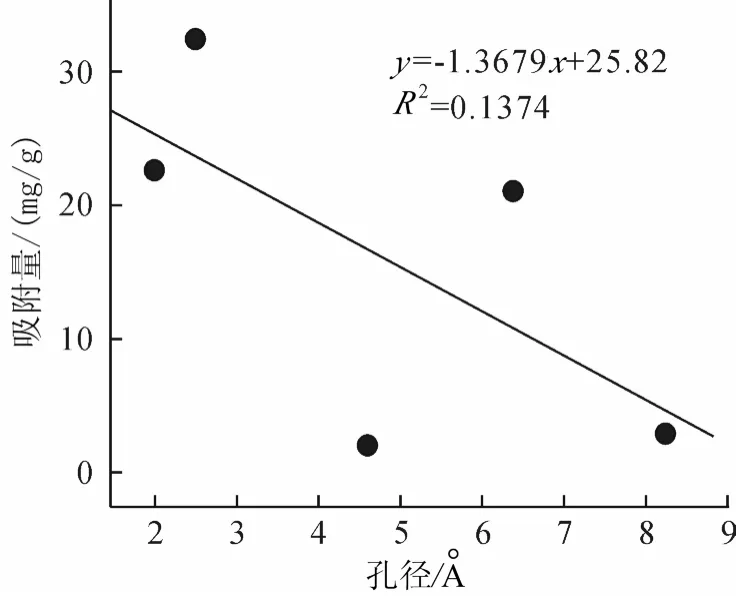
图3 298K时不同压力下孔径对吸附量的影响

图4 298K时500kPa压力下不同ZIF孔径对吸附量的影响

图5 298K时3000kPa压力下不同ZIF孔径对吸附量的影响
3.4 温度对吸附量的影响
为探讨温度对CO2在ZIF中吸附行为的影响,采用同样的方法分别计算了当压力为3000kPa时,不同温度(230K、260K,290K,320K 及350K)下CO2在ZIF-2、-3、-3、-10、-64中的吸附量,结果如图6所示。从图中可以看出吸附量与温度成反比,温度越高吸附的CO2分子数目越少,温度越低吸附的CO2分子数目越多,这可能是由于温度越高分子的运动能力越强,从而使得吸附量有所下降。我们将模拟获得的吸附量对温度的倒数作图,并进行拟合,获得温度升高时CO2吸附于不同ZIF材料所需要克服的能垒,结果如图7和表2所示。由图6、图7可以看出随温度的变化ZIF-10的斜率最大,即ZIF-10中吸附量受温度影响吸附量的变化也最大,通过计算可知随着温度的上升,ZIF-10所需克服的能垒最大,ZIF-64所需克服的能垒最小;即ZIF-64受温度的影响吸附量的变化也最小,这与图6中的结果能够较好的吻合。
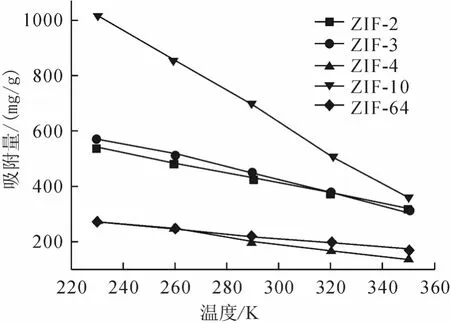
图6 不同温度下3000kPa时CO2在ZIF-2、-3、-4、-10、-64中的吸附等压线

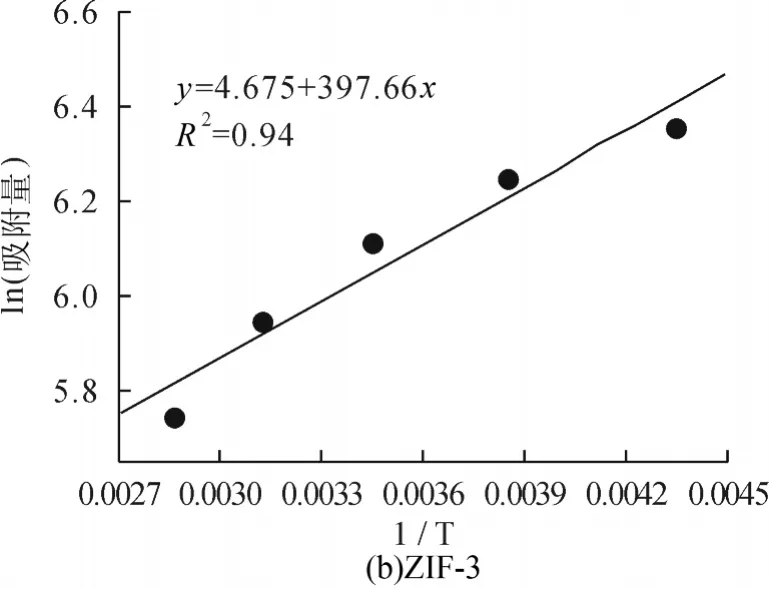
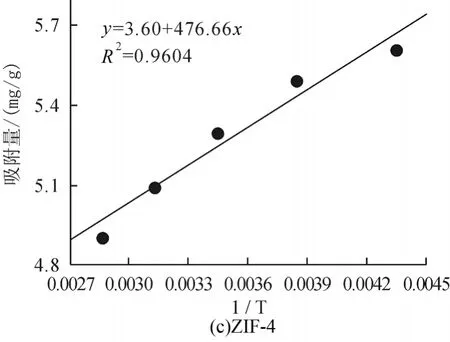

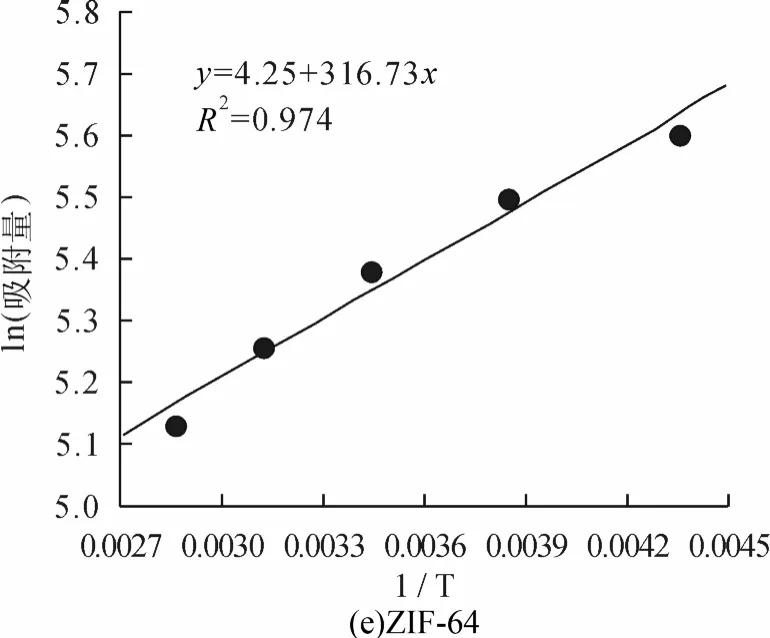
图11 3000kPa时CO2不同温度的吸附量与温度倒数的关系

表2 CO2吸附于不同ZIF结构所需要克服的能垒
4 结语
(1)CO2在ZIF-2、-3、-4、-10、-64中的吸附等温线具有相似的变化趋势,CO2吸附量在低压下(从0.01kPa到10kPa)随着压力的增加几乎呈线性急剧增长,当压力达到一定值时随着压力的增大吸附量基本保持不变,达到饱和吸附平衡。CO2在ZIF-10中的吸附量大于其在ZIF-2、-3、-4、-64中吸附量,其饱和吸附压力也大于其它ZIFs。
(2)低压时的CO2在ZIF中的吸附量与孔径无明显关系,高压下CO2的吸附量由孔径大小所决定。
(3)温度越高吸附量越小,而且吸附量与温度成线性反比的关系,ZIF-10吸附行为受温度变化影响最大,随着温度的上升,CO2在ZIF-10中所需要克服的能垒最大。
[1]Banerjee R,Phan A,Yaghi1OM,et al.High-throughput synthesis of zeolitic imidazolate frameworks and application to CO2capture[J].Science,2008(319):939~943.
[2]Park K S,Zheng N,Yaghi O M,et al.Exceptional chemical and thermal stability of zeolitic imidazolate frameworks[J].Proceedings of the National Academy of Sciences,2006(103):10186~10191.
[3]Park K S,Zheng N,Yaghi O M,et al.Synthesis and structure of chemically stable metal?organic polyhedra[J].Science,2006(103):10186~10191.
[4]Rees B,Rankin,Jinchen Liu,et al.The importance of chargequadrupole interactions for H2adsorption and diffusion in CuBTC[J].Journal of physical chemistry C,2009(113):16906~16914.
[5]Liu D H,Zheng C C,Zhong C L,et al.Computational study on the influences of framework charges on CO2uptake in metal?organic frameworks[J].Journal of physical chemistry C,2009,113(12):5004~5009.
[6]Potoff J J,Siepmann J I.Vapor-liquid equilibria of mixtures containing alkanes,carbon dioxide and nitrogen[J].Aiche Journal,2001(47):1676~1682.
[7]Stephen L,Mayo B.D.Dreiding:A generic force field for molecular simulations[J].Journal of Physical Chemistry,1990(94):8897~8909.
[8]Jorgensen W L,Madura J D,Swenson C J.Optimized intermolecular potential functions for liquid hydrocarbons[J].Journal of the American Chemical Society,1984,106(22):6638~6646.
[9]Zhou M,Wang Q,Zhang L,et al.Adsorption sites of hydrogen in zeolitic imidazolate frameworks[J].Journal of Physical Chemistry,2009(113):11049~11053.
[10]Frost H,Düren T,Randall Q,et al.Effects of surface area,free volume,and heat of adsorption on hydrogen uptake in metal?organic frameworks[J].Journal of Physical Chemistry B,2006,110(19):9565~9570.
