日本血吸虫虫卵在BALB/c鼠肝脏各叶中的分布调查
2011-08-21朱传刚李小红徐玉梅
朱传刚,杨 艺,李小红,刘 毅,徐玉梅
(中国农业科学院上海兽医研究所,上海 200241)
血吸虫成虫寄生于人或其他哺乳类动物的肠系膜下静脉,合抱的雌雄虫交配产卵于小静脉的小分支。部分虫卵附着于肠壁,随着粪便排出体外;而大部分虫卵随肝门静脉血流入肝,抵达于门静脉小分枝,在门管区等处形成虫卵结节,故在肝表面和切面可见粟粒或绿豆大结节。肝脏中血吸虫虫卵的负荷,不仅是血吸虫病病理危害程度的一个重要指标,也是现阶段评估疫苗或药物治疗血吸虫病效果的重要指标之一。血吸虫病研究的相关动物实验均以每克肝脏虫卵数(肝脏EPG)作为重要评价指标。虫卵随血流入肝后,由于肝脏各叶结构不同、位置不同、血液的流体力学不同等因素,可能造成虫卵在肝脏各分叶中的不同分布,所以,肝脏虫卵计数时会因取样位置不同而产生人为差异。为此,利用人工感染血吸虫的方式,观察并测定虫卵在常用的实验动物BALB/c小鼠肝脏各叶中的分布状况,可以有助于明确虫卵在肝脏中的分布。
1 材料与方法
1.1 实验动物BALB/c雄性小鼠,6周龄,体重20~22 g,购自上海复旦大学医学院实验动物中心;阳性钉螺由江苏省寄生虫病研究所购进,实验室人工培养。
1.2 方法
1.2.1 攻击感染 用日本血吸虫中国大陆株正常活尾蚴经小鼠腹部皮肤感染(贴片法),每只小鼠感染约10~40条尾蚴不等。
1.2.2 小鼠肝脏的分叶与计数单位 于攻击感染后6周,小鼠眼眶放血行颈部脱臼致死。取腹正中切口进腹,向两侧牵开腹壁,将胃、脾等提出腹外,充分暴露肝脏,对肝脏行解剖学观察,记录肝的分叶及形态。然后,取下肝脏,称重;切断各叶肝蒂,分别称取各叶肝重,计算肝脏各叶重量百分比。
1.2.3成虫和虫卵计数 实验小鼠取下肝脏后,门静脉灌洗冲虫,同时观察肝脏血管内是否有残余血吸虫,合并后计数配对成虫和未发育童虫。通过分叶顺次肝切除建立小鼠肝脏的虫卵计数取样单位,各计数单位分别称重后,将取样的肝组织加生理盐水定容至10 mL,然用组织粉碎机粉碎,加10 mL 5%KOH溶液65℃消化1 h,再用水稀释1倍后,取100 μL进行镜检。每份样品计数3次,取3次计数的平均值,计算各叶肝脏虫卵EPG及全肝EPG。
1.2.4 统计分析 将计算出的各个小鼠肝脏EPG分别输入EXCEL中,用配对t检验法检测,分析各肝脏虫卵计数单位的EPG之间以及同全肝的EPG的关系。
2 结果
2.1 BALB/c小鼠小鼠肝脏的解剖和分叶特征小鼠肝脏位于横膈下,呈分叶状。游离肝脏周围韧带,完整切除肝脏,可见各叶之间界限明确,有部分相互重叠遮盖。根据人类肝脏解剖分叶的特点和命名习惯,小鼠肝脏分为左外叶、左中叶、右中叶、右上叶、右下叶和尾状叶[1](图1),其中尾状叶又分为尾状突、前尾状叶和后尾状叶。各叶之间的叶间裂十分明确。左外叶最大,呈扁平梭状,遮盖着尾状叶,左中叶外侧遮盖了左外叶内1/4,右中叶遮盖了右上叶的左1/2,右上叶位于右下叶正上方[1]。测得感染血吸虫42 d的BALB/c小鼠肝脏的重量为(2.23±0.26)g。
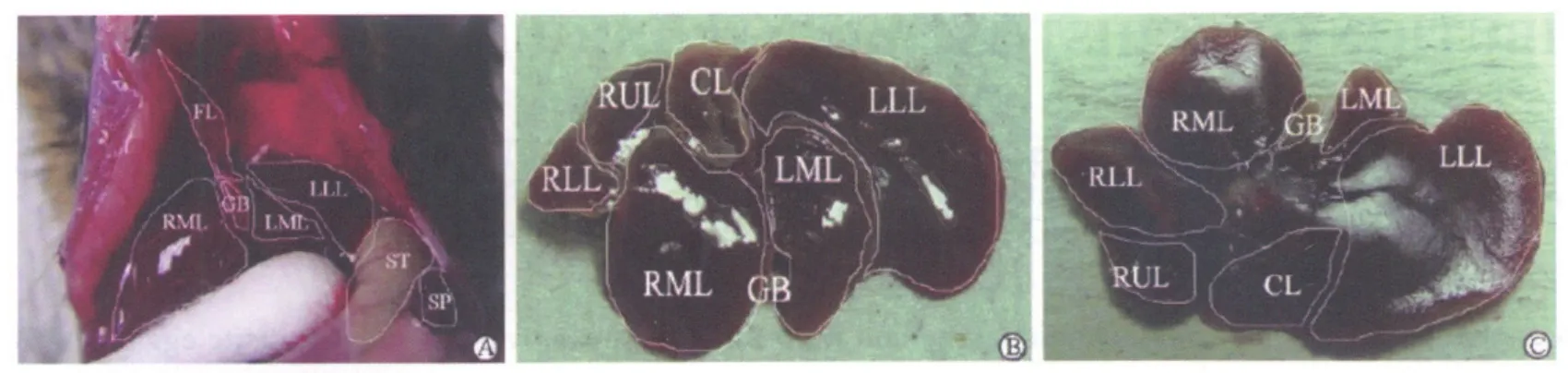
图1 小鼠肝脏的在体解剖和离体解剖分叶观察[1]Fig.1 Observation of mouse liver anatomy in vivo and in vitro[1]
2.2 肝脏虫卵计数取样单位的确定根据肝外形的沟裂可以看出,各分叶的外形、大小不一,有的较小。为保持每个虫卵计数单位大于0.5 g,分别将肝左外叶、左中叶和右中叶、右上叶和右下叶以及尾状叶合并在一起成为三个虫卵计数取样单位:中央叶(包含左中叶和右中叶)、右叶(包含右上叶和右下叶以及尾状叶),左叶(左外叶),如图2所示。根据上述自然肝裂以及人为分类方法,将肝脏的三个虫卵计数取样单位顺次进行解剖,分别称量,并计算各虫卵计数单位肝叶占肝质量的百分比。结果分别为左叶:(0.86±0.12) g,中央叶:(0.61±0.08)g,右叶:(0.76±0.10)g。左叶较大,中央叶较小。左叶、中央叶、右叶三个虫卵计数单位占肝全重的比例分别是:39%、27%、34%。

图2 肝脏的三个虫卵计数单位Fig.2 Three egg count units of livers
2.3 BALB/c种系小鼠血吸虫虫卵分布小鼠体内血吸虫负荷从2对到14对不等,肝脏EPG从13×103~91×103不等,虫卵在小鼠肝脏的分布是不均匀的,见表1。在左叶、中央叶、右叶3个取样样本中的EPG分别为49.80×103±26.70×103,59.03×103±29.04×103,36.55×103±17.77 ×103。中央叶EPG最多,右叶最少,经t检验发现中央叶、右叶、左叶小鼠肝脏EPG的差异有显著统计学意义(P<0.05)。在本试验的不同的血吸虫负荷下,肝脏各叶EPG也基本符合上述规律,以右叶肝脏EPG为基准,左叶、中央叶EPG最高分别是右叶EPG的1.73、2.24倍,平均为1.36倍,1.62倍。
按肝脏虫卵负荷多少,即按EPG数量研究各肝叶中虫卵的分布,各肝叶与全肝EPG的数量关系符合线性关系。
全肝EPG与中央叶EPG:y=1.1x-3,相关系数:0.9566,(y:全肝EPG,x:中央叶EPG)
全肝EPG与左叶EPG:y=1.2x+1.83,相关系数:0.9495,(y:全肝EPG,x:左叶EPG)
全肝EPG与右叶EPG:y=0.72x+2.1,相关系数:0.9195。(y:全肝EPG,x:右叶EPG)
BALB/c小鼠全肝EPG与各虫卵计数单位的EPG进行多重分析,也符合线性关系:y=0.31217 5x1+0.290515x2+0.386702x3-0.04607,相关系数为0.999。(y:全肝EPG,x1:左叶EPG,x2::中央叶EPG,x3:右叶EPG)。
2.4 配对成虫和肝脏EPG关系将每只小鼠肝脏EPG与灌洗冲虫所获虫数一一对应,如表1所示。配对成虫平均为(9±3.64)对,每对配对成虫对肝脏EGP的贡献从3.67×103~6.5×103不等,平均贡献是 5.28×103±0.98×103。
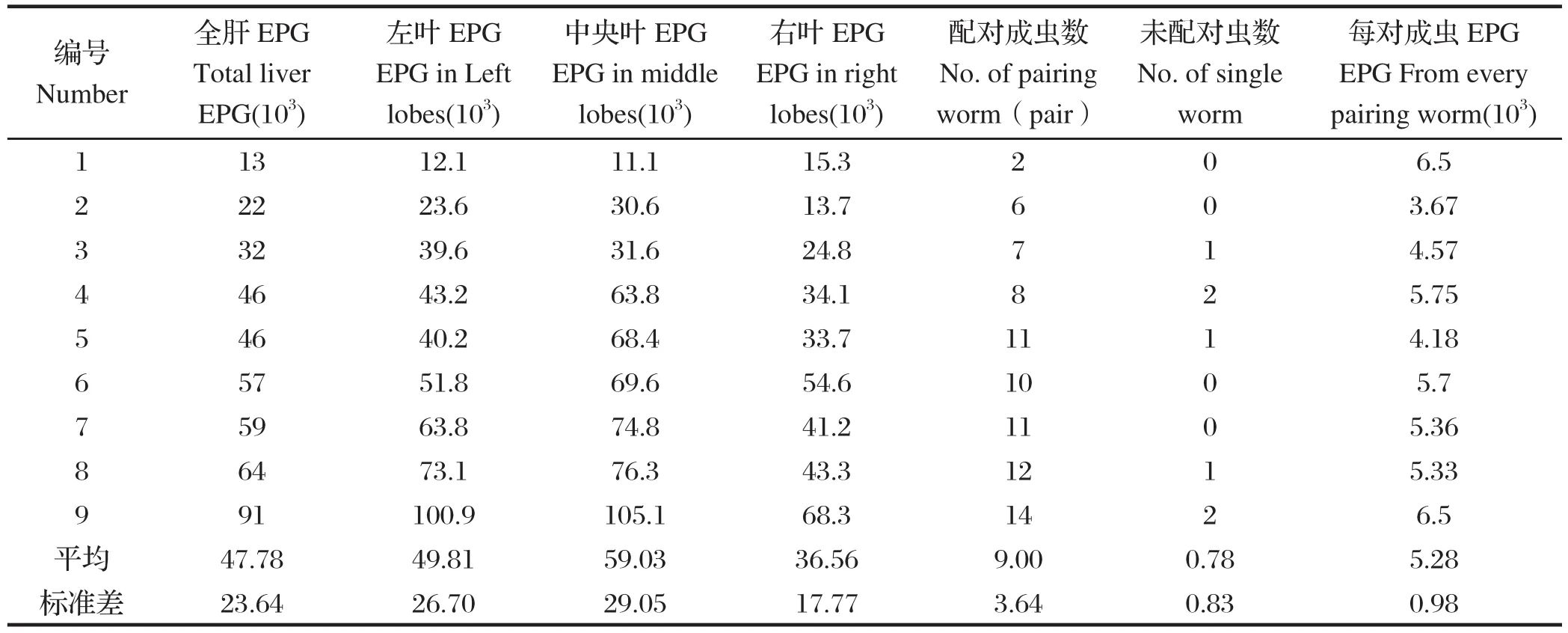
表1 肝脏EPG、虫卵计数单位EPG以及虫负荷的计数Table 1 Count of worm and EPG in every lobes of liver
3 讨论
小鼠肝脏分叶命法名分为2 种,第1 种以1931年Higgins命名法为标准,以肝门为中心,按逆时针把肝脏分为:尾叶、左叶、中叶和右叶4 个主叶[2];第2 种命名法,按上述顺序分为:乳头叶、左外叶、左内叶、中叶、右叶和尾叶[3,4]。2009年,汤朝晖[1]根据人类肝脏解剖分叶的特点和命名习惯将小鼠肝脏分为左外叶、左中叶、右中叶、右上叶、右下叶和尾状叶。我们依据小鼠肝脏的解剖特点,在参考汤朝晖的形态分叶基础上同时考虑取样的重量一致性,将小鼠肝脏各叶合并成三个可供计量的取样单位,分别是:中央叶,包括左中叶和右中叶;右叶,包括右上叶和右下叶以及尾状叶;左叶(左外叶)。这种取样方法保证了肝脏的重量不至于偏差太大,并且顺应肝脏的自然分叶,易于辨认和进行分离。三个计数单位的重量虽然不一致,但基本保持在0.6~1 g之间,利于采取标准的定容、消化、稀释操作。
肝脏EPG作为血吸虫病的病理指标以及血吸虫治疗、预防效果的判断指标,广泛用于血吸虫病相关研究中。研究发现,肝脏EPG的多少同体内配对成虫数有关,由于每对配对成虫均可产卵,因此配对成虫数越多,肝脏EGP越多。本试验结果也证实了这点。
由于肝脏解剖结构等因素的影响,虫卵进入肝脏各叶的数量也会相应不同。研究发现,依据我们提出的虫卵肝脏计数取样单位评价,肝叶之间EPG最大相差达2.24倍,差异具有显著统计学意义。以往评价肝脏EPG的数据没有具体说明从肝脏哪个部分采集样品进行计数,而是笼统的采取“取样1g左右”,“全肝消化”等方式进行虫卵计数,肝脏一般有2 g左右,取样1 g左右可因取样部位不同给数据带来严重的误差。全肝消化计数虫卵比部分抽样较为准确,但血吸虫研究中大多数动物评价实验还需要行灌洗冲虫,可因肝脏充水等因素而造成计数虫卵不准确。若在冲虫前取全肝,可造成冲虫效果下降。因此我们提出可通过冲虫前取相同部分肝脏组织行虫卵计数的方案,只要抽样计数的部位确定,比较虫卵EPG才具有科学意义。本研究同时发现,全肝EPG和计数取样单位的EPG存在线性关系,因此提出,血吸虫病研究过程涉及需要做肝脏EPG、减虫率评估等操作时,可采用取完整的相同虫卵计数取样单位或简单的采取相同肝叶的方法,这样一方面可以得到比较正确的虫卵计数数据,另一方面不影响后继的灌洗冲虫。
肝脏中虫卵分布的不同,主要是由于各肝叶的解剖结构不同造成的。鼠肝脏每个分叶都有独立的肝动脉、门静脉。门静脉在肝门处分为3 支:左支进入尾叶,头支较粗分3 支进入左叶和中叶,右支发出分支进入右上叶和右下叶。右上叶和右下叶在根部有肝组织相连,所谓左、右半肝是门静脉左及右支分别流注部分,由于这些管道的不同,造成虫卵在各肝叶的沉积数量不一,进而造成各肝叶的EPG的不同。我们依据肝脏的自然分叶,结合实验操作,提出的三个虫卵计数取样单位易于辨认和分离。按本试验的方法取样的肝脏重量适当,是较好的考察肝脏虫卵的方案,并可通过这种抽样计数EPG的方法间接得到宿主肝脏的虫卵负荷情况,对于比较固定叶之间的虫卵负荷不失为一种较科学的方案。
[1] 汤朝晖,周露婷,谢志芳,等.利用分叶顺次肝切除术建立小鼠肝脏大部切除后再生模型[J].第二军医大学学报,2009, 30(5): 524-526
[2] Higgins G M, Anderson R M.Restoration of the liver of the white rat following partial surgical removal[J].AMA Arch Pathol, 1931, 12: 186-202.
[3] 吕毅, 潘承恩, 孟令忠, 等.SD大鼠肝脏及附属管道的应用解剖[J].西安医科大学学报, 1998, 19(1): 70-73.
[4] 南开大学实验动物解剖学编写组.实验动物解剖学[M].北京: 人民教育出版社, 1980: 128-129.
