亚洲带绦虫60S核糖体蛋白L8基因的克隆表达和免疫学分析
2011-08-21戴佳琳廖兴江
王 宇,戴佳琳,黄 江,廖兴江
2.贵阳医学院现代病原生物学实验室,贵阳 550004;
3.贵阳医学院多媒体形态学实验室,贵阳 550004
亚洲带绦虫60S核糖体蛋白L8基因的克隆表达和免疫学分析
王 宇1,2,戴佳琳3,黄 江1,廖兴江3
目的原核克隆表达亚洲带绦虫成虫60S核糖体蛋白L8基因(TaRPL8),探索其应用前景。方法用RT-PCR方法从亚洲带绦虫成虫cDNA中获取RPL8基因,克隆到原核表达质粒pET-28a(+)中,在大肠埃希菌BL21/DE3中用IPTG诱导表达,表达产物通过SDS-PAGE进行鉴定,用镍离子金属螯合剂亲和层析柱进行纯化,纯化的重组蛋白用蛋白印迹进行免疫学分析。结果PCR、双酶切及DNA测序结果均表明pET-28a(+)-TaRPL8重组质粒构建成功。SDS-PAGE结果表明目的基因在大肠埃希菌BL21/DE3中获得高效表达,亲和层析获得了高纯度蛋白。重组蛋白可被其免疫的SD大鼠血清识别但不能够被正常大鼠血清识别,表明其具有免疫原性。结论亚洲带绦虫成虫TaRPL8基因可在大肠埃希菌BL21/DE3中获得具有免疫原性的表达,为进一步的功能研究奠定了基础。
亚洲带绦虫;60S核糖体蛋白 L8基因;基因克隆;原核表达
2.贵阳医学院现代病原生物学实验室,贵阳 550004;
3.贵阳医学院多媒体形态学实验室,贵阳 550004
至上世纪70年代以来,在我国台湾地区、东南亚地区、和我国大陆地区相继报道了一种带绦虫,其成虫特征几乎和牛带绦虫一致,而囊尾蚴又与猪带绦虫极为相似。这种带绦虫的中间宿主是猪,人因生食猪肝等内脏而感染。这种带绦虫被命名为亚洲带绦虫[1-3]。近年来的研究证实在贵州省都匀地区存在亚洲带绦虫病的流行。本课题组对该虫做了一些分子生物学研究,但对核糖体蛋白及其相关基因却了解甚少。本研究通过构建pET-28a(+)-TaRPL8原核表达载体,并对其原核表达产物进行纯化和免疫学初步研究。
1 材料与方法
1.1 材料
1.1.1 标本来源,质粒,菌株 虫体标本采自亚洲带绦虫流行区贵州省都匀市米秀乡;原核表达质粒pET-28a(+)和大肠杆菌BL21/DE3由中山大学热带病重点实验室惠赠。
1.1.2 主要试剂和工具酶 Trizol试剂购自美国Invitrogen公司;逆转录试剂盒(PrimeScriptTM RT reagent Kit)购自日本TaKaRa公司;T a KaRa Ex Taq 酶、EcoRI、X hoI、DNA 标准(DL15000、DL2000)(大连宝生物工程公司);T4 DNA连接酶、异丙基-β-D-硫代半乳糖苷(IPTG)(美国 Promega公司);Ni-IDA Agarose(Cat.No.30210)(德国NOVEGN公司);兔抗人IgG试剂盒(武汉博士德生物工程有限公司);质粒提取试剂盒(广州东盛科技公司);低分子量蛋白分子量标准为Fermentas公司(立陶宛)产品;DNA凝胶回收试剂盒(广州铂尔生物科技公司)。
1.1.3 引物的合成和DNA的测序 基因扩增引物由Introvigen上海生物技术有限公司合成 ,重组质粒DNA的测序由金斯特科技股份有限公司完成。
1.2 方法
1.2.1 亚洲带绦虫成虫总 RNA的提取及cDNA的合成 取新鲜亚洲带绦虫成虫节片 ,无菌水清洗干净体表 ,立刻放进DEPC水处理的匀浆器中 ,加入1mLTrizol后匀浆 ,直至样品全部融化成液体 ,将其移入无菌且 RNase free EP管 ,用力振荡3min,室温静置5min。加入0.2mL氯仿 ,混合后静置10 min,4℃12 000g离心20 min,小心取上清液到一个新的RNase free EP管中。加入0.5mL异丙醇 ,室温静置 10 min,4℃12 000g离心 15 min,弃上清液。沉淀加入 1mL75%乙醇 ,震荡15s,4℃7 500g离心5min,弃上清液,倒置在超净台上10min,加入30μ L纯水溶解沉淀 ,所获得的总RNA保存于 -80℃冰箱中。取适量的RNA样品合成cDNA[4-6]。反应体系为:模板 2μ L(500ng),5×PrimeScript缓冲液 2μ L,PrimeScript酶混合物0.5μ L,OligodT 和 Random 6 mers引物各0.5μ L,加RNase Free dH2O至总体系为10μ L。反应条件:37℃30min,85℃5 s。-20℃保存备用。
1.2.2 引物的设计合成、基因扩增 根据Gen-Bank上相关60S核糖体蛋白L8基因序列,利用引物设计软件 Premier 5.0设计引物,上游引物为:5′-CCGGAAT TCAGCGGTGACCGTACAT TCGG-3′;下游引物为:5′-CCGCTCGAGCTACGAACGGACCT TCT TGT-3′。以亚洲带绦虫成虫 cDNA为模板,应用上述设计的特异引物扩增目的基因 ,PCR产物行1.5%琼脂糖凝胶电泳鉴定且回收。
1.2.3 重组原核表达质粒的构建及鉴定 将PCR产物胶回收后和原核表达质粒pET-28a(+)用EcoRI和Xhol进行双酶切后回收 ,连接、转化大肠埃希菌BL21/DE3感受态细胞 ,卡拉霉素筛选阳性单克隆 ,提取的重组质粒进行双酶切、PCR和DNA测序鉴定后进行原核表达[7]。
1.2.4 重组蛋白的诱导表达 挑取含有 pET-28a(+)TaRPL8重组质粒的E.coliBL21/DE3的单菌落接种于含卡那霉素的 LB液体培养基中[空质粒p ET-28a(+)的 BL21/DE3作为阴性对照],放入37°C摇床 ,摇至OD600约为0.6时,取1mL作为诱导前样品 ,加入IPTG至终浓度为1mmol/L,摇床诱导表达5h后离心收集菌体作为诱导后样品 ,所有样品离心后收集菌体离心后取上清行SDS-PAGE电泳分析。
1.2.5 重组蛋白的纯化和蛋白质印迹(Western blotting)分析 依据上述诱导表达方法对阳性克隆进行大量的诱导表达 ,离心收集菌体 ,冰上超声裂解 ,分别取上清和沉淀样品处理后行SDS-PAGE判断重组蛋白的可溶性。尿素变性纯化重组蛋白,按参考文献[8]方法进行,用Bradford法测蛋白浓度,并于-80℃保存备用。蛋白质印迹(Western blot)分析。
2 结 果
2.1 RNA提取 对亚洲带绦虫成虫用Invitrogen公司的T rizol试剂提取总RNA,紫外分光光度计测定OD260/280为1.96,见图1 。

图1 Total RNA电泳图Fig.1 Electropherogram of sample total RNA
2.2 原核重组质粒的鉴定、分析 将重组质粒进行PCR和双酶切鉴定,产物进行1.5%琼脂糖凝胶电泳。结果显示在250~500bp之间有一清晰的条带,与目的基因的大小基本相符,证明重组质粒构建成功,见图2。同时测序结果表明该基因与日本血吸虫RPL8基因(登录号为FN330829)的氨基酸序列的同源性达79%,所以命名为亚洲带绦虫60S核糖体蛋白L8基因,通过生物信息学分析该基因编码蛋白的理论分子质量和等电点分别是14123.4Da和8.75。
2.3 蛋白表达纯化结果 将构建好的重组质粒转化到E.coliBL21/DE3中表达,SDS-PAGE电泳分析结果见图3中第4、5泳道所示,大约在14kDa左右处出现表达条带,与目的蛋白分子量基本相符。将蛋白进行纯化,结果见图3第7泳道所示,证明目的蛋白纯化成功。用Bradford法测该蛋白浓度为0.56mg/mL。
2.4 Western blot鉴定重组蛋白TaRPL8免疫原性 纯化得到的重组蛋白TaRPL8行15%SDSPAGE,Western Blot,使用SD大鼠抗重组蛋白TaRPL8的特异抗血清作为一抗,结果显示特异性抗血清能识别重组蛋白TaRPL8,而正常大鼠血清不能识别,见图4。
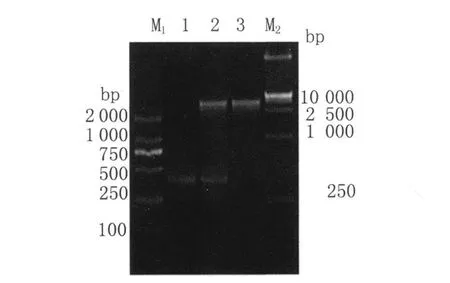
图2 重组质粒的PCR及双酶切鉴定M1:DNA标志物2 000;1:从亚洲带绦虫cDNA中扩增的 PCR产物;2:重组质粒(pET-28a(+)-Ta RPL8)用 EcoRⅠ和 XhoⅠ酶切;3:重组质粒(pET-28a(+)-Ta RPL8);M2:DNA标志物15 000Fig.2 The identification of the pET-28a(+)Ta RPL8 by PCR amplification and digestion with restriction enzymesM1:DNA Marker DL2 000;1:the PCR product amplified from cDNA of Taenia saginata asiatica;2:the recombinants(pET-28a(+)-Ta RPL8)digested by EcoRⅠand XhoⅠ;3:the recombinants(pET-28a(+)-Ta RPL8);M2:DNA Marker DL15 000
3 讨 论
核糖体是生物细胞内的蛋白质合成场所,核糖体蛋白广泛分布于真核生物的各个组织中,核糖体蛋白除了参与组装核糖体的大小亚基之外 ,在生物体内还行使其它重要且保守的功能。核糖体蛋白有许多成员 ,有关它们的分类十分清楚 ,但来源不同生物的相应的核糖体蛋白的序列比较保守 ,这为用同源序列来研究系统发育提供了基础。目前 ,核糖体蛋白序列在分子系统学研究中已有所应用 ,并取得了较好的结果[9]。核糖体蛋白是参与生物系统发育的重要蛋白,在利什曼原虫疫苗的研究中,已证实具有重要的潜在价值[10]。
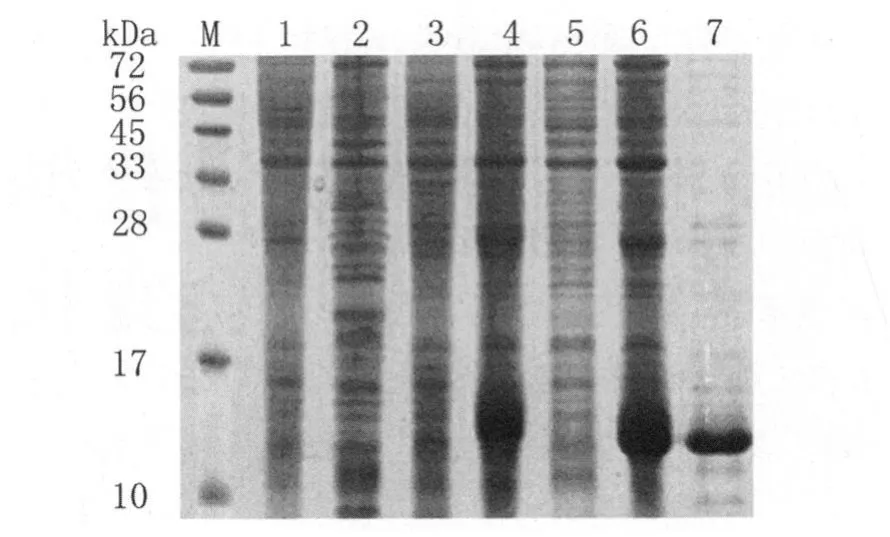
图3 重组质粒的表达及其纯化产物的15%SDS-PAGE电泳分析M:蛋白标志物;1:pET-28a(+)质粒未加IPTG诱导;2:pET-28a(+)质粒加IPTG诱导;3:pET-28a(+)-Ta RPL8质粒未加IPTG诱导;4:pET-28a(+)-Ta RPL8质粒加IPTG诱导;5:pET-28a(+)-Ta RPL8质粒加IPTG诱导后上清;6:pET-28a(+)-Ta RPL8质粒加IPTG诱导后沉淀;7:pET-28a(+)-Ta RPL8质粒加IPTG诱导后沉淀纯化产物Fig.3 15%SDS-PAGE analysis of the prokaryotic expression product and purified productM:Protein marker;1:pET-28a(+)trantformants without IPTG induction;2:pET-28a(+)trantformants with IPTG induction;3:pET-28a(+)-Ta RPL8 trantformants without IPTG induction;4:pET-28a(+)-Ta RPL8 trantformants with IPTG induction;5:insoluble protein of pET-28a(+)-Ta RPL8 trantformants;6:sediments of lysate pET-28a(+)-Ta RPL8with IPTG induction;7:purification of insoluble protein of pET-28a(+)-Ta RPL8 trantformants

图4 重组Ta RPL8蛋白的免疫原性M.蛋白标志物;1:重组蛋白免疫SD大鼠后血清;2:健康大鼠血清Fig.4 Immunogenicity of recombinated Ta RPL8M:protein marker;1:recombinanted pET-28a(+)-Ta RPL8 reacted with serum form immunized SD rat;2:crude antigens reacted with serum from normal rat
本实验成功从亚洲带绦虫成虫cDNA中获得60S核糖体蛋白RPL8基因并构建了pET-28a(+)-TaRPL8重组质粒,测序后序列经 NCBI网站Blastx在线分析 ,该基因序列编码的氨基酸序列与GenBank中日本血吸虫 RPL8基因(登录号为FN330829)的氨基酸序列的同源性可达到79%,并具有完整的RPL8保守功能域 ,该序列含有完整的开放阅读框 ,是一个全长cDNA序列。预测其编码的蛋白相对分子量理论值是14 123.4Da,理论等电点8.75,蛋白的理化性质较稳定。Western Blotting结果表明纯化蛋白能被重组蛋白免疫的SD大鼠血清识别而不能够被正常SD大鼠血清识别 ,说明重组蛋白具有免疫原性。同时亚洲带绦虫成虫60S核糖体蛋白RPL8的获得是对绦虫核糖体蛋白研究的重要补充,为今后更多核糖体蛋白序列的获得及相关功能研究提供了参考。
[1]包怀恩.我国亚洲牛带绦虫研究的现状和展望[J].热带医学杂志,2002,2(3):215-219.
[2]Fan PC.Experimental infection of ThailandTaenia(Chiengma strain)in domestic animals[J].International Journal of Parasitology,1990;20(1):121-123.
[3]Fan PC.Experimental infevtion of philippineTaeniain domestic animals[J].International Journal of Parasitology,1992;22(2):235-238.
[4]Cong X,Shao Zhan-tao,Yuan Jin,et al.Cloning and phylogenetic analy sis of the ribosomal protein L8 cDNA of the Weever(Lateolabrax japonicus)[J].Prog ress in M odern Biomedicine,2008,8(5):858-861.
[5]刘志华,杨 谦.球毛壳菌 60S核糖体蛋白 L10a基因克隆与特性分析[J].微生物学通报,2006,(1):24-28.
[6]潘湛清,姚琼,唐斌,等.甜菜夜蛾三个60S核糖体蛋白基因的获得与序列分析[J].环境昆虫学报,2008,30(4):310-317.
[7]萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯 T,著.分子克隆实验指南[M].2版.北京:科学出版社,2002:822-849.
[8]申萍香,吴璇,黄 江,等.亚洲牛带绦虫成虫延伸因子-1基因的表达、纯化及免疫学分析[J].西安交通大学学报(医学版),2008 29(4):379-382.
[9]Probst P,Stromberq E,Ghalib H W,et al.Identification and characterization of T cell-stimulating antigens from Leishmaniaby CD4 T cell expression cloning[J].Immunol,2001,166(1):498-505.
[10]汪世平,高冬梅,何卓,等.日本血吸虫核糖体蛋白SjRPS4、SjRPL7DNA疫苗对小鼠免疫保护作用研究[J].中国人兽共患病学报,2010,26(2)97-100.
Cloning and prokaryotic expression of 60S ribosomal protein L8 gene ofTaenia saginata asiaticaand analysis on immunogenicity of the recombinant protein
WANG Yu,DAI Jia-lin,HUANG Jiang,LIAO Xing-jiang
(Department of Parasitology,Guiyang Medical College,Guiyang550004,China)
To clone and express the novelgene named 60S ribosomal protein L8 gene ofTaenia saginata asiatica(TaRPL8)in order to analyze the immunogenicity of the recombinant protein.The full-length cDNA of RPL8 gene was cloned fromTaenia saginata asiaticausing RT-PCR;and cloned into the prokaryotic expression vector pET-28a(+)and then expressed inE.col iBL21 with IPTG induction.The recombinant protein was detectedby SDS-PAGE and purified by Ni-IDA affinity chromatography.And its immunogenicity was analyzed by Western Blotting.PCR,double enzyme digestion and DNA sequencing confirmed that the recombinant expression plasmid was successfully constructed.The expression products were obtained and purified by Ni-IDA affinity chromatography.Western blot analysis ofT.a.RPL8 recombinant protein testified that it could be recognized by immunized SD rat serum but couldn't be recognized by normal SD rat,which indicated its immunogenicity.It's suggested that a novel gene coding RPL8 ofTaenia saginata asiaticawas cloned,expressed,purifiedand identified successfully.The purified protein ofTaRPL8 coule be of importance for further research on the biological function of the gene.
Taenia saginata asiatica;60S ribosomal protein L8 gene;molecular cloning;prokaryotic expression
R383
A
1002-2694(2011)08-0731-03
*国家自然科学基金资助项目(No.30760227)和贵州省科技攻关项目[黔科合NY字(2008)3060]联合资助
黄江,Email:mmm_hj@gmc.edu.cn
1.贵阳医学院寄生虫学教研室,贵阳 550004;
2010-11-01;
2010-01-14
