量子点标记肺炎支原体重组蛋白抗体检测抗原方法的建立*
2011-08-21曾晶晶何梦博赵芝娜周世冠王桂珍
曾晶晶,何梦博,赵芝娜,周世冠,王桂珍
量子点标记肺炎支原体重组蛋白抗体检测抗原方法的建立*
曾晶晶,何梦博,赵芝娜,周世冠,王桂珍
目的建立一种用CdSe/ZnS量子点标记技术用于肺炎支原体检测的方法。方法用重组Mp P1蛋白免疫动物制备免疫血清,硫酸铵沉淀法及离子层析法纯化IgG抗体,纯化抗体用CdSe/ZnS量子点标记,离心沉淀法纯化标记产物。用标记抗体检测Mp抗原。结果量子点标记抗体直接玻片荧光法检测Mp抗原具有较高的敏感性(检测灵敏度在0.001μ g/mL),且与呼吸道常见病原菌无交叉反应。结论成功建立量子点标记技术检测肺炎支原体抗原方法,具有操作简单、检测快速的优良,适用于M p感染的早期诊断。
肺炎支原体;量子点标记技术;抗原检测
近年来,量子点凭借其自身独特的光谱特征和光化学稳定性越来越受到人们的重视。量子点(quantum dots,QDs)是一种半导体纳米晶体,与传统荧光染料相比,具有激发光谱宽、发射光谱窄、发光效率高,发光颜色可调,并且具有较高的荧光强度和光稳定性,能够承受多次的激发和光发射等一系列优点[1-2],在实验室诊断中有着广泛的应用前景。
肺炎支原体(Mycoplasma pneumoniae,Mp)不仅引起急性呼吸道疾病,还引起其他多系统、多器官的肺外并发症[3]。由于Mp无细胞壁,故其引起感染的治疗与其它细菌和病毒感染在治疗方法上有所不同。对Mp的实验室诊断,支原体分离培养虽然是金标准,但其分离率低、时间长,成本高不适于临床应用[4]、主要是通过血清学检测和分子生物学[5]等方法,而这些方法存在着各自不同的优缺点,因此,到目前为止,国内外对Mp的实验室诊断没有统一的标准。本研究基于QDs标记技术,拟探讨用量子点标记的重组Mp P1抗体检测Mp抗原,建立一种新的检测体系和方法,以期解决Mp感染的早期、快速诊断问题。
1 材料与方法
1.1 试剂与材料 Mp FH菌株、金黄色葡萄球菌、大肠杆菌、甲型链球菌和乙型链球菌均为本实验室保存菌种;P1重组蛋白为本实验室制备;发射波长605nm的核壳型CdSe/Zns硒化镉量子点,表面活性基团为羧基,购自武汉珈源量子点公司;弗氏完全佐剂和不完全佐剂购自Sigma公司;1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸(EDC)、N-羟基琥珀酰亚胺(NHS)均购自上海生工;荧光分光光度计(HITACHI);荧光显微镜(OLYMPUS)。
1.2 方法
1.2.1 兔源多抗的制备 P1重组蛋白的提取与纯化参照文献[6],纯化的重组蛋白加等体积弗氏完全佐剂免疫家兔,多点皮下注射免疫,以弗氏不完全佐剂加强免疫3次后颈动脉采血获得多抗血清,以ELISA法测定抗体效价。
1.2.2 IgG的提取纯化 采集的免疫血清用硫酸铵沉淀法粗提免疫球蛋白,取免疫血清加入饱和(NH4)2SO4使其成20%溶液,以除去纤维蛋白。吸取离心上清加入饱和(NH4)2SO4使之成为50%溶液以除去白蛋白,再加入饱和(NH4)2SO4使其成33%溶液从而除去类球蛋白,沉淀溶于PBS中即为粗提Mp多克隆抗体。取NaOH处理后的DEAESephadex A-50装柱,用0.01 mol/L PBS平衡至pH7.4后加入硫酸铵粗提免疫球蛋白,然后用洗脱液进行洗脱并分管收集,用紫外分光光度计测纯化抗体的浓度。采用SDS-PAGE方法确定抗体纯度。
1.2.3 抗体标记与纯化[7]在1.5mL的微量离心管中加入50μ L的量子点(8.05μ mol/L),然后加入10μ LEDC(0.4mg)和 10 μ L sulfo-NHS(0.2mg),加磷酸盐缓冲液补至800μ L,不停地混合溶液,室温下反应20min。加入纯化的抗体 200 μ L(5 mg/mL),37℃振荡反应2 h。加入100 μ L甘氨酸(1 mol/L),封闭量子点上未反应的羧基。将偶联反应所得到的产物4℃,12 000 r/min离心20 min,所得沉淀即为纯化的偶联有量子点的P1重组蛋白抗体。
1.2.4 量子点偶联产物效果测定 偶联产物荧光效率测定:用荧光分光光度计测定量子点标记的抗体,通过标记物荧光强度的测定,判定抗体-量子点的偶联反应是否改变量子点的荧光效率。试验所用激发光为488 nm,扫描605 nm的发射波谱。
偶联产物的免疫反应性测定 取Mp全菌抗原2μ L滴于硝酸纤维素膜(NC膜)上,4℃干燥后用BSA-PBS 4℃封闭过夜。用PBS洗膜 3次,干燥后,在含有包被抗原处分别加入量子点偶联-P1重组蛋白抗体、量子点、P1重组蛋白抗体和PBS反应。37℃作用2 h,反应后用PBS洗3次,在紫外灯下观察结果。
1.2.5 量子点偶联产物检测Mp抗原 取Mp FH对数生长期培养物,12 000 r/min离心30min,弃上清,沉淀加入0.01 mol/L的PBS溶液,充分混匀,离心洗涤3次,收集沉淀反复冻融3次后,即为Mp菌体抗原,加入0.01 mol/L的PBS制备菌悬液,取5μ L菌悬液滴加于玻片上,室温自然干燥,用-20℃预冷的丙酮固定。将1∶40稀释的偶联有P1重组蛋白多克隆抗体的量子点(0.4μ mol/L)滴加入上述抗原片上,于37℃湿盒中作用45 min,用 PBS洗涤3次,自然干燥,滴加碱性缓冲甘油,加盖玻片封片,在荧光显微镜下观察。
1.2.6 敏感性试验 将Mp菌体抗原依次稀释为10 μ g/mL 、1 μ g/mL 、0.1 μ g/mL 、0.01 μ g/mL 、0.001 μ g/mL,固定其它条件,操作过程同 1.2.5,以PBS作空白对照进行检测。
1.2.7 特异性试验 分别将金黄色葡萄球菌、大肠杆菌、甲型链球菌和肺炎链球菌抗原按1.2.5操作,以PBS作空白对照进行检测。
2 结 果
2.1 Mp P1重组蛋白免疫血清纯化 ELISA方法测定P1免疫血清效价为1∶25 600,蛋白浓度为18.1 mg/mL,用饱和硫酸铵沉淀法后测得蛋白浓度为8.471 mg/mL,DEAE-Sephadex A-50离子交换层析法进行纯化后的P1重组蛋白IgG浓度为3.68 9mg/mL。SDS-PAGE结果显示见图1,粗制免疫血清中含有多种蛋白组分,饱和硫酸铵沉淀纯化的抗体仍有杂蛋白,而经过离子层析纯化后的血清仅有1条带,分子量为57kD与IgG重链分子量相符。
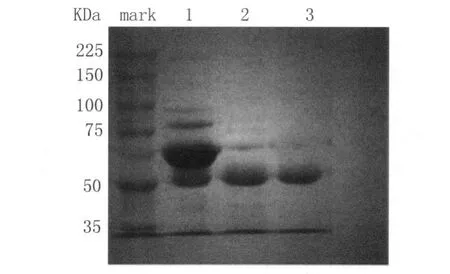
图1 SDS-PAGE鉴定Mark:分子量标准;1:P1重组蛋白免疫血清;2:P1重组蛋白硫酸铵沉淀免疫血清;3:P1重组蛋白离子交换层析方法纯化的血清Fig.1 Analysis of purified Mp IgG by SDS-PAGE
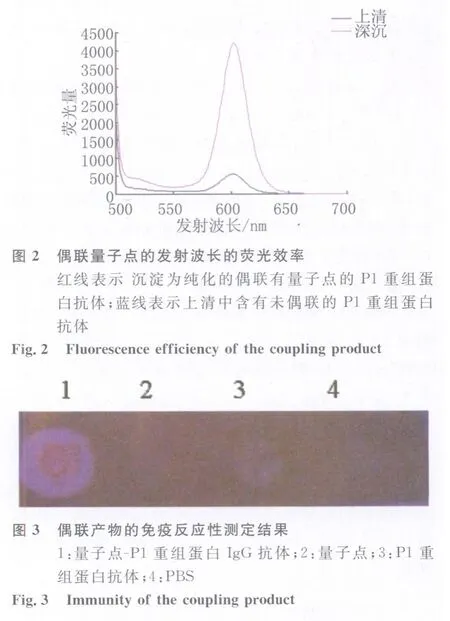
2.2 量子点偶联产物效果测定结果:用Hitachi F-4500分光光度计选择488nm激发波长测定标记产物。结果显示,抗体与量子点的偶联反应未改变量子点的发射波长的荧光效率。
偶联产物的免疫反应性测定结果显示,膜上滴加偶联有量子点的P1重组蛋白抗体显示较强的红色荧光,而滴加量子点、P1重组蛋白抗体和PBS对照的位置无红色荧光,如图3。证明本实验成功将量子点标记在P1重组蛋白抗体上,且被标记的P1重组蛋白抗体仍能与相应抗原分子特异性结合。
2.3 量子点偶联产物检测Mp抗原 含有有Mp菌体抗原部分呈现出橘黄色、边界清晰的圆形颗粒,见图4。随着MP抗原浓度减少,出现的荧光点也随之减少,其可以检测到 0.01μ g/ml~0.001μ g/mL MP蛋白中的抗原,见图5,表明有较高的敏感性。将标记抗体分别与金黄色葡萄球菌、大肠杆菌、甲型链球菌和肺炎链球菌抗原作用,由图6所示,结果表明特异性较好。

图4 ×1 000Fig.4 MP抗体颗粒

3 讨 论
近十多年来,量子点荧光标记技术陆续在生物医学领域中使用。早期研究主要集中于对细胞的免疫荧光标记成像。由于其具有高灵敏度、靶向、实时、原位、活体、多色、多功能示踪等特性,近来被应用于病原学检测及致病机制研究[8-9]。将量子点标记技术用于病原抗体检测[10]及抗原检测[11-12]的研究均有报道,结果显示量子点偶联抗体有较大的应用潜力,在实验室诊断领域中也受到了人们广泛的关注。
Mp感染广泛存在于世界各地,可引起地区性流行。早期诊断、早期治疗可明显缩短Mp感染病程,建立有效、敏感的早期检测方法是十分重要的。
本文利用交联剂DEC和NHS,采用共价键连接的方法进行抗体的量子点标记。EDC和量子点表面的羧基反应生成酰基异脲,但酰基异脲在水溶液中容易水解,又生成羧基产物。在溶液中加入NHS,酰基异脲极易和NHS反应,生成具有胺反应活性的NHS酯,其能与抗体表面的氨基反应生成稳定的酰胺而偶联到抗体上。与传统的抗体荧光素标记方法相比,量子点标记方法十分简单,只需要简单离心就可对标记产物纯化。而传统的抗体荧光素标记方法需要反应过夜,标记产物还需要透析法或层析法进行纯化,整个过程耗时,且操作繁琐。
本文应用量子点标记P1重组蛋白抗体用于Mp抗原的检测,由于重组蛋白特异性高[7],本研究用其抗体以直接免疫荧光法检测Mp抗原也显示出高的特异性,与其他呼吸道常见菌无交叉反应。在预先完成量子点标记后,从处理标本到完成目标抗原检测,用该方法检测所需时间为45~60min,对Mp蛋白抗原检测的灵敏度在0.001 μ g/mL,表明方法简便、快速、敏感。由于感染后抗原出现时间早于抗体,因此可用于Mp感染的早期诊断。
本研究应用量子点标记技术建立的Mp抗原检测方法,已经在实验阶段取得了比较理想的结果,不仅具有较高的灵敏度和很好的特异性,操作也更加简便快速。本实验组将会对该检测体系和方法在临床标本检测中应用作进一步的研究和评价。
[1]Kobayashi H,Hama Y,Koyama Y,et al.Simultaneous multicolor imaging of five different lmphatic basins using quantum dots[J].Nano Lett,2007,7(6):1711-1716.
[2]Kim KY.Nanotechnology platforms and physiological challenges for cancer therapeutics[J].Nanomedicine,2007,3(2):103-110.
[3]Macdowell AL,Bacharier LB.Infectious triggers of asthma[J].Immunol Allergy Clin North Am,2005,25(1):45-66
[4]She RC,Thurber A,Hymas WC,et al.Limited utility of culture for Mycoplasma pneumoniae andChlamydophila pneumoniaefor diagnosis of respiratory tract infections[J].J Clin Microbiol,2010,48(9):3380-3382.
[5]Honderlick P,Philippe B,Picard C,et al.Simultaneous detection by multiplex PCR of aty pical bacterial pathogens involved in infections of respiratory tract.Is it useful of the microbiological diagnosis of respiratory infections[J].Pathol Biol(Paris),2006,54(8-9):467-469.
[6]宋焕景,王桂珍,董占双,等.肺炎支原体P1重组蛋白抗原的纯化与应用[J].微生物学杂志,2007,27(3):107-110.
[7]Dwarakanath S,Bruno J G,Shastry A,et al.Quantum dot-antibody and aptamer conjugates shift fluorescence upon binding bacteria[J].Biochemical and Biophysical Research Communications,2004,325(11):739-743.
[8]Liu YJ,Yao DJ,Chang HY,et al.Magnetic bead-based DNA detection with multi-layers quantum dots labeling for rapid detection ofEscherichia coliO157∶H7[J].Biosens Bioelectron,2008,24(4):558-565.
[9]Ssinathrao S,Krishna K V Mohan,Chintamani Atreya.Gmmaphage lysine PlyG sequence-based synthetic peptides coupled with Qdot-nanocrystals are useful for developing detection methods forBacillus anthracisby using surrogates,B.anthracis-Sterne andB.cereus-4342[J].BMC Biotechnology,2009,9:67.
[10]李玲,蒲晓允,李蒙,等.基于量子点及免疫磁珠技术快速检测弓形虫抗体的实验研究[J].免疫学杂志,2009,25(1):105-107.
[11]李蒙,蒲晓允,李玲,等.应用量子点及磁微技术快速检测阴道毛滴虫抗原[J].第三军医大学学报,2009,31(8):740-43.
[12]Wang X,Du Y,Li Y,et al.Fluorescent identification and detection ofStaphy lococcus aureuswith carboxymethy l chitosam/Cds quantum dots bioconjugates[J].J Bimater Sci Polym ED,2010,10(19):61-75.
Detection ofMycoplasma pneumoniaeby quantum dots label antibody
ZENG Jing-jing,HE Meng-bo,ZHAO Zhi-na,ZHOU Shi-guan,WANG Gui-zhen
(Departmentof Pathogenic biology,College of basic medical science,Chinamedical universtity,Shenyang110001,China)
A test method using quantum dots conjugation was developed for the detection ofM.pneumoniae.To obtain the anti-M p P1 polyclonal antibody,a rabbit was immunized with recombinantMpP1 antigens.The polyclonal antiserum was purified by ammonium sulfate precipitation and ion exchange chromatography.CdSe/ZnS quantum dots(QDs)was used to label rabit anti-recombinant P1 protein IgG,and the production was purified.M.pneumoniaewas successfully detected at the concentration as low as 0.001 g/mL.No crossreaction was observed when this system was used to detectM.pneumoniaeand other common bacteria.The QDs test method established in this study had been demonstrated to be a specific,sensitive and rapid for the diagnosis of mycoplasma,and it offers a promising possibility to be used in laboratory diagnosis.
M.pneumoniae;quantum dots;antigen detection
R374
A
1002-2694(2011)08-0704-04
*辽宁省教育厅基金项目(No.2004D226)资助
王桂珍,Email:gzw004@126.com
中国医科大学基础医学院病原生物学教研室,沈阳110001
2011-01-17;
2011-03-24
