脑桥中央髓鞘溶解症的临床和MRI特点(8例报告)
2011-08-11严明兰
常 颖, 高 垚, 李 欢, 严明兰
脑桥中央髓鞘溶解症(central pontine myelinolysis,CPM)是并不多见的脱髓鞘疾病,由 Adams等[1]于1959年首先报道,呈散发性发病。目前关于CPM的病因看法并不一致,普遍认为是某些严重疾病导致的结果。国外报道:自1986年后不变的首位病因是慢性酒精中毒,占发病率的39%;其次是快速纠正低钠血症的病例(占报道的21.5%);占第3位的是肝移植术后的患者,占报道的17%[2]/.。国内郭筱华等[3]回顾性分析了72例CPM患者,首位病因是各种原因导致的水、电解质平衡紊乱(特别是低钠血症及快速纠正的病例,占54%)。CPM以往仅见于尸体解剖病理诊断,目前随着影像技术的发展,尤其是MRI的出现,本病得以更多地在患者生前诊断;但普通MRI扫描影像学表现往往要晚于临床症状,因此早期诊断需要弥散成像[4]。最早认为病变仅累及脑桥,以后发现除脑桥外其它部位也可出现相同的病理改变,如基底节、丘脑、下丘脑、皮质下白质、小脑、中脑等,并出现相应的临床症状,称脑桥外髓鞘溶解症(EPM),占 CPM病例的10%[5]。我国孙斌等[6]报道6例CPM,只有1 例累及脑桥,5例合并累及脑桥以外。激素、血浆交换治疗有效[7,8]。本文收集了2002年 ~2006年在吉林大学中日联谊医院收治的8例经临床和MRI证实的CPM和(或)EPM患者,报道如下。
1 资料与方法
1.1 患者资料 8例患者均为2002年~2006年吉林大学中日联谊医院就诊的患者,男5例,女3例;年龄28~67岁。具体的临床资料(见表1)。8例患者均有基础疾病,患者1经消化科会诊排除肝昏迷而转入神经内科;患者2和3直接首诊入神经内科。患者4肝硬化病史10余年,肝移植术后第2天突然出现意识障碍而转入神经内科。患者7在出现神经系统症状20d前诊断肾功能不全氮质血症期,改善肾功能治疗过程中,出现走路不稳,故首诊入神经内科。患者8诊断Ⅰ型糖尿病20余年,一直皮下注射胰岛素,诊断糖尿病肾病10余年。该患因突然出现意识障碍就诊,当时结合实验室检查诊断糖尿病高渗昏迷入我院内分泌科,入院第2天高渗状态纠正后,患者仍处于浅昏迷状态,且四肢不自主运动,双侧病理反射阳性,故转入神经内科。
8例均无低钠血症及其他离子异常,此8例患者亦没有长期大量饮酒史。
8例患者中5例急性起病,3例患者为急性肝损伤,既往均无肝病病史;第4例患者既往肝硬化病史,肝移植术后第2天发病。另4例患者均为慢性肾功能不全患者。6例有相应临床症状的患者在发病早期均行头部MRI检查,均表现脑桥基底部对称分布的蝙蝠翅样或桥脑弥散病灶,T1W1低信号、T2W2高信号,其中2例病灶几乎占据整个脑桥;这7例患者中有3例伴有脑桥外的髓鞘溶解,病灶主要分布在丘脑、壳核;这3例患者中的2例在发病后的1个月复查了头部MRI,发现脑桥的病灶有不同程度的缩小,表现 T1W1低信号、T2W2高信号,丘脑、壳核的病灶表现 T1W1高信号、T2W2高信号。另外1例无相应临床表现的患者头部MRI显示脑桥基底部T1W1低信号、T2W2高信号。除1例无临床症状及1例肝移植术后患者外,其余6例一经明确诊断,均立即行激素地塞米松10mg静点,7d后减为5mg,再继续应用7d后停药;同时给予中成药活血化瘀改善脑循环、脑代谢活化剂、预防感染、降转氨酶、改善肝功能、肾功能等综合治疗。3例发生在急性肝功能损伤后的患者治疗2w后全部意识转清,肢体瘫痪及球麻痹症状基本恢复正常,转氨酶也恢复正常;另外3例亚急性起病的患者肢体功能、共济运动、球麻痹的症状均有不同程度的恢复,生活可以自理。
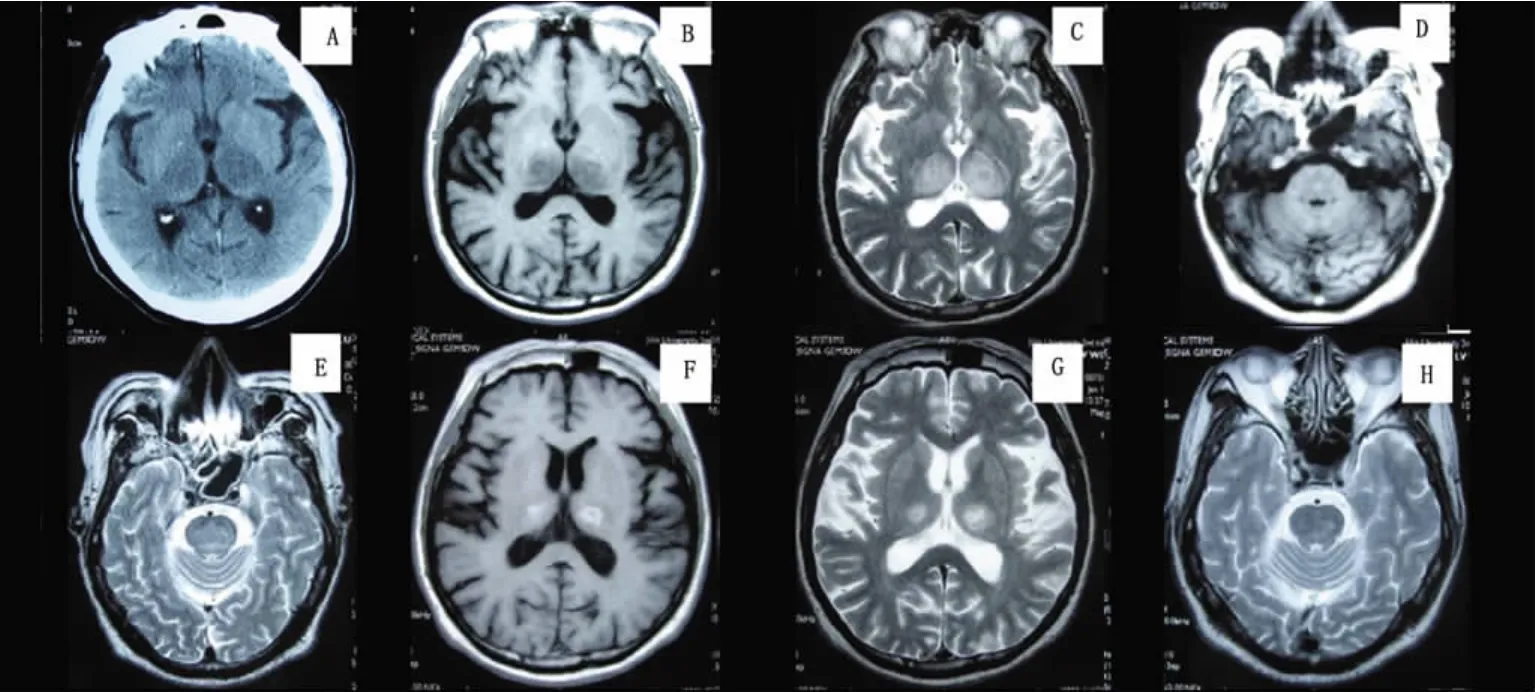
图1 患者1:双侧丘脑可见“猫眼”样对称的低密度改变(A),入院第2天头部MRI显示:双侧丘脑、桥脑长T1、长T2异常信号(B~E),3w后复查头部MRI示:脑桥、双侧丘脑病灶明显缩小,但双侧丘脑病变表现为短T1、长T2异常信号(F~H)

图2 患者2:脑桥典型的蝙蝠翅膀样及双侧丘脑的长T1、长T2异常信号(A~D)

表1 8例患者的临床资料
2 讨论
本组的8例患者均没有低钠血症,主要的病因是肝功能异常及代谢紊乱(包括糖尿病、慢性肾功能不全、糖尿病肾病),与文献报道的不一致,考虑可能为本组病例的病例数较少有关。
目前,关于CPM的发病机制并未完全阐明。有大量研究关注低钠血症及其纠正速度对脑的影响。血钠浓度降低,水顺渗透梯度进入脑细胞导致脑水肿发生。因此,如果快速纠正慢性低钠血症,由于Na+、K+以及有机溶质不能尽快进入脑细胞,可能引起脑细胞急剧缺水,导致髓鞘和少突神经胶质细胞脱失。最近研究表明血浆渗透压升高可引起脱髓鞘,也称渗透压性脱髓鞘。而血尿素氮及血糖是影响血浆渗透压的重要指标[9~12],因此认为CPM可继发于高血糖和氮质血症的患者[13]。本组4例患者有慢性肾功能不全,其中1例为糖尿病、糖尿病肾病;3例急性发作的患者发病时血浆渗透压明显高于正常水平,而另外的1例患者因无明显的神经系统症状,故血浆渗透压在正常范围。因此我们推断糖尿病、肾功能不全的患者在急性发作时会伴有血浆渗透压的升高,而渗透压的升高会导致脱髓鞘的改变。
肝功能障碍引起CPM的病理机制目前并不清楚,但肝功能障碍可引起葡萄糖耐受不良及蛋白合成减少、浮肿;肝功能障碍也能引起血脑屏障的破坏导致血管源性脑水肿,而脑桥对血管源性水肿特别敏感。因此肝功能异常被认为是引起CPM的一个重要因素。本组有3例患者为急性肝功能障碍,该3例患者既往均没有肝脏病病史,入院后诊断CPM。因糖皮质激素对血脑屏障有保护作用[14,15],且可抑制血脑屏障的破坏,故上述3例患者均给予地塞米松治疗,2w后临床症状明显好转。因此我们认为,肝功能异常导致血脑屏障受到破坏,引起CPM,早期的激素治疗有效。
肝移植术后已成为CPM的第3大病因。接受肝移植手术的患者术前多伴有低钠血症,血钠的快速恢复及术后的血浆渗透压的升高、手术时间过长、术后应用免疫抑制剂环孢霉素是肝移植术后患者引起CPM的主要原因[16~18]。本组患者有1例患者为肝移植术后,因曾行脾栓塞手术,故未能行头部MRI检查,但头部CT的改变提示为CPM。
目前认为MRI是对CPM具有确诊价值的检查方法。在急性期T1加权像为低信号、T2加权像为高信号。弥散加权像(diffusion weighted imagine,DWI)对早期的脱髓鞘病变更为敏感[4]。本组6例有相应临床症状的患者在发病早期均行头部MRI检查,表现脑桥基底部均可见对称分布的蝙蝠翅样或脑桥弥散病灶,T1W1低信号、T2W2高信号,其中2例病灶几乎占据整个脑桥。6例患者中有3例伴有脑桥外的髓鞘溶解,病灶主要分布在丘脑、壳核;这3例患者中的2例在发病后的1个月复查了头部MRI,发现脑桥病灶有不同程度缩小,表现T1W1低信号、T2W2高信号;丘脑、壳核的病灶表现T1W1高信号、T2W2高信号。T1、T2在1个月后均表现的高信号考虑与髓鞘溶解后的代谢产物有关[19~22]。
为预防髓鞘溶解,在积极处理原发病的同时,应尽可能避免电解质紊乱,尤其低钠血症。24h血钠升高以不超过25mmol/L为宜,一旦症状控制,就应减少钠的应用,血钠24h升高一般不超过10mmol/L。目前主张用生理盐水慢速纠正,并限制液体入量。对髓鞘溶解的治疗早期应用脱水剂,大剂量激素并辅以改善脑循环,神经营养和抗感染等综合支持治疗。本组6例患者均行激素治疗,同时给予改善脑循环、脑代谢活化剂、预防感染等综合治疗,6例患者均好转出院,生活自理,提示预后不像以往那么差,故临床上遇到CPM和(或)EPM患者无论病情多严重,均不应放弃治疗。
[1]Adams RD,Victor M.Central pontine myelinolysis.In disease of the nerver system due to nutritional deficiency[M].Chapter 38,principles of Neurology(3rd),New York:1985.778 -780.
[2]Kleinschmidt-DeMasters BK,Rojiani AM,Filley CM.Central and extrapontine myelinosysis:then and now[J].J Neuropathol Exp Neruol,2006,65:1 -11.
[3]郭筱华,赵忠新.脑桥中央髓鞘溶解症的流行病学、发病机制和临床特点[J].中华神经科杂志,2006,39(4):275 -277.
[4]Kimberly AR,Norbert GC,Gary MM.Early diagnosis of central pontine myelinolysis with diffusion-weighted Imaging[J].AJNR AM Neuroradiol,2004,25:210 -213.
[5]陈清堂.临床神经病学[M].北京:北京科学技术出版社,2000.504-506.
[6]孙 斌,武小玲,朱 克,等.脑桥中央髓鞘溶解症[J].中国临床神经科学,1999,7(1):26 -28.
[7]Daniela G,Francesca C,Stefano V,et al.Plasmapheresis improves the outcome of central pontine myelinolysis[J].J Neurol 2005,252:734 -735.
[8]Murase T,Sugimura Y,Takefuji S,et al.Mechanisms and therapy of osmotic demyelination[J].Am J Med,2006,119:69 -73.
[9]Rajbhandari SM,Powell T,Davies-Jones GAB,et al.Central pontine myelinolysis and ataxia:an unusual manifestation of hypoglycemia[J].Diabet Med,1998,15:259 -261.
[10]Itoh M,Matayoshi Y,Miyawaki H,et al.A case of hyperosmolar nonketotic diabetic coma associated with rhabdomyolysis and central pontine myelinolysis[J].J Jpn Soc Intensive Care Med,1999,6:373 -377.
[11]Sugie M,Kamiya Y,Satou H,et al.Asymptomatic osmotic demyelination syndrome accompanied by chronic hepatitis C,chronic alcoholism and diabetes mellitus[J].Neurol Med,2007,67:488 -490.
[12]Tarhan NC,Agildere AM,Benli US,et al.Osmotic demyelination syndrome in end-stage renal disease after recent hemodialysis:MRI of the brain[J].Am J Roentgenol,2004,182:809 -816.
[13]Hiroo I,Hidetomo M,Hirotaka K,et al.Central pontine lesions observed with MRI in four diabetic patients[J].Inter Med,2008,47:1425 -1430.
[14]Sterns RH,Silver S,Kleinschmidt-DeMasters BK,et al.Current perspectives in the management of hyponatremia:prevention of CPM[J].Expert Rev Neurotherap,2007,7:1791 -1797.
[15]Palmer BF,Gates JR,Lader M.Causes and management of hyponatremia[J].Pharmacother,2003,37:1694 -1702.
[16]Kanwal F,Chen D,Ting L,et al.A model to predict the development of mental status changes of unclear cause after liver transplantation[J].Liver Transpl,2003,9:1312 -1319.
[17]Dunn CJ,Wagstaff AJ,Perry CM,et al.Cyclosporin:an updated review of the pharmacokinetic properties,clinical efficacy and tolerability of a microemulsion based formulation(neoral)1 in organ transplantation[J].Drugs,2001,61:1957 -2016.
[18]Seok JI,Youn J,Chung EJ,et al.Sequential observation of movement disorders and brain images in the case of central pontine myelinolysis and extrapontine myelinolysis[J].Parkinsonism Relat Disord,2006,12:462-464.
[19]Choe WJ,Cho BK,Kim IO,et al.Extrapontine myelinolysis caused by eletrolyte imbalance during the management of suprasellar germ cell tumors.Report of two cases[J].Nerv Syst,1998,14:155 -158.
[20]Ho VB,Fitz CR,Yoder CC,et al.Resolving MR features in osmotic myelinolysis(general pontine and extrapontine myelinolysis)[J].AJNR,1993,14:163 -167.
[21]Waragai M,Satoh T.Serial MRI of extrapontine myelinolysis of the basal ganglia:a case report[J].J Neuro Sci,1998,161:173 - 175.
[22]Jung Im Seok,Jinyoung Youn,Eun Joo Chung,et al.Sequential observation of movement disorders and brain images in the case of central pontine myelinolysis and extrapontine myelinolysis[J].Parkinsonism and Related Disorders,2006,12:462 -464.
