氯化锂对MPTP致帕金森病小鼠模型行为学及黑质多巴胺能神经元影响的研究
2011-08-11王炎强刘洪梅王红军曹俊平肖成华高殿帅
王炎强, 刘洪梅, 王红军, 曹俊平, 肖成华, 高殿帅
帕金森病(Parkinson’s disease,PD)是继阿尔茨海默病之后最常见的进行性神经退行性运动障碍性疾病,以泛素蛋白酶体系统障碍、线粒体功能障碍、氧化应激等各种病理状态导致特发性黑质致密部多巴胺(dopamine,DA)能神经元变性,Lewy小体形成为主要特征。目前临床上尚无明确地有效控制与逆转病程的措施,且患病率日趋增高,已引起医学科研人员的广泛关注。因此,寻找延缓或阻止病变发展的替代治疗成为当前亟待解决的核心问题之一。国内外学者证实锂盐除了以其独特的药理学特性在精神、癫痫疾病等方面取得良好的效益之外还且具有神经营养与保护作用。本研究以1-甲基4-苯基-1,2,3,-6四氢吡啶(MPTP)构建帕金森小鼠模型为平台,通过观察氯化锂(LiCl)对其行为学特征、黑质多巴胺能神经元变化的影响,探讨LiCl对黑质DA能神经元的保护作用,从而为PD病因、发病机制研究及临床防治提供科学依据。
1 材料与方法
1.1 动物及试剂 实验小鼠,7~8w龄,体重20~25g,由徐州医学院实验动物中心提供。氯化锂、MPTP、小鼠源TH抗体、兔源CaBP抗体、辣根过氧化物酶标记的生物素卵白素复合物、生物素结合的羊抗小鼠单克隆抗体(二抗)、碱性磷酸酶结合的山羊抗兔小鼠IgG购于Sigma公司;封闭用羊血清原液,购于北京中山公司。
1.2 PD模型的制备与分组 实验小鼠随机分为MPTP组、NS(生理盐水)组、LM(LiCl+MPTP)组、PM(PBS+MPTP)组,每组12只。NS组注射同等剂量的NS,其他3组均腹腔注射MPTP 30mg/kg,连续给药5d。其中:PM、LM组在小鼠腹腔注射MPTP第2天分别腹腔注射PBS(30mg/kg)与LiCl(30mg/kg),连续4d,注射后进行行为学测定。
1.3 行为学检测 (1)一般行为学与震颤麻痹评分观察:给药后立即观察行为变化,无任何症状0分;间断性细小震颤,但活动自如1分;频繁性震颤,后肢僵直,颤尾,活动逐渐受限2分;连续性震颤,四肢僵硬,吞咽活动频繁,活动受限3分;全身麻痹而死亡4分。(2)自主活动计数:自制30cm×30cm×15cm的有机玻璃盒,底部刻出6cm×6cm的格子,在安静光线较暗的环境中检测,适应环境10min后,计数5min内小鼠移动的格子数和站立的次数,连续测5次取平均值。(3)滚轴实验:在滚轴上保持平衡并连续运动,直径6cm,转速20r/min,适应5次后,每次间隔1min,连续测5次取平均值。(4)游泳实验:将受试小鼠放入20cm×30cm×20cm的有机玻璃水箱中,水深10cm,水温为22℃ ~25℃。在1min内能连续不断游泳记3.0分;大部分时间游泳仅偶尔漂浮记2.5分;漂浮时间占整个受试时间50%以上记2.0分;偶尔游泳记1.5分;偶尔用后肢游动并漂浮在一边记1.0分。每次检测间隔 1min,共检测5次取平均值[1]。
1.4 免疫组织化学染色 实验小鼠用水合氯醛腹腔麻醉后,4% 多聚甲醛灌注、取脑、后固定、石蜡包埋及连续脑组织冠状切片(厚6μm),切片脱蜡至水,微波修复,0.5%正常羊血清封闭,37℃,30min。依次加入小鼠抗TH抗体或抗CaBP抗体、生物素结合的羊抗小鼠Ig、辣根过氧化物酶(HRP)标记的生物素卵白素复合物。DAB分别对CB和TH显色,梯度酒精脱水,二甲苯透明,中性树胶封片。参照Paxions and Wastson(1986)图谱,将每个中脑组织切片从嘴侧至尾侧分为前、中、后3个区域。任意选择带有明显核仁的有清晰轮廓的TH+神经元或CB+神经元作为测量对象,测定单位面积内阳性细胞数平均数。
1.5 Western blot法检测 模型制备1w后,将与免疫组化同批同组小鼠快速断头取脑,分离右侧黑质,立即置液氮冻存备用。液氮中取出黑质加1.5 ml匀浆缓冲液,用Teflon匀浆器高速匀浆离心取上清夜,均在冰水浴中进行。按改良Lowry方法,以牛血清白蛋白为标准蛋白,测定蛋白后分装,置-80℃冰箱待用。按Hu等方法,等量蛋白样品经10%SDS-聚丙烯酰胺凝胶电泳分离后,以湿转法转移至NC上。转移后的NC膜经3%BSA封闭后加入一抗TH或CB,4℃过夜。用洗涤液洗膜,加入相应二抗(碱性磷酸酶结合的羊抗小鼠),37℃2h洗膜,以NBT/BCIP显色,反应达到要求后,流水洗涤终止反应。所得膜可直接用图像处理仪(Gene Company)扫描,ImageJ软件进行图像处理[2]。
2 结果
2.1 行为学测定 小鼠在 MPTP注射后3~5min出现竖毛、竖尾、弓背、运动减少、步态不稳、下颌和肢体尾部震颤等急性反应。1h内行为学改变较明显,24h后恢复正常。MPTP组小鼠震颤麻痹评分、移动格子数、站立次数、滚轴实验、游泳能力都显著低于NS组(P<0.05),LM组小鼠震颤麻痹评分、移动格子数、站立次数、滚轴实验、游泳能力都显著高于 PM 组 (P <0.05),(见表1)。
2.2 免疫组织化学染色结果 与NS组相比,MPTP组黑质TH、CB阳性神经元数目明显减少,差异有显著性(P<0.01),神经元呈带状分布仅存轮廓,阳性纤维、细胞稀疏,排列紊乱,胞体面积变小,胞浆染色变淡,突起细短、稀疏。TH、CB阳性神经元细胞突起的长短、数量、胞体的面积等形态学方面也有明显的差别。LM组和PM组比较,LM组黑质TH、CB阳性神经元数目明显增多,差异有显著性(P<0.01),神经元呈簇带状分布,比较密集,表达增多,阳性纤维、细胞浓密,排列整齐,胞体面积变大,胞浆染色深,突起粗长、浓密。胞体的数目、面积、突起的长度与突起数目也明显增多(见表2、见图1~图4)。
2.3 Western blot结果 腹腔注射LiCL和PBS后,同侧黑质TH蛋白、CB蛋白表达水平LM组与PM组相比差异有显著性(P<0.05)(见表2、见图5)。
表1 各组行为学评分比较()

表1 各组行为学评分比较()
与NS组比较*P<0.05;与PM组比较#P<0.05
行为学检测组别震颤麻痹评分 站立次数 移动格子数 滚轴实验 游泳实验NS组MPTP组PM组LM组0.00 ±0.00 2.23 ±1.25*2.21 ±1.26 1.62 ±0.94#24.61 ±7.85 15.52 ±5.47*14.81 ±6.13 20.72 ±7.68#73.54 ±8.72 53.26 ±6.32*52.83 ±7.14 67.82 ±9.31#22.63 ±5.70 11.48 ±4.31*12.72 ±3.87 16.51 ±4.62#2.96 ±1.41 1.51 ±0.57*1.67 ±0.63 2.42 ±1.15#
表2 各组黑质阳性细胞数与蛋白表达比较()

表2 各组黑质阳性细胞数与蛋白表达比较()
与NS组比较*P<0.01;与PM组比较#P<0.05
黑质TH、CB蛋白表达组别黑质阳性细胞数TH+ CB +TH CB NS组MPTP组PM组LM组67.53 ±10.76 34.85 ±8.62*30.52 ±5.30 63.74 ±12.48#36.41 ±6.64 19.76 ±5.83*21.26 ±6.14 56.47 ±7.51#1.23 ±0.21 1.00 ±0.00*1.00 ±0.00 1.98 ±0.57#1.15 ±0.17 1.00 ±0.00*1.00 ±0.00 1.87 ±0.76#

图1 MPTP组、NS组同侧黑质处TH免疫组织化学染色

图2 MPTP组、NS组同侧黑质处CB免疫组织化学染色
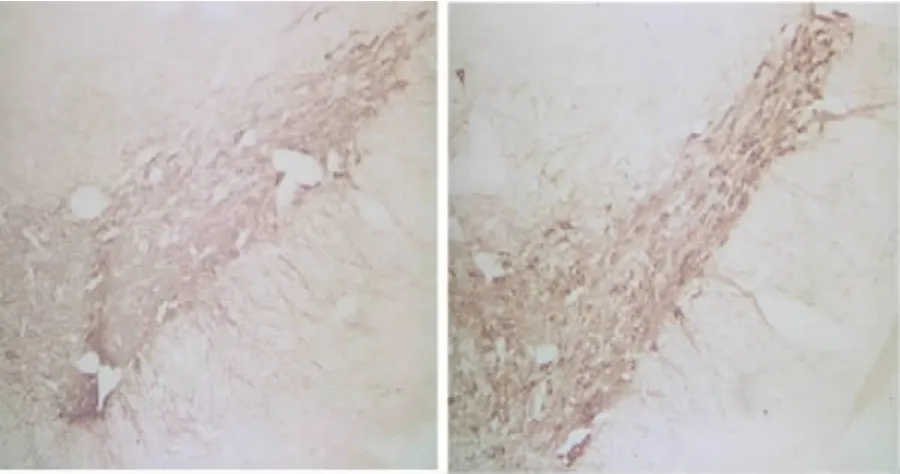
图3 PM组、LM组同侧黑质处TH免疫组织化学染色

图4 PM组、LM组同侧黑质处CB免疫组织化学染色

图5 LM组、PM组同侧黑质TH、CB蛋白表达的比较
3 讨论
多巴胺能神经细胞的变性是PD发病的中心环节,PD病因、发病机制复杂,目前尚不完全明确。因此,建立稳定的模拟人类PD病理、生化、行为学改变的PD动物模型,有助于其发病机制、病理过程、干预治疗的研究。MPTP对多巴胺能系统的损害具有高度选择性,其制备模型的可行性及机制本课题已有报道[3]。本研究发现,小鼠在 MPTP注射后 3~5min出现竖毛、竖尾、弓背、运动减少、步态不稳、下颌和肢体以及尾部震颤等急性反应,1h内行为学改变较明显,24h后完全恢复。随用药次数增加,急性反应减轻,而24h后运动减少、肢体僵硬、步态不稳、反应迟缓等运动障碍程度增加,症状持续时间延长。竖毛、竖尾可能与体内儿茶酚胺如去甲肾上腺素与5-羟色胺变化相关;震颤可能与残存DA能神经元的多巴胺转换率及突触后受体的暂时代偿性改变相关。
自主活动计数、滚轴实验、游泳实验是目前 PD小鼠行为学检测最常用的方法,能相对准确地反映其运动减少、迟缓、协调性等行为学改变。TH主要存在于黑质多巴胺能神经元内,是DA合成的关键酶和DA能神经元的标志酶。而含CB的DA能神经元主要存在于黑质致密部,尤其背外侧部,具有抗变性作用,能够保持胞内钙稳态,发挥细胞保护作用[1,4,5]。本研究证实:小鼠 PD 模型行为学变化与TH、CB神经元前后形态学改变、表达含量的变化密切相关,具有一致性[6]。LiCl能改善MPTP所致小鼠PD模型的行为学障碍;LiCl对DA神经元保护作用,表现为促进TH与CB表达,促进轴突生长、细胞分化,维持多巴胺能神经元的存活[7];抑制MPTP的神经毒性;提高神经元的抗损伤能力,改善神经元的可塑性与自我保护功能;促进残存的DA能神经元合成及释放能力;增加DA神经递质含量、更新率、TH活性,增加DA受体敏感性和受体数目;促进星形胶质细胞的增生,抑制小胶质细胞的激活;阻断脂质过氧化与超氧阴离子自由基的产生;促进BDNF的分泌,通过 BDNF-TrkB 途径保护 DA 神经元[8,9];增加 Bcl-2/Bax的表达[10];激活蛋白激酶C(PKC)、腺苷酸环化酶(AC)、G-蛋白(Gs-蛋白)、MAPK/ERK激酶及在激活PI3K/Akt信号转导通路的同时通过其间的“cross talk”激活NF-kB两条通路发挥多途径、多环节、多靶位协同作用,防止DA能神经元的变性凋亡,发挥保护作用[11~13]。
[1]袁红花,袁凤刚,高殿帅,等.钙结合蛋白-D28K对脑内DA能神经细胞的保护作用[J].山东大学学报(医学版),2011,49(3):22 -26.
[2]肖成华,王炎强,刘洪梅,等.氯化锂对PD小鼠黑质DA能神经元保护作用的实验研究[J].中风与神经疾病杂志,2006,23(6):652-654.
[3]王炎强,刘洪梅,王红军,等.经纹状体注射GDNF对帕金森病模型小鼠黑质DA能神经元保护作用的实验研究[J].徐州医学院学报,2006,26(1):4 -8.
[4]Ng MC,Iacopino AM,Quintero EM,et al.The neurotoxin MPTP increase calbindin-D28k levels in mouse midbrain dopaminergic neurons[J].Mol Brain Res,1996,36:329 - 336.
[5]Meyer M,Zimmer J,Seiler RW,et al.GDNF increases the density of cells containing calbindin but not of cells containing calretinin in cultured rat and human fetal nigral tissue[J].Cell Transplant,1999,8:25-36.
[6]Goldberg NR,Haack AK,Lim NS,et al.Dopaminergic and behavioral correlates of progressive lesioning of the nigrostriatal pathway with MPTP[J].Neuroscience,2011,28(180):256 - 271.
[7]Senatorov VV,Ren M,Kanai H,et al.Short-term lithium treatment promotes neuronal survival and proliferation in rat striatum infused with quinolinic acid,an excitotoxic model of Huntington 's disease[J].Mol Psychiatry,2004,9(4):371 - 385.
[8]Fukumoto T,Morinobu S,Okamoto Y,et al.Chronic lithium treatment increases the expression of BDNF in the rat brain[J].Pharmacology(Berl),2001,158(1):100 -106.
[9]Baydyuk M,Nguyen MT,Xu B,et al.Chronic deprivation of TrkB signaling leads to selective late-onset nigrostriatal dopaminergic degeneration[J].Exp Neurol,2011,228(1):118 - 125.
[10]Youdim MB,Zarraf W.Prevention of MPTP dopaminergic neurotoxicit y in mice by chronic lithium:involvements of Bcl-2 and Bax[ J].Neuropharma,2004,46(8):1130 -1140.
[11]King TD,Bijur GN,Jope RS,et al.Caspase-3 activation induced by inhibition of mitochondrial complex I is facilitated by glycogen synthase kinase-3beta and attenuated by lithium[J].Brain Res,2001,919(1):106-114.
[12]Maet R,Borowicz KK.Role of nuclear factor kB in the central nervous[M].Pharmacol Rep,2007,59:25 -33.
[13]Wang HJ,Cao JP,Yu JK,et al.Calbindin-D28K expression induced by glial cell line-derived neurotrophic factor in substantia nigra neurons dependent on PI3K/Akt/NF-B signaling pathway[J].Eur J Pharmacol,2008,595(1 ~3):7 -12.
