鸭副粘病毒与H9亚型禽流感病毒双重PCR检测方法的初步建立
2011-08-08刘宇卓魏雪涛张敬峰
刘宇卓,魏雪涛,李 银,张敬峰
(1.江苏省农业科学院兽医研究所,南京 210014;2.农业部兽用生物制品工程技术重点实验室,南京 210014;3.国家兽用生物制品工程技术研究中心,南京 210014)
禽流感(Avian influenza,AI)是由A型禽流感病毒(Avian influenza virus,AIV)所引起的禽类疾病[1],是一种严重威胁全世界养禽业的重要疾病。1994年我国学者陈伯伦从发病蛋鸡分离到H9N2亚型AIV。此后,H9N2亚型AIV在我国被广泛报道,多呈低致病性感染,并呈逐渐蔓延之势。鸭、鹅等水禽一直被认为是AIV巨大的基因储存库,其充当着流感病毒由野生水禽到陆生禽类传播过程中间媒介的作用。但近年来,H9N2亚型禽流感对水禽感染毒性增强[2-4]。新城疫病毒(Newcastle disease virus,NDV)是一种严重危害养禽业的重要传染病病原之一,该病毒为禽副粘病毒科副粘病毒属病毒,给全球养禽业造成严重经济损失。过去一般认为水禽(如鹅、鸭等)对NDV的易感性较差,多呈隐性感染。而自20世纪90年代以来,国内外愈来愈多的报道显示NDV对水禽的致病力逐渐增强,鹅、鸭等水禽已成为易感禽类[5-7]。鸭的副粘病毒病和鸭的H9亚型禽流感感染在临床表现及剖检症状上有很多相似的地方,给临床诊断带来很多困扰,严重影响疫病的诊治和预防,因此,本文探索对这两种病原进行双重PCR检测,一次性对两种病原进行检测,缩短临床诊断时间,提高敏感性及特异性,同时亦可用于鉴别诊断。
1 材料与方法
1.1 病毒
鸡源H9亚型禽流感病毒(AIV H9)、鸭副粘病毒(DPV)、鸡新城疫病毒(NDV)、鸭源H9亚型禽流感病毒(AIV H9)、雏鸭病毒性肝炎病毒(DHV)、鸡传染性支气管炎病毒(IBVP)、鸡传染性法氏囊病毒(IBDV)均为江苏省农科院兽医研究所家禽重大疫病防控项目组保存。
1.2 试剂
PCR试剂盒、pMD18-T载体、常用工具酶以及凝胶回收试剂盒等购自TaKaRa公司;LB培养基、Trizol抽提试剂、焦碳酸二乙酯(DEPC)购自Invotrizen公司;氨苄青霉素为Promaga公司产品;其他试剂均为国产分析纯。
1.3 引物的设计与合成
根据GenBank已发表的两种病毒基因序列,选择核苷酸保守序列,利用primer6.0分析软件,设计了2对特异性引物,由TaKaRa公司合成。
1.4 双重RT-PCR检测方法的建立
1.4.1 RNA的提取
取已知H9亚型AIV和DPV两种病毒混合尿囊液,同时分别以两种病毒作为阳性对照,10 000 r·min-1离心30 min,取上清液每管依次加入Trizol 800 μL,振荡混匀,室温放置10 min,加入氯仿200 μL,剧烈振荡后,室温放置1 min,4℃12 000 r·min-1,离心 15 min,取上层水相 750 μL,加入500 μL异丙醇,混匀,-20℃放置15 min,4℃10 000 r·min-1离心1 min,去上清,缓缓加入75%乙醇1 mL洗涤,4℃ 8 000 r·min-1离心5 min,去上清,室温干燥20 min,加入DEPC水10 μL,使充分溶解。
1.4.2 双重RT-PCR
1.4.2.1 反转录 (RT)
5×AMV Buffer 4 μL、10 mmol·L-1dNTPs 2 μL、两对反转录引物各1 μL、RNA酶抑制剂0.5 μL、RNA 模 板 10 μL,AMV 反 转 录 酶 0.5 μL,H2O(DEPC 处理)1 μL,总体积为 20 μL,瞬间离心混匀,65℃反应15 min,42℃孵育1 h,95℃5 min,同时设立阴性、阳性对照,产物置-20℃保存备用。
1.4.2.2 PCR
按25 μL体系进行。在PCR反应管中分别加入:含 MgCl2(25 mmol·L-1)1.5 μL,灭菌水 14 μL,反转录产物 4 μL,10×EX TaqDNA聚合酶buffer 2.5 μL,10 mmol·L-1dNTPs 0.5 μL,两种上、下游引物 50 pmol·μL-1各 0.5 μL,EX TaqDNA 聚合酶0.5 μL。94℃ 3 min,然后进入循环 94℃ 30 s,54℃ 30 s,72℃ 30 s,30循环,于72℃延伸10 min,4℃保存。将PCR反应产物于1.2%琼脂糖凝胶进行电泳,电压为120 V,时间30 min,紫外灯下观察结果,并进行拍照。
1.4.3 PCR产物序列测定和分析
切割回收目的片段,然后按凝胶回收试剂盒说明书所示方法纯化回收PCR产物。按pMD18-TVector说明加入连接体系,转化大肠杆菌DH5α感受态细胞,挑选单菌落,用碱裂解法抽提质粒DNA进行PCR鉴定,阳性克隆菌由南京基天生物技术公司进行测序,并对基因序列用DNAstar软件对测序结果进行拼接和分析。
1.5 双重RT-PCR特异性试验
取RNA病毒DHV、IBV、IBDV尿囊液,同时取H9亚型AIV、DPV及其混合物作为阳性对照,灭菌水作为空白对照,按上述方法提取RNA,用两对特异性引物进行双重RT-PCR,对PCR产物进行电泳观察结果。
1.6 双重RT-PCR敏感性试验
取含H9亚型AIV及含DPV的尿囊液,分别测定病毒液的鸡红细胞凝集价(HA),以相同的HA价为基础,分别10倍倍比稀释,取10-1、10-2、10-3、10-4、10-5、10-6、10-7,并测定对应浓度下 RNA 含量,将相同的稀释度混合为一个样品,提取RNA,并用建立的双重RT-PCR方法对上述各定量样品进行测定,比较检测血凝效价为0的样品及最低稀释度毒液的RNA浓度,研究双重RT-PCR方法的敏感性,同时与HA方法进行比较。
1.7 双重RT-PCR稳定性研究及应用
1.7.1 待检样品
取-20℃保存不同时间NDV及H9亚型禽流感病毒尿囊液;取病死或攻毒后死亡鸭,采集鸭肺脏、脾脏、肝脏等组织;用棉拭子采集攻毒后存活鸭喉头分泌物,置30%甘油生理盐水中,-20℃保存备用。
1.7.2 待检样品处理
取-20℃保存2、4和12个月的ND及H9亚型禽流感病毒尿囊液,冻融2次;取待检病料置无菌研钵中剪碎并研磨,按1∶3加入灭菌生理盐水,将保存的喉拭子充分捻动、挤干后弃去拭子。均4℃ 12 000 r·min-1,离心10 min,取上清。
1.7.3 双重RT-PCR
取上述待检材料,分别提取RNA,并按已建立的方法进行双重RT-PCR检测。
2 结果与分析
2.1 双重RT-PCR的建立
2.1.1 双重RT-PCR的反应条件优化
按方法中条件进行RT-PCR。将PCR反应产物于1.2%琼脂糖凝胶进行电泳,电压为120 V,时间30 min,紫外灯下观察结果,并进行拍照。试验结果如图1所示。由PCR产物的电泳图可知,一次性扩增出两条目的条带:大小为732 bp的H9亚型AIV,大小为363 bp的DPV,均与预期目的条带相符。
2.1.2 目的片段的克隆和测序
切取目的片段进行胶回收,克隆、转化后进行阳性质粒筛选、测序。测序结果与GenBank上公布的两种病毒的序列进行比较,同源性达96%~99%。
2.2 双重RT-PCR特异性试验
RT-PCR产物电泳结果见图2。由图2可知:用已建立的双重RT-PCR方法,不但AIV H9与DPV混合液出现两条特异性条带,AIV H9与DPV均在相对应位置出现特异性条带,而其他病毒及空白对照均未出现条带,表明该方法具有特异性。
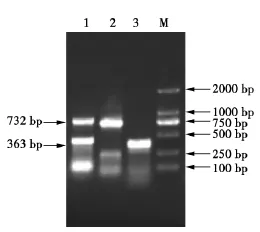
图1 双重RT-PCR方法的建立Fig.1 Duplex RT-PCR amplification of two virus gene
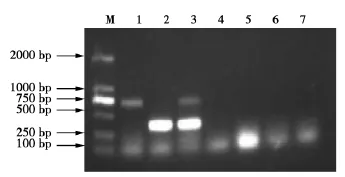
图2 双重RT-PCR特异性试验Fig.2 Specificity test of duplex RT-PCR products
2.3 双重RT-PCR敏感性试验
取H9亚型AIV、DPV,以相同的血凝价为基础,10倍倍比稀释至10-7,分别提取RNA,并检测血凝效价为0的样品的RNA浓度,分别进行RT-PCR。试验结果显示,稀释到10-4的病毒液的HA效价为0,而用RT-PCR方法,无论其中一种病毒检测还是混合病毒检测均可以检出稀释到10-5的病毒液(见图3)。说明该方法敏感性高于常规的HA检测方法100倍以上。经测定10-5病毒液的RNA浓度为2 ng·μL-1,因此该方法可检测的最小病毒核酸量为 2 ng·μL-1。
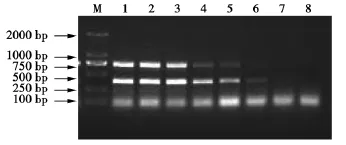
图3 双重RT-PCR敏感性试验Fig.3 Sensitivity test of duplex RT-PCR products
2.4 双重RT-PCR的稳定性及应用
取-20℃保存2、4和12个月的阳性NDV、DPV及不同H9亚型AIV尿囊液,提取RNA并进行双重RT-PCR,均能扩增出特异性条带。
对临床疑似病例及攻毒死亡禽组织进行双重RT-PCR方法检测,同时采用鸡胚分离方法进行对比,阳性符合率达100%。
3 讨论与结论
1966年Hommee和Esterday第一次在美国威斯康辛的火鸡中分离到H9亚型禽流感病毒[8-9],此后该亚型病毒不断的在鸡群尤其是火鸡群中流行。进入90年代,H9亚型禽流感病毒呈广泛流行趋势,危害日趋严重。1995~1999年,在德国及意大利、爱尔兰、南非、美国、韩国等多个国家的多种禽类中均有发生[10]。1994年国内由陈伯伦等首次分离到H9N2亚型禽流感病毒[11]。之后的几年里,H9N2亚型禽流感在我国家禽中广泛流行,危害日趋严重。据统计,1996~2000年间,我国H9N2型禽流感占感染鸡群的93.89%,成为影响养禽业的主要病害。
H9N2亚型禽流感病毒还可感染人,具有重要的公共卫生意义。1999年,Peiris等在香港分离到了人源H9N2亚型流感分离株(A/HK/1073/99)[12],同年郭元吉等人对深圳人群作流感的血清学监测,从19%的人体中分离到H9N2亚型流感病毒[13]。因此,开展针对H9亚型禽流感病毒的快速诊断及相关研究显得尤为重要。
PCR是一种高度特异、灵敏的方法,在疾病的诊断上有着较为广泛的应用。因所设计合成的引物具有针对性,其反应具有特异性、敏感性、稳定性的特点,检测效率远远高于实验室传统的一些常规检测方法。随着PCR实验室技术的日益成熟而越来越受到欢迎,已被广泛地应用于检测、诊断和流行病学调查等方面。本检测方法的建立是基于DPV及H9亚型AIV两种病毒的RT-PCR检测方法[6,14],利用一次PCR,对两种流行病混合感染进行诊断,也可以用于检测其中的某一种病毒。本研究所建立的双重RT-PCR方法,由试验结果可知其敏感性良好,对两种病毒的最低检测含量均为2 ng·μL-1,是血凝试验的100倍。同时该方法具有较强的特异性,可以特异性地检测出DPV、H9亚型AIV或同时检出此两种病毒,却不能检出DHV、IBDV、IBV等。
本试验从含毒尿囊液、发病死亡禽组织脏器中提取总RNA,进行双重RT-PCR检测,与用鸡胚分离病毒结果相符,而采集攻毒后喉拭子进行PCR检测与鸡胚分离比较结果却不理想,较鸡胚分离阳性结果相去甚远。分析原因,可能是拭子中病毒的含量极低,用鸡胚分离,通过数天的增殖可逐渐地达到一定的病毒量,而PCR方法需要一定的起始病毒量作为模板。因此,条件允许的情况下,可以采用双重RT-PCR方法检测经鸡胚分离培养的尿囊液及发病死亡家禽的组织脏器的病毒核酸,从而进行诊断。由于鸭副粘病毒及H9亚型禽流感病毒均具有血凝特性,因此采用该方法不仅操作简便、特异性强,而且对鉴别诊断具有极高的应用价值。
[1] 于康震,崔尚金,付朝阳,等.禽流感与养禽业发展和人类健康[J].中国预防兽医学报,2000,22(4):73-76.
[2] 刘秀梵.家养水禽在我国高致病性性禽流感流行中的作用[J].中国家禽,2004,26(12):4-8.
[3] 傅光华,程龙飞,施少华,等.产蛋异常蛋鸭H9N2亚型禽流感病毒的分离鉴定[J].中国农学通报,2009,25(22):21-24.
[4] 万春和,傅光华,程龙飞,等.禽流感病毒全基因测序及遗传进化分析[J].农业生物技术学报,2009,17(5):750-757.
[5] 黄瑜,李文杨,程龙飞,等.番鸭副黏病毒1型的分离鉴定[J].中国预防兽医学报,2005,27(2):148-150.
[6] 崔华敏,陈立功,董兵,等.鸭源新城疫病毒分离株的生物学特性鉴定[J].中国家禽,2007,29(21):24-26.
[7] 李建侠,刁有祥,刘霞,等.鸭副粘病毒病RT-PCR诊断方法的建立与应用[J].西北农林科技大学学报:自然科学版,2010,38(11):31-35.
[8] Homme P J.B C Easterday Avian influenza virus infectious.I.charaterization of influenza a/Turkey/Wisconsin/1966 virus[J].Avian Disease,1970,14:66-74.
[9] Nobusawa,E,Aoyama,et al.Comparison of complete amino acid sequences and receptor-binding[J].Virology,1991,182(2):475-485.
[10] Alexander D J.A review of avian influenza in different bird species[J].Veterinary Microbiology,2000,74(1-2):3-13.
[11] 陈伯伦,张泽纪,陈伟斌.禽流感研究I.鸡A型禽流感病毒的分离与血清学初步鉴定[J].国兽医杂志,1994,20(10):3-5.
[12] Peiris M,Yuen K Y,Leung C W,et al.Human infection with influenza H9N2[J].Lancet,1999,354:916-917.
[13] 郭元吉,李建国,程小雯,等.禽H9N2亚型流感病毒能感染人的发现[J].中华实验和临床病毒学杂志,1999,13(2):5-8.
[14] 齐岩,袁润余,张贺楠,等.H9N2亚型禽流感病毒广东分离株的全基因克隆及序列分析[J].病毒学报,2010,26(3):176-182.
