传染性造血组织坏死病毒糖蛋白基因的原核表达及抗原性分析
2011-07-12赵永欣赵丽丽刘巍巍王健楠李一经乔薪瑗葛俊伟
赵永欣,赵丽丽,刘巍巍,王健楠,李一经,乔薪瑗,葛俊伟,刘 敏*
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.东北农业大学动物医学学院,哈尔滨 150030)
传染性造血组织坏死病(Infectious hematopoietic necrosis,IHN)是鲑、鳟鱼类一种严重的传染性疾病。随着水生动物及其产品进出口贸易,世界范围内的传染性造血组织坏死病急剧增加,已有报道在日本、韩国、中国、欧洲等地区检测到该病病毒[1-2]。本实验室从黑龙江省某渔场病鱼组织内分离得到传染性造血组织坏死病毒IHNV-ZYX株(GenBank编号HM099906),病鱼的症状为体色发黑,眼球突出,腹部膨大,鳍基充血,腹鳍基部的骨胳肌中有“V”形出血斑块,经解剖可观察到,鱼的鳃丝褪色呈苍白色,肝、脾、肾褪色。
传染性造血组织坏死病病毒为传染性造血组织坏死病的病原体,属弹状病毒科(Rhabdoviridae)诺拉弹状病毒属(Novirhabdovirus),呈子弹状,基因组为不分节段的单股负链RNA[3-4]。此病毒具有囊膜,其囊膜蛋白(G)是糖基化蛋白,N端具有一段疏水性的信号肽,在内质网中被切除后成为成熟的糖蛋白,糖基化是病毒颗粒在成熟过程中由宿主细胞内分泌到细胞外所必需的[5]。G蛋白在膜融合及决定病毒毒力方面起着重要作用,还是病毒的主要抗原,可以诱导产生中和抗体[6],刺激细胞免疫[7]。
本试验将IHNV-ZYX株全长的G基因(1 527 bp)进行了原核表达,制备了抗G蛋白血清,分析了IHNV G蛋白的抗原性,为进一步研究IHNV G基因的免疫保护作用及诊断试剂和基因工程疫苗的研制奠定物质基础。
1 材料与方法
1.1 主要材料和试剂
毒株、菌株与质粒:IHNV-ZYX株为本实验室分离,CHSE-214细胞由深圳出入境检验检疫局江育林教授惠赠,Rosetta(DE3)菌株、pET-30b载体由本实验室保存。
主要试剂:限制性内切酶(购自TaKaRa公司);T4DNA连接酶(购自NEB公司);HRP标记的山羊抗兔IgG、兔抗山羊IgG(购自Sigma公司);山羊抗IHNV阳性血清由深圳检疫局刘荭馈赠。
1.2 方法
1.2.1 引物设计
根据GenBank登录的IHNV基因序列(L40883),设计两对引物:G基因(1 527 bp)上游引物:Gu 5′GGATCCGATGGACACCATGATCACCAC 3′含有BamHⅠ酶切位点,下游引物:Gl 5′CTCGAGGGAC CGGTTTGCCAGGTGATA 3′含XhoⅠ酶切位点。由上海生物工程有限公司合成。
1.2.2 重组表达质粒pET30b-G的构建
将用CHSE-214细胞繁殖的IHNV-ZYX株病毒,经Trizol裂解后,以氯仿、异丙醇抽提病毒总RNA,RT-PCR方法分别扩增得到G基因片段。将G基因PCR产物分别与pMD18-T连接,转化JM109感受态细胞,提取质粒,经酶切鉴定筛选阳性克隆、测序。获得阳性重组质粒后用BamHⅠ、XhoⅠ双酶切,纯化后连接到经同样双酶切纯化的pET-30b载体,构建重组表达质粒pET30b-G。
1.2.3 重组蛋白的诱导表达及鉴定
将 pET30b-G转化大肠杆菌Rosetta(DE3)感受态细胞,37℃振荡培养至OD600值达0.6时,经IPTG诱导进行表达。表达产物进行SDS-PAGE分析。
1.2.4 抗体的制备
将 pET30b-G/Rosetta(DE3)重组菌诱导后提取包涵体,经SDS-PAGE分离目的片段,将凝胶在0.25 mol·L-1KCl溶液中染色,切下目的胶条并碾碎,加入少量的PBS后反复冻融3次,离心取上清并测得G蛋白浓度为3.95 mg·mL-1。以处理后的G蛋白加弗氏佐剂,按参考文献[8]介绍的方法分3次免疫新西兰兔,三免后第7天心脏采血,分离血清,-80℃保存。
1.2.5 抗体效价的检测及抗原性分析
用重组G蛋白包被ELISA板,兔抗G蛋白血清和兔阴性血清为一抗,HRP标记的山羊抗兔IgG作为二抗,OPD显色。结果判定:当P/N=(阳性血清OD490的值-空白孔OD490的值)/(阴性血清OD490的值-空白孔OD490的值)>2时,阳性血清的最大稀释度即为血清抗体效价。同时用感染IHNV的细胞培养物包被ELISA板,用同样的方法测定G蛋白抗血清与病毒的反应性。
将诱导后的G蛋白进行SDS-PAGE电泳并转膜,以山羊抗IHNV阳性血清为一抗,HRP标记的兔抗山羊IgG为二抗,进行Western-blot分析。
2 结果与分析
2.1 目的基因扩增及重组表达质粒pET30b-G的构建
以IHNV-ZYX株cDNA为模板,通过PCR扩增,获得扩增片段G基因约为1 527 bp,与预期大小相符。测序结果表明通过RT-PCR方法成功地扩增了G目的基因。用Bam HⅠ和XhoⅠ双酶切pET30b-G质粒,分别得到约5 400和1 527 bp的片段,酶切鉴定与预期相符(见图1)。
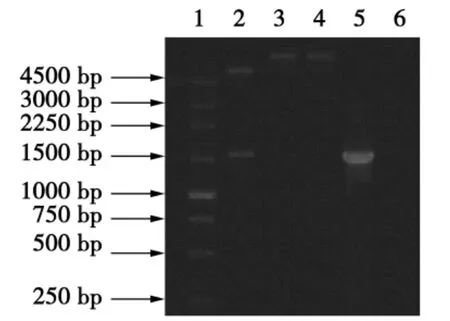
图1 重组质粒pET30b-G酶切PCR鉴定结果Fig.1 Restriction map of pET30b-G
2.2 重组蛋白的诱导表达
结果见图 2。重组菌 pET30b-G/Rosetta(DE3)诱导后在约52 ku处出现蛋白条带,与预期重组蛋白分子质量一致。且一定范围内随着诱导时间的延长,表达量逐渐增多,在诱导4 h时表达量最大。超声波处理诱导后菌体,经SDS-PAGE分析,菌体在沉淀中有目的蛋白,可知此蛋白以包涵体形式存在。

图2 重组菌pET30b-G/Rosetta(DE3)表达蛋白SDSPAGE鉴定结果Fig.2 SDS-PAGE profile of pET30b-G/Rosetta(DE3)expressed protein
2.3 抗血清效价的测定
将本试验制备的兔抗G蛋白血清作为阳性血清,免疫接种前兔血清作为阴性血清,重组G作为抗原,进行间接ELISA试验。结果表明抗血清与相应的抗原有较强的反应性,满足P/N>2时,血清的最大稀释度分别为1∶25 600,即为制备的兔抗G蛋白血清效价(见表1)。

表1 间接ELISA检测G蛋白结果Table 1 Indirect ELISA result of inspection
2.4 G蛋白免疫原性的检测
用感染IHNV-ZYX株的细胞培养物包被ELISA板,与兔抗G蛋白的免疫血清进行试验,结果见图3。
从结果可知,抗G蛋白的兔血清稀释度为1∶1 600时,P/N仍大于2。说明制备的抗血清与全病毒抗原发生较强的特异性反应,抗G蛋白的免疫血清能够识别IHNV抗原,G蛋白具有良好的免疫原性。
重组G蛋白经SDS-PAGE转印到NC膜上,山羊抗IHNV血清1∶1 000稀释作为一抗,HRP兔抗山羊IgG1∶2 000稀释作为二抗,Western-blotting结果见图4。诱导后的G菌体蛋白在52 ku处出现了明显的特异性条带,而未经诱导的菌体蛋白无条带产生。Western-blotting结果表明,重组G蛋白可被山羊抗IHNV血清识别,G蛋白具有良好的反应原性。以上两项结果说明,表达的G蛋白与天然的IHNV G蛋一样具有相同的抗原性。
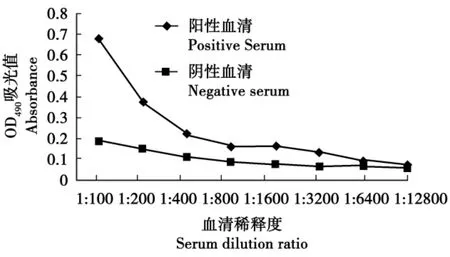
图3 间接ELISA检测抗G蛋白兔血清效价结果Fig.3 Result of G protein infected rabbit

图4 表达目的蛋白的Western-blotting检测Fig.4 Identification of expressed protein by Westernblotting
3 讨论与结论
G蛋白是传染性造血组织坏死病毒的主要抗原,可诱导动物机体产生特异性的免疫应答,还可以作为研究IHNV免疫保护的抗原基因,因此通常选择G基因作为抗原基因来构建DNA疫苗[7]。有报道指出肌肉注射G蛋白表达质粒可诱导机体产生高水平免疫率[9-11]。Lorezen等构建了IHNV病毒G蛋白基因的DNA疫苗[12-13],能够诱导虹鳟产生75%的较高水平的免疫保护率。Kim等认为该病毒G蛋白一个氨基酸的改变会影响病毒的毒力和致病性[14]。因此,G蛋白在传染性造血组织坏死病毒基因工程疫苗和诊断技术等方面的研究中是重要的靶蛋白。目前国内对此研究较少,2009年郭露玲等对其进行了原核表达但并未分析该蛋白的功能特性[15],本研究的病毒株IHNV-ZYX为本实验室获得的分离株,更深一步地对其功能进行研究是很有必要的。
本试验获得分离株IHNV-ZYX G基因全长cDNA序列,而且成功构建了表达IHNV G蛋白大肠杆菌载体系统,可以在IPTG的诱导下大量表达G蛋白,纯化后制备了高效价的抗血清,兔抗G蛋白的血清可与IHNV特异反应,表明G蛋白具有良好的免疫原性。同时,本试验制备的G蛋白可被山羊抗IHNV阳性血清识别,反应条带单一,说明表达的G蛋白也具有良好的反应原性。本试验的结果表明,以原核表达系统表达的G蛋白可以作为检测抗原,完全可以代替全病毒制备抗原进行病毒繁殖,病毒纯化等繁琐工艺,这对于IHNV在细胞上繁殖周期长,繁殖IHNV的细胞培养难度大具有更重要的现实意义。因此,G蛋白可作为IHNV的诊断抗原,为建立诊断检测方法,流行病学调查等研究奠定了基础。
分离株IHNV-ZYX G基因全长cDNA序列的获得为研究分离株的免疫学特性及对其编码的G基因结构与功能的深入研究奠定基础,分离株G蛋白具有良好的免疫原性也为IHNV的免疫预防提供重要的理论基础。
[1]ArkushKD,BovoG,De Kinkelin P,et al.Biochemical and antigenic properties of the first isolates of IHNV from salmonid fish in Europe[J].Aquat An Health,1989(1):148-153.
[2]Lapatra S E.The use of serological techniques for virus surveillance andcertification of finfish[J].Annual Review of Fish Diseases,1996,(6):15-28.
[3]吴金炉,曾志南.鱼类病毒病与鱼类病毒疫苗[J].海洋科学,1999(4):37-42.
[4]WolfK.Fishvirusesandfishviraldisease[M].[S.L.]CornellUniversity Press,1989:476-493.
[5]Leavitt R,Schlesinger S,Kornfeld S.Tunicamycin inhibits glycosylation and multiplication of Sindbis and vesicular stomatitis viruses[J].Virology,1977,21(1):375-385.
[6]Boudinot P,Blanco M,de Kinkelin P,et al.Combined DNA immunization with the glycoprotein gene of viral hemorrhagic septicemia virus and infectious hematopoietic necrosis virus induces double-specific protective immunity and nonspecific response in rainbow trout[J].Virology,1998,249(2):297-306.
[7]Corbeil S,Lapatra S E,Anderson E D,et al.Evaluation of the protective immunogenicity of the N,P,M,NV and G proteins of infectious hematopoietic necrosis virus in rainbow trout oncorhynchus mykiss using DNA vaccines[J].Diseases of Aquatic Organisms,1999,39(1):29-36.
[8]郭鑫.动物免疫学实验教程[M].北京:中国农业大学出版社,2007.
[9]Corbeil S,Lapatra S E,Anderson E D,et al.Nanogram quantities of a DNA vaccine protect rainbow trout fry against heterologous strains of infectious hematopoietic necrosis virus[J].Vaccine,2000,18(25):2817-2824.
[10]Garver K A,Conway C M,Elliott D G,et al.Analysis of DNA-vaccinated fish reveals viral antigen in muscle,kidney and thymus,and transient histopathologic changes[J].Marine Biotechnology,2005,7(5):540-553.
[11]Garver K A,Conway C M,Kurath G.Introduction of translation stop codons into the viral glycoprotein gene in a fish DNA vaccine eliminates induction of protective immunity[J].Marine Biotechnology,2006,8(4):351-356.
[12]Lapatra S E,Corbeil S,Jones G R,et al.Protection of rainbow trout against infectious hematopoietic necrosis virus four days after specific or semi-specific DNA vaccination[J].Vaccine,2001,19(28-29):4011-4019.
[13]Lorenzen N,Lorenzen E,Einer-Jensen K,et al.DNA vaccines as a tool for analysing the protective immune response against rhabdoviruses in rainbow trout[J].Fish&Shellfish Immunology,2002,12(5):439-453.
[14]Kim C H,Winton J R,Leong J C.Neutralization-resistant variants ofIHNVhavealteredvirulenceandtissuetropism[J].Virology,1994,68(5):8447-8453.
[15]郭露玲,刘海滨,石剑,等.传染性造血组织坏死症病毒囊膜蛋白在原核细胞中的表达[J].华中农业大学学报,2009,28(2):210-213.
