6株旋毛虫49 ku ES抗原基因克隆及序列分析
2011-08-01路义鑫韩彩霞李晓云董晓波宋铭忻
路义鑫,韩彩霞,李晓云,董晓波,宋铭忻
(东北农业大学动物医学学院,哈尔滨 150030)
旋毛虫病(Trichinellosis)是一种重要的人兽共患寄生虫病,主要因生食或半生食含旋毛虫幼虫的肉类所致。该病的流行不但对畜牧业、食品业及外贸出口造成了重大经济损失,而且对人类健康构成威胁[1-2]。
旋毛虫的抗原成分复杂,目前的研究热点主要集中在排泄分泌(Excretory-secretory,ES)抗原。ES抗原中,主要的特异性蛋白成分有3种,分子质量分别为45、49和53 ku,占ES总量的50%以上[3-4]。但在旋毛虫ES抗原的研究中,几乎所有学者都关注于T.spiralis(旋毛形线虫),而对旋毛虫属其他种及基因型旋毛虫研究甚少。不同种旋毛虫在形态学、生物化学及免疫学等方面都存在差异[5-6],那么在遗传基因上包括编码ES蛋白的基因序列是否存在差异,进而可能在抗原性上也存在一定的差异呢?该基因能否作为分子标记进行分类学研究?为解决这些问题,本试验以不同来源的6个旋毛虫株为研究对象,克隆了不同种株旋毛虫49 ku ES抗原基因并进行序列比较分析,为该基因用于旋毛虫病的免疫防治奠定了基础。
1 材料与方法
1.1 虫种
试验用各旋毛虫株均为东北农业大学寄生虫学教研室提供的由昆明小鼠传代保种的虫体,详见表1。

表1 剂量选择与分组Table 1 Dose selection and group
将6株不同来源旋毛虫(ISS3、ISS10、HC、HH、SW、MP)肌幼虫,分别经口感染5只成年健康昆明小鼠,感染剂量为每只小鼠200条活幼虫,于感染40 d后将含旋毛虫肌幼虫的小鼠剖杀。人工胃液消化法收集虫体,用蒸馏水反复洗涤干净,备用。
1.2 主要试剂
胃蛋白酶(购自上海长城生化制药厂);DEPC(购自Sigma公司);Trizol(购自Invitrogen公司);DNA Marker、Taq DNA聚合酶、反转录酶、dNTP、Rnase等均(购自大连宝生物工程有限公司);小量胶回收试剂盒(购自上海华舜生物工程有限公司);小量质粒提取试剂盒(购自北京博大泰克生物技术有限公司)。
1.3 引物的设计
参考GenBank中T.nativa编码49 ku ES基因序列(序列号AY486427.1),应用Oligo 4软件设计1对引物,UP:5′GC GAA TTC ATG GCT ACT GAT GAT ACA GAA TGG TT 3′,LOW:5′G CGG ATC CTT CTA TTA GCT GTA TGG GC 3′,引物由宝生物工程(大连)有限公司合成。
1.4 旋毛虫总RNA的提取
将约500条DEPC处理水洗涤3次的旋毛虫肌幼虫与Trizol液一起研磨,研碎虫体后移入1.5 mL离心管中,补加Trizol液至800 μL,震荡混合5 min,加入氯仿 200 μL,彻底混匀 2~3 min,12 000 r·min-1离心15 min,取上清并加入500 μL异丙醇,室温放置 15~30 min,12 000 r·min-1离心 15 min,去上清并用滤纸吸干后用75%乙醇洗涤一次,离心并吸出乙醇,滤纸吸干离心管中残液并放入37℃温箱烘干,向管中加DEPC处理水20 μL,放于-70℃冰箱备用。
1.5 RNA反转录和目的基因扩增
首先逆转录合成cDNA链,然后以其为模板扩增目的基因。以20 μL体系进行反转录。取5 μL RNA样品与1 μL下游引物混合,置70℃水浴吸附5 min,迅速冷却后继续加入 5×Buffer 4 μL,DTT 2 μL,RNA 酶抑制剂 1 μL,反转录酶 1 μL,dNTP 2 μL,DEPC 水 4 μL,混匀后,置于 37℃水浴 1~1.5 h,70℃ 5 min(终止)。
取以上反转录产物(即cDNA),以25 μL体系进行 PCR 扩增。cDNA 4 μL,Primer 1 μL(上、下游引物各 0.5 μL),10×Buffer 2.5 μL,dNTP 3 μL,Taq 酶 0.5 μL,ddH2O 14 μL,混匀后置于 PCR 仪中扩增。PCR采用双循环程序。95℃预变性5 min;94℃变性1 min,48℃退火1 min,72℃延伸2 min(20个循环);94℃变性1 min,51℃退火1 min,72℃延伸2 min(25个循环);72℃延伸8 min。
1.6 PCR产物克隆测序
扩增产物在10 g·L-1琼脂糖凝胶上电泳,以DNA分子质量标准初步确定片段大小,在紫外灯下切下目的条带,柱离心小量胶回收试剂盒纯化后,按分子克隆的常规方法将目的片段与载体pMD-18T进行连接、转化,筛选阳性克隆菌测序,并进行序列分析,与GenBank中的相应基因序列进行比对分析。
2 结果与分析
2.1 目的基因RT-PCR扩增
如图1所示,各虫样PCR产物均在凝胶中扩增出目的条带,在泳道2~6可见大小950 bp左右的特异条带,这与预期扩增片段大小相吻合。目的片段与pMD18-T载体重组质粒的PCR鉴定电泳图谱见图2。在泳道3~7重组质粒样品均扩增出长度为950 bp左右的目的条带,与虫体RT-PCR产物大小一致,基本确定为阳性重组质粒。

图1 目的基因的RT-PCR扩增电泳图谱Fig.1 RT-PCR amplification of interest gene
2.2 序列分析
应用DNAstar软件将不同来源的6个旋毛虫株49 ku ES抗原基因核苷酸序列和推导的氨基酸序列与GenBank中的T.spiralis(P49)相应基因序列(序列号M64242.1)进行同源性比较,并比较6个虫株间的同源性。
由表2可知,旋毛形线虫(ISS3)和GenBank中的T.spiralis49 ku ES序列(P49)同源性为99.9%,仅在517位有一个碱基A→G的突变;旋毛形线虫(ISS3)与本地毛形线虫(ISS10)的同源性为97.8%;黑龙江猪株(HH)与ISS3的同源性为97.3%,与ISS10的同源性为99.1%;黑龙江犬株(HC)与ISS10的基因序列完全一样,与ISS3同源性为97.8%;美国猪株(MP)与ISS3和ISS10的同源性分别为97.5%和99.6%;黑龙江猫株(SW)与ISS3和ISS10的同源性分别为97.6%和98.7%。从表2可见,根据旋毛虫49 ku ES基因核苷酸序列推导的氨基酸序列的同源性都稍低于相应的核苷酸序列的同源性,在94.0%~99.7%之间。通过软件DNAstar分析49 ku ES蛋白的抗原性,旋毛虫各种株之间几乎没有差异。
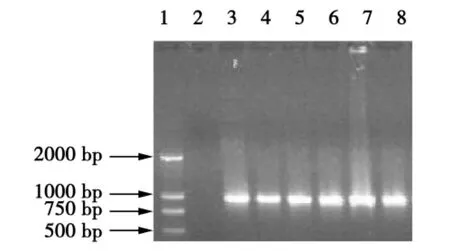
图2 重组质粒的PCR鉴定Fig.2 Identification of recombinant plasmid by PCR
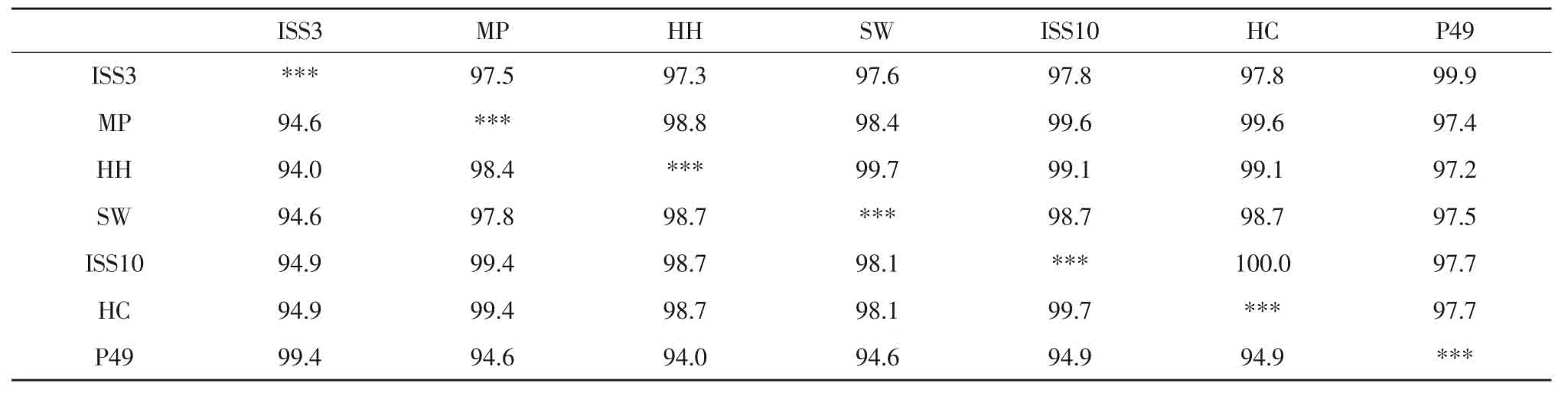
表2 旋毛虫49 ku ES基因序列同源性Table 2 Homology of 49 ku ES sequence of Trichinella spp.
所测得6个旋毛虫株与GenBank中的T.spiralis标准序列P49核苷酸序列同源性高达97.2%~99.9%,不同旋毛虫之间该序列差异很小。应用DNAstar软件构建基因进化树(见图3),可见49 ku ES序列分成2个大的分支,旋毛形线虫(ISS3)与标准序列P49位于同一分支,黑龙江猪、犬、猫和美国猪株似乎都与本地毛形线虫(ISS10)的同源性更高,但是从整体来看,所有虫株间49 ku ES基因序列差异不显著(≤2.8%),最大的差异不超过3%。磁性脂质体处于水相上层,密度比较小,薄膜法制备的磁性脂质体处于水相下层,密度比较大,经过高压均质的脂质体在水相中均匀的分布(见图1)。

图3 6株旋毛虫与GenBank中T.spiralis相应序列构建的基因进化树Fig.3 Phylogenetic tree of 49 ku ES sequence of Trichinella spp.
3 讨论与结论
旋毛虫病是危害严重的人兽共患寄生虫病,该病对人类健康威胁很大,至今仍未得到有效的控制,已被列为再次出现的疾病[1,7]。选择敏感性高,特异性好的诊断与免疫抗原,是旋毛虫病防治具有重要意义。ES抗原(排泄分泌抗原)直接暴露于宿主的免疫系统,是诱导宿主产生免疫应答的主要靶抗原[4,8]。近年来应用DNA重组技术在体外大量表达ES抗原已成为当前研究的热点。
本试验对不同来源的6株旋毛虫编码49 ku ES抗原基因与GenBank中T.spiralis相应序列进行比对分析。从基因系统发生树来看,分为两个进化分支,分别以旋毛形线虫与本地毛形线虫两个国际上公认的虫种为代表,也是我国至今仅发现的两个旋毛虫虫种。除本实验室保种的旋毛形线虫与GenBank已登录的T.spiralis相应序列高度同源,黑龙江猪、犬、猫和美国猪旋毛虫均与本地毛形线虫在同源性上更接近。传统分类上认为我国猪分离株归属于旋毛形线虫,犬分离株归属于本地毛形线虫[9-11],猫分离株的分类地位尚存在争议[9,12-13]。本试验所测序列间虽然存在一定差异,但在整体上看,所有虫株核苷酸和氨基酸序列的同源性分别达97.2%和94.0%以上,序列间差异很小。因此在分类学上,旋毛虫49 ku ES基因具有相当强的保守性,该基因不能较好地区分各旋毛虫种。
根据49 ku ES核苷酸序列推导的氨基酸序列,虽然序列之间存在着差异(≤15个氨基酸),然而可识别的糖基化位点却完全相同,应用DNAstar软件分析编码蛋白二级结构的抗原性,可以看出他们的抗原表位基本相同,不同旋毛虫49 ku ES抗原性几乎没有差异。Western-blot检测结果也基本证明了这一点,本地毛形线虫的49 ku ES重组抗原可以被小鼠T.spiralis和T.nativa阳性血清以及它们的中国地理株的小鼠血清特异性识别[14],说明该基因编码蛋白的抗原性很稳定,只要获得一个虫株的重组49 ku ES蛋白,即可用于其他不同种株旋毛虫病的诊断及预防。研究表明,49 ku ES蛋白仅与旋毛虫阳性血清反应而不与阴性血清反应,同时亦不和其他的寄生虫病血清反应,具有良好的特异性[15-16],应用旋毛虫49 ku ES重组蛋白建立的间接ELISA检测方法,具有较高的特异性和敏感性[17]。
由于49 ku ES排泄分泌抗原是由虫体食道管附近的杆状体细胞分泌,可直接与宿主的免疫系统相互作用,受到宿主免疫机能选择的可能性较大,因此不同旋毛虫种株间的个别基因突变也许是受到不同宿主免疫反应的影响,即使是同种宿主不同个体也会存在差异。可见,虽然旋毛虫在形态、生物化学、不同宿主的繁殖力指数甚至生殖隔离等多方面上都有很大的差异,但是仍能找到不同种株间共同的抗原成分,作为诊断和免疫的良好抗原,对旋毛虫病的防治具有重要的意义。
[1]Dupouy-CametJ.Trichinellosis:Aworldwidezoonosis[J].Veterinary Parasitology,2000,93(3-4):191-200.
[2]Murrell K D,Pozio E.Trichinellosis:the zoonosis that won't go quietly[J].International Journal for Parasitology,2000,30(12-13):1339-1349.
[3]Su X Z,Prestwood A K,Mcgraw R A.Cloning and expression of complementary DNA encoding an antigen ofTrichinella spiralis[J].Molecular and Biochemical Parasitology,1991,45(2):331-336.
[4]马鸣旺,申丽洁.旋毛虫抗原的研究进展[J].中国病原生物学杂志,2008,3(8):631-634.
[5]Lichtenfels J R,Murrell K D,Pilitt P A.Comparison of three subspecies ofTrichinella spiralisby scanning electron microscopy[J].Journal of Parasitology,1983,69(6):1131-1140.
[6]宋铭忻,张桂红,路义鑫.旋毛虫各隔离种嗜酸性粒细胞变化的研究[J].黑龙江畜牧兽医,2000(2):5-6.
[7]Pozio E.World distribution ofTrichinellaspp.infections in animals and humans[J].Veterinary Parasitology,2007,149(1-2):3-21.
[8]Gamble H R,Murrell K D,Marti H P.Inoculation of pigs againstTrichinella spiralis,using larval excretory-secretory antigens[J].American Journal of Veterinary Research,1986,47(11):2396-2399.
[9]诸欣平,刘明远,王凤云,等.用DNA限制性片段长度多态性鉴定中国旋毛虫3个分离株[J].寄生虫与医学昆虫学报,1998,5(2):39-43.
[10]徐克成,刘明远,王嵘,等.中国旋毛虫形态度量学分析[J].中国兽医学报,1998,18(4):52-55.
[11]董晓波,李冬梅,花丽茹,等.旋毛虫各隔离种ITSⅡ区基因克隆和序列分析[J].中国预防兽医学报,2006,28(2):164-166.
[12]刘明远,徐克诚,宋铭忻,等.中国旋毛虫猫分离株SW种类归属的进一步鉴定[J].中国兽医科技,1998,28(7):8-10.
[13]李冬梅,王秀荣,董小波,等.黑龙江省猫旋毛虫18S rRNA基因分子克隆及序列分析[J].中国兽医杂志,2007,43(5):5-7.
[14]郑宝亮,王秀荣,路义鑫,等.本地毛形线虫49 ku ES蛋白结构基因的分子克隆及原核表达[J].中国预防兽学报,2007,29(7):510-514.
[15]阎玉河,马增全,陈辉,等.旋毛虫基因重组抗原对小鼠的免疫保护试验[J].河南农业科学,1995,07(7):33-35.
[16]李燎,雷莉,冯瑞元,等.旋毛虫肌肉期幼虫分泌排泄物中特异性抗原的分析[J].地方病通报,1996,11(3):15-18.
[17]朱江巍.旋毛虫P53-ELISA和P49-ELISA检测方法建立及抗体消长规律比较[D].哈尔滨:东北农业大学,2008.
