不同温度下雌激素对施氏鲟早期性腺发育及血清性激素的影响
2011-08-01孙大江曲秋芝刘海金
张 颖,孙大江,曲秋芝,刘海金
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.中国水产科学研究院黑龙江水产研究所,哈尔滨 150070;3.中国水产科学研究院,北京 100141)
施氏鲟(Acipenser schrenckii)为鲟科鱼类,俗名七粒浮子,分布于中俄界河的黑龙江及其附属水系。近年来,由于环境恶化及过渡捕捞使野生施氏鲟的资源急剧下降,目前为我国Ⅱ级保护种类[1]。鲟鱼籽酱具有“黑色黄金”之称,国际市场上高达500~700 美元·kg-1[3]。因此,在鲟鱼商品鱼养殖利润空间稳定的情况下,鲟鱼的全雌化生产将提高鲟鱼养殖的利润空间,促进鲟鱼养殖业的发展。
自Yamamoto等1969年提出了性激素在诱导鱼类性别转换方面的作用后,该方法已成功在50多种海、淡水鱼类的全雌化生产中应用[4-6]。外源雌激素诱导法因其操作简单,在幼鱼时期即可操作,省时省力,成为鲟鱼全雌化生产的研究热点。但由于诸多因素的限制,目前也仅在短吻鲟、意大利鲟和杂交鲟中有成功的报道,如Grandi等采用17β-E2400 μg·L-1浸泡意大利鲟受精卵后,促使意大利鲟的性分化提前[7-10]。Shawn等的研究表明浓度分别为10、50 和 100 mg·kg-1的 17β-E2对 5 月龄的短吻鲟(Acipenser brevirostrum)持续投喂9个月后的雌性化诱导率分别是65%和58%[8]。Nataka等对已发生性分化的3月龄的杂交鲟(Huso huso♀×Acipenser ruthenus♂)投 喂 1 μg·g-117β -E2和 17α -methyltestosterone(MT)450 d后可发生雌性化和雄性化[11]。目前尚末在施氏鲟中有相关报道。此外,鱼类的性别是由遗传因素和环境因素相互作用共同决定的。在诸多的环境因素中,研究较多的是温度对性腺分化的影响。不同的温度可诱导不同种鱼类的性腺向雄性或雌性分化。如在高温(36℃)下,奥利亚罗非鱼(Oreochromis aureus)雄性率可达98%。在(32±1)℃的条件下[12],泥鳅(Misgurnus anguillicaudatus)的雄性率可达90%[13]。而在一些鱼类则相反,如南美洲的另一种银汉鱼(Odontesthes bonariensis)在低温(17℃)下,雌性率达100%,在高温(29℃)下则为0%[14],而温度对鲟鱼性分化作用方面还未见研究报道。因此,本试验采用温度和外源雌激素注射的诱导方法,期望在施氏鲟性腺发育早期了解其性腺分化、性别比率和血清性激素水平,了解温度和外源雌激素在施氏鲟发育早期对其性分化的影响机制。
1 材料与方法
1.1 实验鱼
试验用鱼采自中国水产科学研究院鲟鱼繁育工程中心在2010年4月下旬自繁纯种施氏鲟。人工饲料开口驯化结束后,即孵化后70 d运输到中国水产科学研究院黑龙江水产研究所,暂养到90 d后,开始试验,实验鱼平均体长(10.2±5.88)cm,平均体重(15.19±2.95)g。
1.2 试验设计
试验采用循环水系统,水族箱为95 cm×50 cm×60 cm,试验鱼经充分暴气3 d后的水驯养1周后,供试验用,pH保持在7.5左右,溶解氧浓度>6.0 mg·L-1,光照为自然光源。同批鱼卵孵化至90 d,按平均体长、体重一致的原则,将实验鱼随机分为5个温度处理(15,18,21,24和27℃)组,每个温度处理组2个重复,每个重复30尾鱼。采用电子温控器控制温度(±0.5℃)。将雌激素溶解于30%、45%、60%和75%的医用乙醇中,配置为2 mg·mL-1的浓度,计算死亡率后选取最适乙醇浓度注射,注射浓度为0.1 ug·g-1。各试验组在所设定的温度中培育30 d至孵化后120 d。各试验组和对照组于注射第1天、7天、15天和30天采集血浆液氮保存。对照组为相同温度下的未注射组。养殖方法幼鱼期投喂人工饲料,每日投喂3次,日投喂率为4%。
1.3 血浆性激素的测定方法
用注射器浸润肝素钠后,于尾椎动(静)脉取血。血样先注入置于碎冰中的1.5 mL塑料离心管内,室温放置 1 h 后,5 000 r·min-1离心 10 min,血浆入液氮中速冻后再置-20℃冰箱中保存,待测l7β-雌二醇(17β-estradiol,E2)和睾酮(Testosterone,T)含量。采用BECMAN ACESSⅡ电化学法光仪测定血浆中E2和T浓度,E2和T电化学发光试剂盒由BECMAN提供。
1.4 组织学切片制作
饲养试验30 d结束后,于120 d分别计算其成活率。采其性腺组织,Bouin′s液固定,常规石蜡切片,HE染色。在OLYMPUS BX51显微镜(配冷光源数码相机OLYMPUS DP70)下观察,拍照。早期性腺发育分期参照Flynn的方法[9]。通过对各组所有存活个体的性腺切片进行观察,确定性别,计算其雌雄比率。
1.5 数据处理
试验数据经处理后采用SPSS11.0软件对成活率和雄性率进行t检验(t-test)。
2 结果与分析
2.1 温度和注射17β-E2对施氏鲟死亡率的影响
不同温度处理组的死亡率统计结果见表1。对照组(未注射)中,28℃处理组的死亡率显著高于其他温度组,而其他温度试验组间的死亡率差异不显著,均低于1%。经激素处理后,28℃组的死亡率最高,其他组的死亡率没有显著的规律。由此可见,除高温组外,其他温度对试验鱼的死亡率没有影响。
2.2 不同养殖温度下注射17β-E2对施氏鲟血浆T浓度的影响
如表2所示,注射17β-E224 h后,各温度组血浆T含量下降到0 ng·mL-1,显著低于对照组(P<0.05)。注射后1~15 d各组血浆T含量均为0 ng·mL-1,一直持续到注射后 30 d,21、25 和 28℃高温组血浆T含量开始缓慢回升到0.33~0.41 ng·mL-1,说明注射 17β-E2显著降低了血浆 T 含量。总的变化趋势是:处理后24 h后达到最低值,即各温度组血浆T含量明显下降到0。30 d时以高温组开始回升,21、24和27℃组血浆T水平与对照组差异不显著(P>0.05)。注射 17β-E2后,温度同时也对施氏鲟的血浆T水平具有一定调控作用。
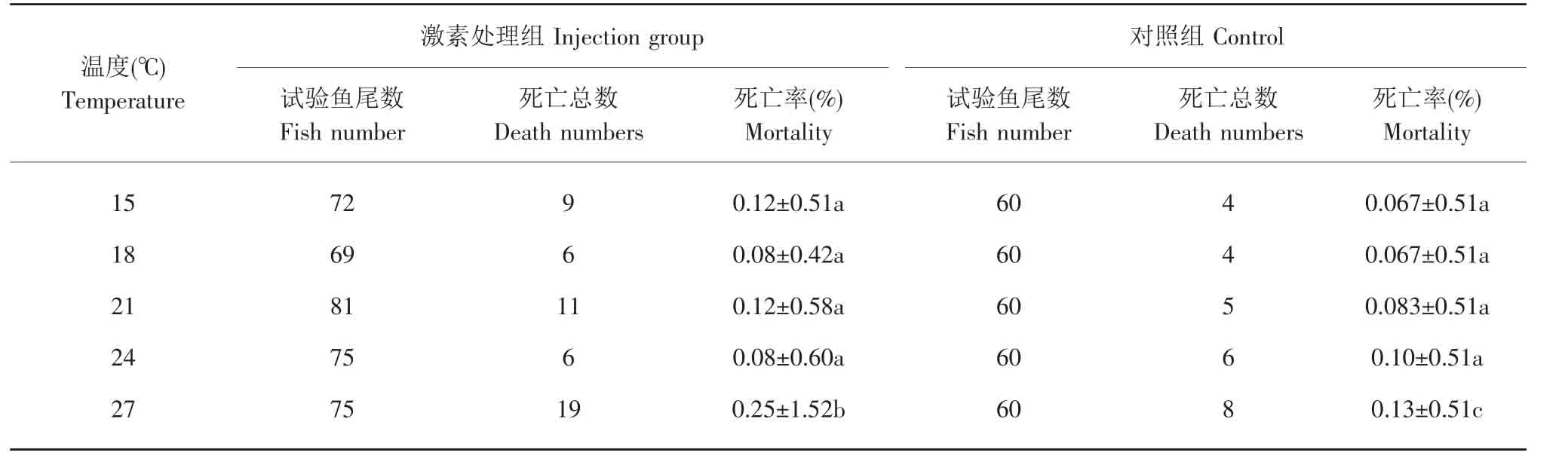
表1 不同温度下注射17β-E2的死亡率Table 1 Mortality of 17β-E2injection by different temperature

表2 17β-E2注射后不同温度下施氏鲟血清T水平的变化Table 2 Changes of serum T levels of Amur sturgeon under different temperature by 17β-E2injection
2.3 不同养殖温度下注射外源雌激素对施氏鲟血浆E2浓度的影响
如表3所示,17β-E2注射后24 h血浆E2水平显著升高,明显高于对照组(P<0.05)。注射7~15 d,血浆温度E2水平显著下降,以15℃组下降最慢显著高于对照组(P<0.05),28℃组与对照组无显著差异(P>0.05),而18℃组、21℃组和24℃组显著低于对照组(P<0.05)。注射30 d时E2水平略有回升,其中18℃组、21℃组和24℃组与对照组无显著差异(P>0.05),15℃组和27℃组显著低于对照组(P<0.05)。由此可以看出,注射17β-E2后,在短时间内显著提高了施氏鲟血浆E2水平后,随之血浆E2水平后很快降低,不久后又开始持续回升。总的变化趋势是:注射17β-E224 h后,各温度组血浆E2水平明显升高,7 d后开始缓慢降低,15 d后降到最低值后,开始回升,30 d时有所回升,以21和24℃组回升最快。注射17β-E2后,温度也对施氏鲟血浆E2水平具有一定调控作用。
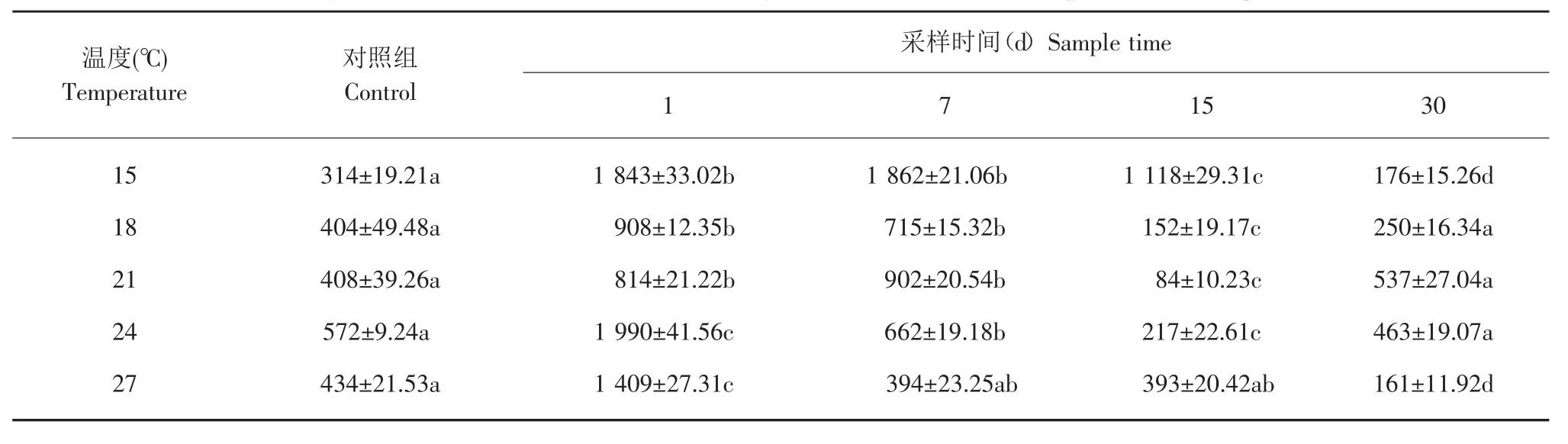
表3 17β-E2注射后不同温度下施氏鲟血清E2水平的变化Table 3 Changes of serum E2levels of Amur sturgeon under different temperature by 17β-E2injection
2.4 不同养殖温度下注射外源雌激素对施氏鲟性腺分化及性别比率的影响
与对照组比,17β-E2注射的各温度处理组的性腺外部形态结构相同,其发育特点是早期性腺均为线条状,白色,成对存在,外被一层薄的结缔组织(见图版Ⅰ-a)。
本试验结束时对照组的性腺已完成PGC细胞向性腺原基的迁移,体细胞、性原细胞和生殖上皮细胞数量迅速增加,体组织增生物向性腺腹腔凸出,形成原始性腺雏形,性腺内血管增多(见图版I-b)。低温没有抑制了施氏鲟性腺的早期发育(见图版Ⅰ-c,d),而高温更促进了施氏鲟性腺的早期发育(见图版Ⅰ-m,n)。激素处理组中的高温组的性腺出现2种不同的表面结构,性腺开始分化。其中,生殖上皮光滑,不具有皱褶或生殖沟的性腺原基发育为精巢(见图版Ⅰ-c,h,k,n),而生殖上皮有内陷、褶皱和深沟的性腺原基发育为卵巢(见图版Ⅰ-d,f,g,m)。注射 17β-E2和温度能使施氏鲟的性分化时间提前,但不能改变群体中的雌雄1∶1的性别比率(见表4)。
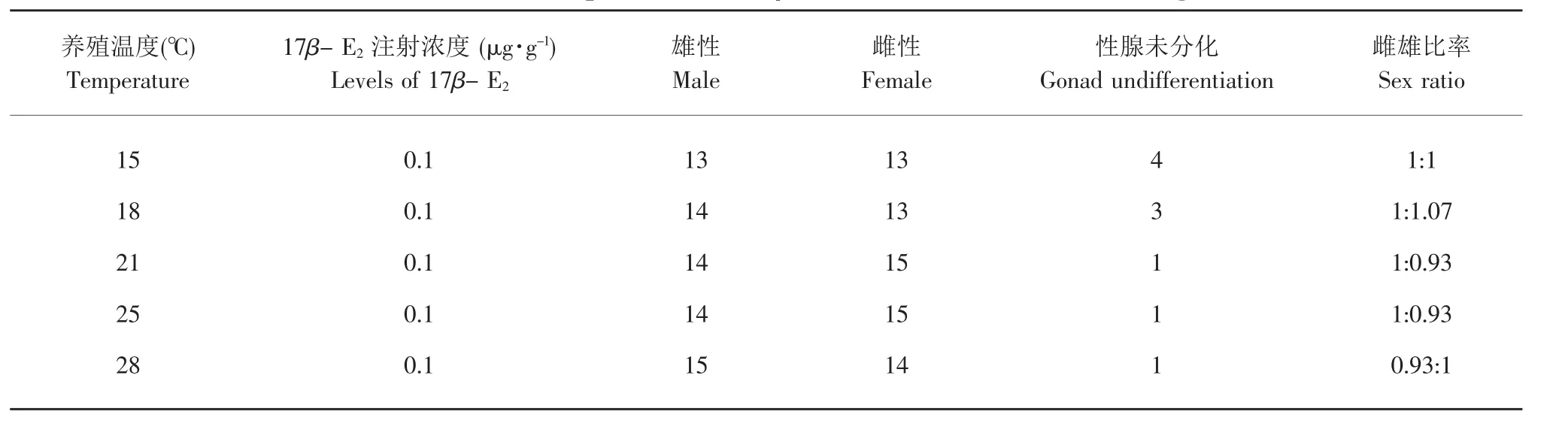
表4 温度和外源雌激素对施氏鲟性别比率的影响Table 4 Effects of temperature and 17β-E2on sex ratios of Amur sturgeon

图版Ⅰ 温度和外源雌激素对施氏鲟性分化和性别比率的影响PlateⅠ Effect of temperature and estradiol-17β on sex differentiation and sex ratio of Amur sturgeon
3 讨论
3.1 激素处理对死亡率的影响
研究表明,激素诱导鱼类性转化时,处理强度对成活率有影响。Flynn等研究表明estradiol-17β对短吻鲟幼鱼具有一定的致死作用[9]。张晓彦、Knorr和阮洪超等的研究结果表明,性激素的剂量与试验鱼死亡率关系密切[15-17]。在本试验中,雌二醇浓度的浓度为0.1 μg·L-1注射处理,随养殖水温的不同出现了较高的死亡率。由此可见,本试验所使用的激素剂量对施氏鲟成活率基本没有影响。
3.2 温度和外源雌激素对施氏鲟血浆性激素的影响
在性激素产生过程中,有一系列的酶促反应参与,高温或低温有可能通过芳香化酶的催化作用,最终影响鱼体内雌、雄激素的产生[18-20]。本试验中,在受到外源激素的影响后,21℃组的雌激素含量恢复较快,这可能与温度影响体内性激素(雄激素和雌激素)的产生的结论相一致。温度影响芳香化酶的表达已有试验证明,如对斑马鱼(Danio rerio)的研究表明,高温诱导基因型雌性斑马鱼转化为表型雄性的逆转过程中,引起了卵母细胞凋亡和性腺中的芳香化酶活性降低[20-21]。此外,南方鲶(Silurus meridionalis)的人工繁殖后代全是雌性,但使用非类固醇类芳香化酶抑制剂(Fadrozole)处理孵化不久的幼鱼可以得到高比例的雄鱼,表明芳香化酶的活性可能受到了抑制,不能催化雄激素转化成雌激素,从而使雌鱼性逆转为雄鱼[22]。
注射17β-E2后,施氏鲟体内的内分泌平衡水平被破坏。其总的规律是不同温度下,血浆E2的水平增加而T浓度显著降低至0 pg·mL-1,这可能高水平的E2浓度与T浓度产生拮抗作用,抑制体内T浓度的产生[23]。此外,对真鲷(Pagrus major)的研究表明,在一天的不同时间内采样测定血浆T和E2的含量,会有很大差别,血浆性类固醇激素的分泌存在日变化节律,且与光周期有密切关系[24]。本研究中施氏鲟为底层鱼类,各组的采样条件也均一致,因此不受采样时间和光周期的限制。环境不适或操作胁迫均可能造成血浆T水平升高不显著或者下降,特别是环境胁迫作用最有可能是血浆T水平下降的直接原因[24]。本试验中,虽然注射雌二醇后,不同温度条件下的T浓度显著降低至0 pg·mL-1,但随着体内E2的水平的变化,30 d后开始恢复,因此不认为是环境胁迫作用导致血浆T水平的显著下降。
3.3 温度和外源雌激素对施氏鲟性分化和性比的影响
解剖学上鲟开始出现雌雄分化的时间在不同种之间差异较大。Grandi等报道纳氏鲟(A.naccarii)于6月龄性腺开始雌雄分化,俄罗斯鲟(A.gueldenstaedtii)在 3月龄、杂交鲟(Huso huso x A.ruthen)在6月龄、小体鲟(A.ruthen)在8月龄、短吻鲟(A.brevirostrum)在 7月龄、而中华鲟(A.sinensis)在 9月龄性腺开始雌雄分化[9,25-27]。本研究中,施氏鲟在孵化后120 d还没开始性分化,表明施氏鲟的性腺分化时间要长于俄罗斯鲟。姚道霞等人和张晓彦等人对黄颡鱼和半滑舌鳎的报道表明,用17β-E2处理黄颡鱼和半滑舌鳎时,雌二醇促使其卵巢提前分化,而使精巢分化推迟[15,28]。其原因可能是在鱼类性分化过程中起了关键作用的芳香化酶可以刺激卵巢的分化,而外源性雌激素可以显著提高鱼类芳香化酶的产生[15]。因此,在鱼类性分化之前,进行外源性雌激素处理,会促使鱼体内雌性激素的分泌量增加和雄性激素的降低,从而使鱼类的卵巢分化提前,精巢分化滞后。本研究中17β-E2和温度处理使施氏鲟性腺均已在组织学水平上出现性分化,其中27℃高温组明显的促进其性腺的提前发育,未观察到精巢分化滞后的现象。此外,雌激素用于诱导产生雌鱼,雄激素则根据剂量不同用于诱导雄性化或不育鱼。而激素处理对性分化的影响除了正常的性转化外,还可能使性腺出现畸形,如卵巢与精巢共存、精巢中出现卵巢腔或是性腺萎缩等[28]。本试验中未发现雌雄间体、性腺萎缩等现象这与半滑舌鳎性分化的组织学的研究结果一致[15]。
研究表明,CYP19可以催化雄激素转化为雌激素,被认为是性腺性别分化中的关键酶,控制着性激素的相对比率,比率的高低决定性别分化的方向[29]。温度通过影响芳香化酶基因的表达或其调节基因的活性而最终影响性腺性别的分化[29-30]。在本试验中温度和外源雌激素是否是通过影响芳香化酶,从而影响雄激素/雌激素比率来影响施氏鲟性别分化的还需要进一步研究,但是可以肯定的是在本研究中,施氏鲟的雄激素/雌激素比率通过温度和外源雌激素发生了显著的改变。有研究认为,鱼类性分化过程中芳香化酶起了关键作用,可以刺激卵巢的分化,而外源性雌激素可以显著提高鱼类芳香化酶的产生[31-33]。
[1]谢忠明,孙大江,王京树,等.鲟鱼养殖技术[M].北京:中国农业出版社,2002:33-35.
[2]孙大江,曲秋芝,马国军,等.中国鲟鱼养殖概况叫[J].大连水产学院学报,2003,18(3):216-227.
[3]曲秋芝,孙大江,王丙乾,等.施氏鲟卵巢发育的组织学观察[J].中国水产科学,2004,28(5):487-492.
[4]Yamazaki F.Sex control and manipulation in fish[J].Aquaculture.1983,33:329-354.
[5]Grandi G,Giovannini S,Chicca M.Gonadogenesis in early developmental stages ofAcipenser naccariiand influence of estrogen immersion on feminization[J].Journal of Applied Ichthyology,2007,3(1):3-8.
[6]Nagahama Y.Gonadal steroid hormones:major regulators of gonadal sex diferentiation and gametogenesis in fish[J].Physiol Fish Univ Bergen,2000:211-222.
[7]Van Eenennaam J P,Doroshov SI.Effects of age and body size on gonadal development ofAtlantic sturgeon[J].Fish Biol,1998,53:624-637.
[8]李璐.施氏鲟早期性腺发育研究[D].哈尔滨:东北林业大学,2006.
[9]Flynn S R,Benfey T J.Sex differentiation and aspects of gametogenesis in shortnose sturgeon Acipenser brevirostrum Lesueur[J].J Fish Bio1,2007,70:1027-1044.
[10]Omoto N,Maebayashi M,Mitsuhashi E,et al.Effects of estradiol-17β and 17α-methyltestosteroneon gonadal sex differentiation in theF2hybridsturgeon,thebester[J].Fish.Sci,2002,68:1047-1054.
[11]Pandian T J,Sheela S G.Hormonal induction of sex reversal in fish[J].Aquaculture,1995,138:1-22.
[12]Shawn R.Flynn,Tillmann J.B.Effects of dietary estradiol-17β in juvenile shortnose sturgeon,Acipenser brevirostrum,Lesueur[J].Aquaculture,2007,270:405-412.
[13]Tessema M,MLLER-Belecke A,H?RSTGEN-Schwark G.Effect of rearing temperatures on the sex ratios ofOreochromis niloticuspopulations[J].Aquaculture,Amsterdam,2006,258(1):270-277.
[14]陈玉红,林丹军,尤永隆.泥鳅的性腺分化及温度对性腺分化的影响[J].中国水产科学,2007,14(1):74-82.
[15]Ito L S,Takahashi C,Yamashita M,et al.Warm water induces apoptosis,gonadal degeneration,and germ cell loss in subadult pejerreyOdontesthes bonariensis(Pisces,Atheriniformes)[J].Physiol Biochem Zool,2008,81(6):762-774.
[16]张晓彦,刘海金.17β一雌二醇对半滑舌鳎性分化和生长的影响[J].东北农业大学学报,2009,40(6):67-72.
[17]Knott S,Braunbeck T.Decline in reproductive success,sex reversal and development alterations in Japanese medaka(Oryzias latipes)after continuous exposure to octylphenol[J].Ecotoxicology and Enviremental Safety,2002,51:187-196.
[18]阮洪超,黄瑞冬.己烯雌酚诱导黑鲷幼鱼性转换[J].海洋水产,1997(6):6-7.
[19]楼允东,吴萍.温度在水产动物性别控制中的作用[J].上海水产大学学报,2008,17(4):481-485.
[20]翁幼竹,张为民,方永强,等.1713一雌二醇诱导鲻鱼雌性化的机制:芳香化酶和雌激素受体双染定位研究[J].中国水产科学,2003,10(6):446-450.
[21]Simpson E R,Mahendroo M S,Means G D,et a1.Aromatase cytochrome P450,the enzyme resporsible for estrogen biosynthesis[J].Endocrinol Rev,1994,15:342-355.
[22]Goto Kazeto R,Kight K E,Zohar Y,et a1.Localization and expression of aromatase mRNA in adult zebrafish[J].Gen Comp Endocrinol,2004,139(1):72-84.
[23]张修月,焦保卫,吴天利,等.南方鲶性腺分化的组织学观察[J].动物学杂志,2005,40(1):41-48.
[24]Syaghalirwa N M,Mandiki,Igor Babiak1,et al.Effects of sex steroids and their inhibitors on endocrine parameters and gender growth differences in Eurasian perch(Perca fluviatilis)juveniles[J].Steroids,2005,70:85-94.
[25]温海深,宋海霞,杨立廷,等.外源激素对养殖牙鲆血浆睾酮和雌二醇含量的影响研究[J].海洋学报,2006,28(4):115-120.
[26]Akhundov M M,Fedorov K Y.Early gametogenesis and gonadogenesis in sturgeons.On criteria for comparative assessment of juvenile gonadal development in the example of the Russian sturgeon,Acipensergueldemtaedtii[J].JIchthyol,1991,31:101-114.
[27]Wrobel H H,Hees I,Schinnel M,et a1.The genus Acipenser as a model system for vertebrate urogenital development:Nephrostomial tubules and their significance for the origin of the gonad[J].Anat Embryol,2002,205:67-80.
[28]陈细华,危起伟,杨德国,等.养殖中华鲟性腺发生与分化的组织学研究[J].水产学报,2004,28(6):633-639.
[29]姚道霞.黄颡鱼性分化及激素诱导性转化研究[D].哈尔滨:东北林业大学,2007:1-56.
[30]Tsai C L,Chang S L,W an g L H,et a1.Temperature influences the ontogenetic expression of aromatase and oestrogen receptor mRNA in the developing tilapia(Oreochromis mossambicus)brain[J].J Neuroendocrinol,2003,15(1):97-102.
[31]Eric S,Alexis F.Temperature effects and genotype temperature interactions on sex determination in the European sea bass(Dicentrarchus labraxL.)[J].Journal of Experimental Zoology,2002,292:494-505.
[32]Nagahama Y.Gonadal steroid hormones:Major regulators of gonadal sex diferentiation and gametogenesis in fish[J].Physiol Fish Univ Bergen,2000,295:211-222.
[33]Pandian T J,Sheela S G.Hormonal induction of sex reversal in fish[J].Aquaculture,1995,138:1-22.
