黑曲霉MAN1基因在大肠杆菌中的表达及酶学性质分析
2011-07-12曹雨婷
张 旭,李 璐,曹雨婷,徐 欣,李 杰
(东北农业大学生命科学学院,哈尔滨 150030)
β-1,4-D-甘露聚糖酶(β-1,4-D-mannan mannanohydrolase EC 3.2.1.7),又简称为 β-D-甘露聚糖酶或β-甘露聚糖酶,是一类能够水解含有β-1,4-甘露糖苷键的甘露寡糖、甘露多糖(包括甘露聚糖、半乳甘露聚糖、葡甘露聚糖等)的水解内切酶[1-3],属于一类能够水解半纤维素而且具有纤维素酶活性的广谱诱导酶[4]。作为一种新型工业用酶,在食品、医药、造纸、饲料和石油等工业领域中有着广泛的应用前景[5],作为一种鉴定多糖结构的工具酶[6-7],对糖工程、植物基因工程等基础研究有重要用途。
早在20世纪初,就有分解植物甘露聚糖酶的最初报道[8],从50年代至今研究工作已经从产β-甘露聚糖酶微生物菌株的选育,产酶发酵工艺条件的优化、酶的分离纯化和理化特性,酶的作用机理,不同来源酶的特性及应用等方面转向酶基因的克隆、表达和活性位点等方面。到目前为止,已从不同来源的微生物只分离到大量不同类型和功能的甘露聚糖酶,并对其酶学性质、催化机制以及分子结构等进行了细致的研究[9]。本研究以β-甘露聚糖酶生产菌黑曲霉为材料,克隆甘露聚糖酶基因MAN1,并进行原核表达,以期为甘露聚糖酶的工业化生产探索新的途径。
1 材料与方法
1.1 材料
黑曲霉菌株(由肇东日成酶制剂有限公司提供);大肠杆菌E.coli DH5α、BL21,质粒PET-32b均由本实验室保存;RNAiso Plus、RT-PCR试剂盒、pMD18-T载体、T4DNA连接酶、Prime STAR Taq酶、限制性内切酶、Ladder Marker(购自大连宝生物工程公司);DNA回收试剂盒(购自北京百泰克生物技术有限公司);PDA、LB培养基的配制方法参照美国Invitrogen公司Pichia Expression Kit提供的说明书,其他试剂均为国产分析纯。
引物参照NCBI上甘露聚糖酶基因序列(XM001400053)设计,由上海生工生物工程技术有限公司合成。为方便克隆,引物的5′端分别添加了限制性酶切位点Eco RⅠ和NotⅠ(加下划线表示)。引物序列如下:
P1:5′GAATTCATGAAGCTTTCCAACGCCCT3′
P2:5′GCGGCCGCTTAAGCACTACCAATAGC AG 3′
1.2 方法
1.2.1 β-甘露聚糖酶基因cDNA的克隆
黑曲霉在加入魔芋粉的液体PDA培养基中培养,根据RNAiso Plus提供的说明书提取黑曲霉的总RNA。以总RNA为模板,按照RT-PCR试剂盒的说明书,合成cDNA的第一条链,并进行琼脂糖凝胶电泳检测其质量。以cDNA为模板,用引物P1、P2进行目的基因的PCR反应,反应体系为25 μL,含有 50 ng模板 cDNA,0.2 mmol·L-1dNTP,25 pmol每种引物,5×Prime STAR Loading Buffer,2 U Prime STAR Taq酶。反应条件为:94℃预变性5 min;94℃ 30 s,55℃ 30 s,72℃ 90 s进行30个循环的反应;最后,72℃延伸5 min。反应结束后,进行琼脂糖凝胶电泳,扩增出约1 200 bp的DNA片段,回收目的条带,再与pMD-18T连接,转化大肠杆菌DH5α得到pMD18-MAN1。获得的阳性克隆经酶切鉴定后送往上海生工测序。
1.2.2 原核大肠杆菌表达载体的构建
大肠杆菌表达载体pET-MAN1的构建过程如图1所示。以Eco RⅠ、NotⅠ双酶切pET-32b和pMD18-MAN1载体,分别回收约5 800 bp的大片段和约1 200 bp的MAN1片段,连接,转化E.coli BL21,挑选阳性克隆,酶切鉴定,构建成大肠杆菌表达载体pET-MAN1。

图1 大肠杆菌表达载体pET-MAN1的构建Fig.1 Construction of expression vector pET-MAN1
1.2.3 β-甘露聚糖酶的诱导
将转化得到的重组菌株接于LB培养基中,37 ℃、150 r·min-1,12~16 h 后,取 1%的菌液加入LB中进行二次活化至OD600=0.8时,加入终浓度0.1 mmol·L-1的 IPTG,20 ℃、150 r·min-1条件下培养 2,4 和 6 h,4 000 r·min-1离心 10 min 收集菌体,裂解,取上清和沉淀做SDS-PAGE分析。同时,做未诱导菌株、转大肠杆菌空菌和转空载体菌株的对照,分析重组蛋白的表达情况。
1.2.4 β-甘露聚糖酶活性的测定
将诱导培养后的菌体上清用DNS法检测β-甘露聚糖酶活性[10]。利用比色法测定酶解后还原产物的生成量,表示酶的活力。诱导2,4和6 h的不同菌株粗酶液各0.1 mL,0.9 mL的0.5%槐豆胶溶液(pH 3.5 0.05 mol·L-1磷酸缓冲液配置)置于 70 ℃水浴反应10 min,加入DNS显色剂3 mL,再沸水浴15 min显色,冷却,用蒸馏水定容至15 mL,混匀,在550 nm下测定吸光率。
酶活单位定义:在设定的温度及pH条件下,1 min从底物溶液中分解产生1 μmol还原糖(表示为还原糖当量)所需要的酶量为一个酶活单位,简称IU。
2 结果与分析
2.1 β-甘露聚糖酶基因cDNA的克隆
以黑曲霉的总RNA为模板,用β-甘露聚糖酶基因引物经RT-PCR可扩增出约1 200 bp的目的条带。如图2、3所示,其带纹单一,特异性强,表现出与目的基因大小一致的条带。将该片段克隆连至pMD18-T并测序。Blast比对结果表明,该序列与GenBank中编号XM001400053的序列相似性为100%,所克隆的分子即为预期的MAN1基因,编码384个氨基酸的β-甘露聚糖酶。克隆片段的核苷酸序列及编码多肽序列:
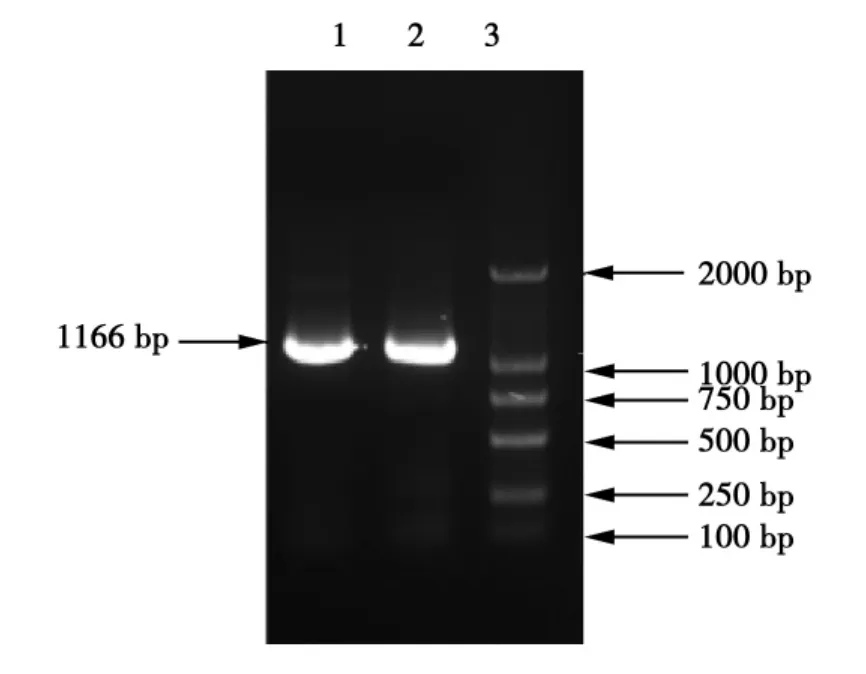
图2 甘露聚糖酶基因cDNA的克隆Fig.2 Mannanase gene cloning of cDNA


图3 克隆片段的核苷酸序列及编码氨基酸序列Fig.3 Nudeotide sequence of doned fragment and its amino acid sequence
经Eco RⅠ、NotⅠ双酶切pET-MAN1的质粒验证,得到约5 900 bp和1 200 bp的片段,如图4所示,表明载体构建成功。
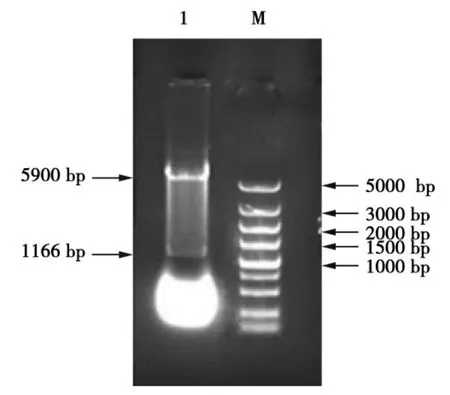
图4 表达载体PET-MAN1酶切鉴定结果Fig.4 Characterization of expression vector PET-MAN1 with endonucleas
2.3 表达载体的转化及酶活性鉴定
2.3.1 表达产物的SDS-PAGE分析
将转化E.coli.BL21获得的pET-MAN1重组子,37℃条件下,用0.1 mmol·L-1的IPTG诱导2、4、6 h后的SDS-PAGE分析结果表明,在约62 ku处出现与预计大小一致的条带。未诱导的E.coli.BL21菌和转空载体的E.coli.BL21则没有相应的特异条带,如图5所示,证明重组蛋白表达成功。
2.3.2 表达产物酶活性的测定
用LB培养基培养重组大肠杆菌,用0.1 mmol·L-1的IPTG诱导2、4、6 h,菌体经酶解破碎后,通过DNS法测定上清液酶活。IPTG诱导6 h时重组菌株酶活达到48 IU·mL-1(见表1)。

表1 不同诱导时间对甘露聚糖酶活性的影响Table 1 Different induction time on the activity of mannan
2.3.3 重组甘露聚糖酶的最适温度
用DNS法分析在pH 5,不同温度条件下重组甘露聚糖酶活性变化,并以酶活最高为100%计算相对酶活,证明其最适温度为55℃(见图6)。
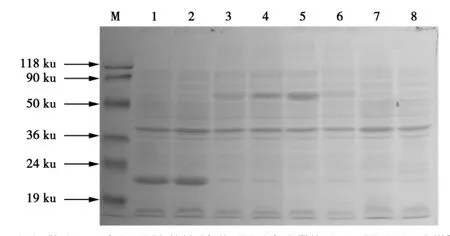
图5 诱导表达蛋白SDS-聚丙烯酰胺凝胶电泳图谱Fig.5 SDS-induced protein polyacrylamide gel electrophoresis
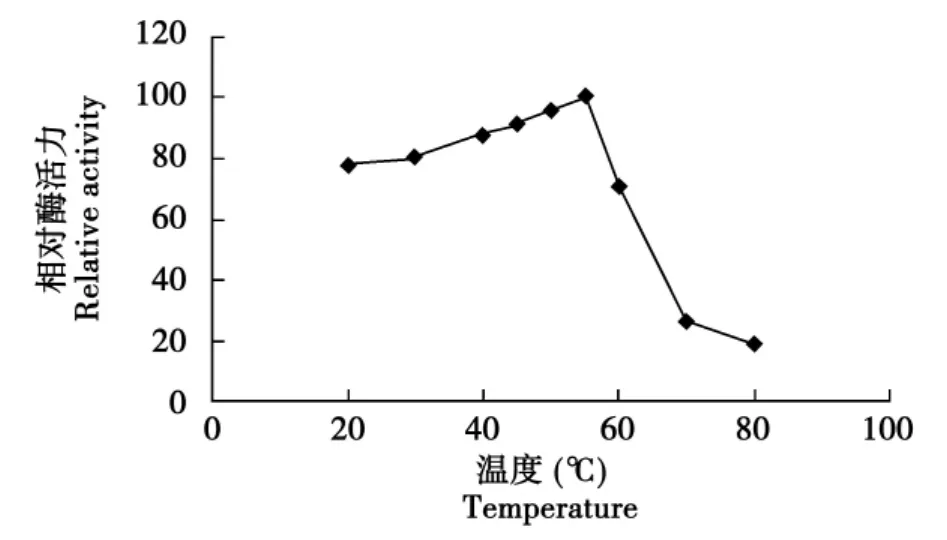
图6 温度对甘露聚糖酶酶活力的影响Fig.6 Effect of temperature on activity of mannanase
2.3.4 重组甘露聚糖酶的最适pH
用DNS法分析在55℃,不同pH条件下重组甘露聚糖酶活性变化,并以酶活最高为100%计算相对酶活,证明其最适最适pH为5.5(见图7)。
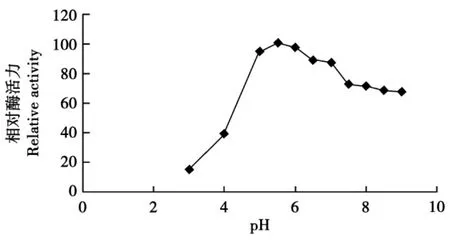
图7 pH对甘露聚糖酶活力的影响Fig.7 Effect of pH on activity of mannanase
3 讨论与结论
重组蛋白的表达系统主要包括真核和原核两大系统,原核系统主要是大肠杆菌表达系统。大肠杆菌表达系统具有的操作简单、价格经济,遗传背景清楚等优势使该系统成为高效表达外源蛋白最常用的原核表达系统[11],但是很多真核基因在原核中很难高效表达,是因为真核基因的一些密码子对于原核来说可能是稀有密码子,如:Arg密码子AGA、AGG、CGG、CGA、UUA;Gly密码子GGA;Leu密码子CUA、TTG;Ile密码子AUA;Ser密码子UCA等在E.coli中很少使用[12]。本试验选择大肠杆菌BL21和pET-32b表达系统,通过与MAN1蛋白的融合,使MAN1在大肠杆菌中得到高效表达,在MAN1基因384个密码子中,有20个稀有密码子,其中编码Gly(G)的有5个,编码Val(V)的有7个,编码 Leu(L)的有 6 个,编码 Arg(R)和 Pro(P)的各一个,稀有密码子的存在大大降低了蛋白质合成的速率,使蛋白表达量降低。
在微生物中β-甘露聚糖酶的来源非常广泛,包括细菌、真菌、放线菌等都是甘露聚糖酶的主要来源,真菌来源的β-甘露聚糖酶分子质量大多在45~55 ku,最适 pH 4.0~5.5,最适温度 55~75 ℃,真菌来源的酶多为酸性酶。本试验所用黑曲霉提取的β-甘露聚糖酶的分子质量为41 ku,最适反应温度为55℃,最适反应pH为5.5,在温度20~60℃、pH 5~9有较大的活性区间。本试验只对最适反应温度和最适反应pH做了研究,还可以进一步对温度和pH的稳定性、底物的种类和质量浓度、离子强度及金属离子和螯合剂等做出相应的研究。
近年来已经在枯草芽孢杆菌(Bacillus subtilis)、嗜碱芽孢杆菌(Alkalophilic Bacillussp)、里氏木霉(Trichoderma reesei)及荧光假单孢菌(Pseudomonas fluorescence)等中克隆到甘露聚糖酶基因,并把这些基因分别在大肠杆菌中进行了表达研究。结果表明这些基因菌可以再大肠杆菌中表达,并具有甘露聚糖酶的活性。不同菌种测定得到的酶活有很大差异,本研究以RT-PCR的方法成功获得了来源于黑曲霉的β-甘露聚糖酶基因,并在大肠杆菌中实现了表达,并通过测定得到此酶的最适温度和最适pH,最高酶活可达到48 IU·mL-1使其为应用于工业奠定了基础。
[1]Petrus J Z,Moodley V,Rose S H,et al.Production of the aspergillus aculeatusendo-1,4-β-mannanaseina.Niger[J].Journal of Industrial Microbiology&Biotechnology,2009(4):611-617.
[2]Zhang Q,Yan X,Zhang L,et al.Cloning,sequence analysis and heterologous expression of a beta-mannanase gene from Bacillus subtilis Z-2[J].Molecular Biology,2006,40(3):418-424.
[3]齐军茹,廖劲松,彭志英.β-甘露聚糖酶的制备及其应用研究进展[J].中国食品添加剂,2002,6(6):12-15,4.
[4]尤新.功能性低聚糖生产与应用[M].北京:中国轻工业出版社,2004.
[5]吴襟,何秉旺.微生物β-甘露聚糖酶[J].微生物学通报,1999,26(2):134-136.
[6]Mccleary B V.beta-D-Mannosidase from helix pomatia[J].Carbohydrate Research,1983,111(2):297-310.
[7]李剑芳,邬敏辰,夏文水.微生物β-甘露聚糖酶的研究进展[J].江苏食品与发酵,2004(3):4-9.
[8]Khalilova E A,Abramov Sh A.Effect of culture media on the composition of free amino acids inSaccharomyces cerevisiaeyeast[J].Prikl biokhim mikrobiol,1985,21(3):293-299.2001,37(5):578-581.
[9]陈小兵,丁宏标,乔宇.β-甘露聚糖酶的酶学性质、工农业应用及基因工程研究[J].中国生物工程杂志,2005,25(S1):156-159.
[10]Bailey M J,Beily P,Poutanen K.Interlaboratory testing of methods for assay of xylannase activity[J].Journal of Biotechnology,1992,23:257-270.
[11]张巍,陈品林,雷明,等.海南坡鹿CDC42 cDNA的克隆、原核表达及纯化[J].兽类学报,2011,31(1):97-102.
[12]尹春光,杜立新,赵桂平,等.Mx基因稀有密码子和mRNA结构及大肠杆菌表达优化[J].遗传,2009,31(1):75-82.
