超高效液相色谱-串联质谱法检测猪血清中泰乐菌素残留的建立
2011-08-08李艳华
崔 阳,王 冰,徐 刚,边 栋,李艳华*
(1.东北农业大学动物医学学院,哈尔滨 150030;2.东北农业大学食品学院,哈尔滨 150030)
泰乐菌素是一种畜禽专用大环内酯类抗生素,作为促进生长用的添加剂在国内养猪业中已广泛应用。在我国,泰乐菌素仍然属于限制使用的药物饲料添加剂。然而2006年欧盟成员国全面禁止使用抗生素作为促生长剂。但对于活体动物出口的检疫,无法采用动物组织或脏器直接测量,因而进行血液中泰乐菌素含量的测量来标示泰乐菌素在体内组织中的残留情况。到目前为止,我国尚无有关猪血清中泰乐菌素残留的可靠分析方法。报道的检测大环内酯类的方法主要有高效液相色谱法[1-2]、气/质联用法[3]、液/质联用法(LC/MS或LC-MS/MS)[4-10]。
本试验采用超高效液相色谱串联三重四级质谱(UPLC-MS/MS)技术对血清样品中的泰乐菌素进行分析。克服了血清取样量小的限制,且MS具有高灵敏度、高选择性的特点,可以在极低的浓度下进行精确的定量,因此本试验可以对血清中微量泰乐菌素进行快速鉴别和测定,同时也对泰乐菌素在猪体内的药物代谢动力学研究提供了检测方法。猪血清中泰乐菌素的检测限达到0.2 ng·mL-1,回收率及精密度结果满意。猪血清中泰乐菌素的检测方法,作者未见文献报道。
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂与标准品
甲醇-HPLC级(Dimammd),乙腈-HPLC级(Fisher),泰乐菌素标准品(Sigma),乙酸、乙酸铵-分析纯(科密欧),SEP-Vac C18固相萃取柱3 mL,200mg填料(Waters),去离子水(Milli-Q),5种不同来源的空白血清样品(香坊试验猪场)。
1.1.2 仪器
Water ACQUITY UPLC超高压高效液相色谱仪串联Quattro Premier XE三重四级质谱。质谱采用电喷雾电离原,MassLynx4.1的软件控制系统。
1.2 方法
1.2.1 色谱条件
采用ACQUITY UPLC BEH-C18柱(50 mm×2.1 mm,1.7 μm),乙腈(A)和0.2%乙酸(B)为流动相梯度洗脱(见表1)。流速0.25 mL·min-1,柱温30℃,5 μL进样。
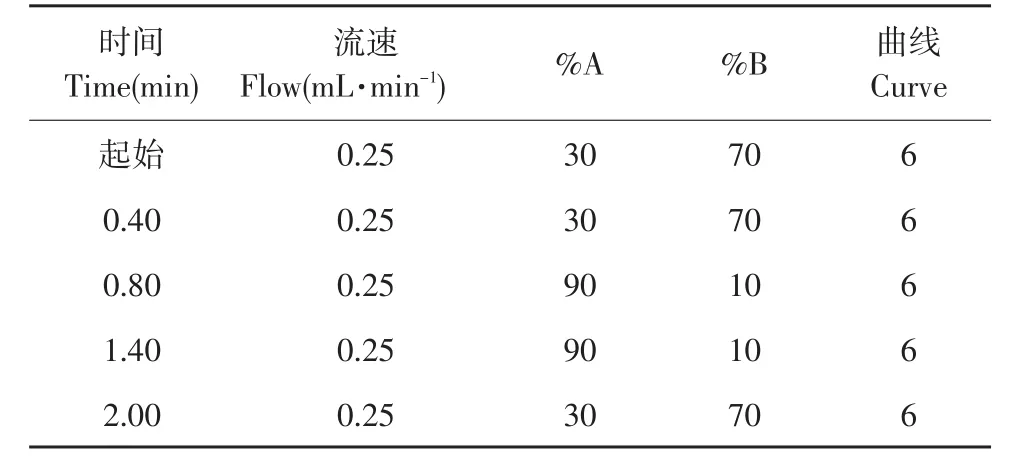
表1 超高效液相色谱分析的流动相的组成与梯度Table 1 Composition and gradient of the mobile phase for UPLC analysis
1.2.2 质谱条件
采用ESI+模式,毛细管电压3.0 kV;锥孔电压25 V;源温度110℃;脱溶剂气温度350℃;锥孔气流量50 L·h-1;脱溶剂气流量550 L·h-1。碰撞气体为氩气,碰撞室压力3.3×10-3mbar,定性和定量的离子及其碰撞能量等质谱条件见表2。泰乐菌素离子碎片及断裂方式见图1。
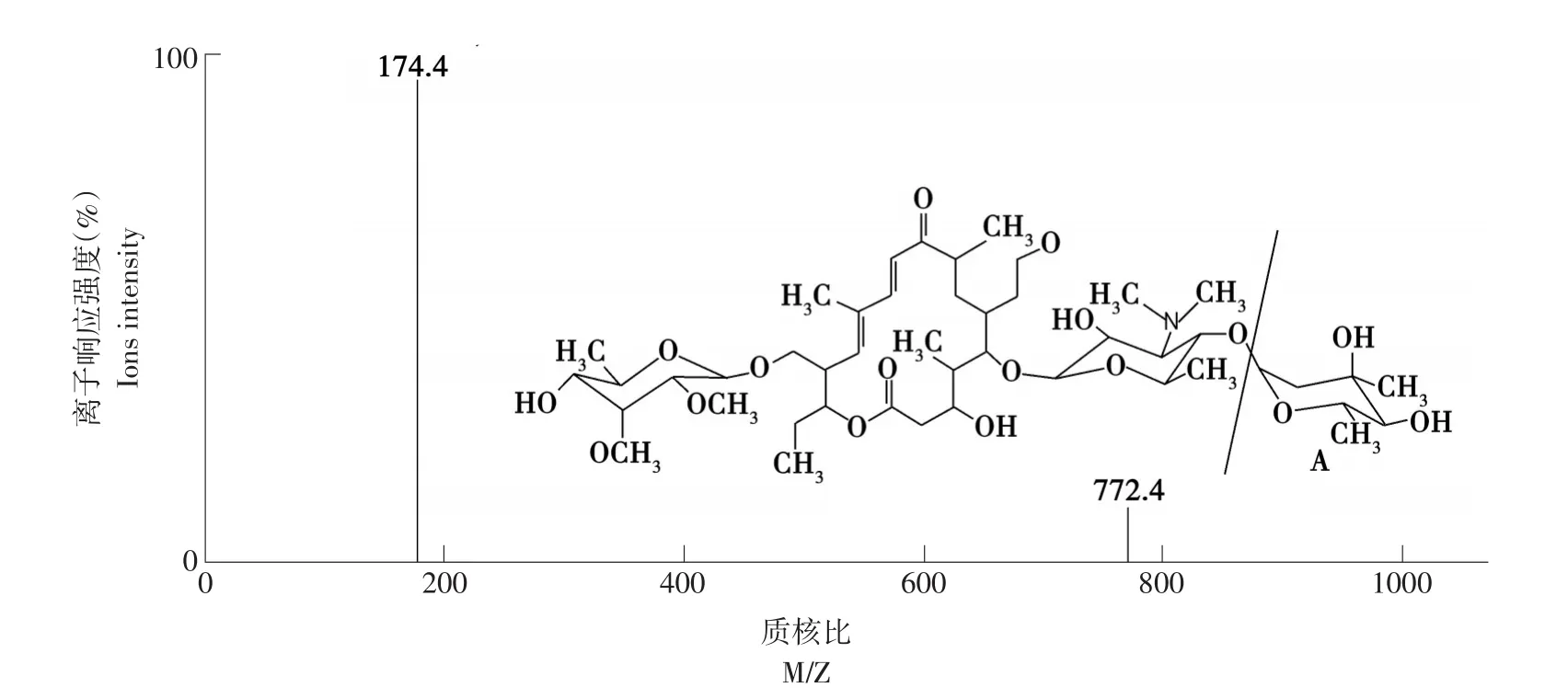
图1 泰乐菌素离子碎片质谱图Fig.1 Mass spectra of the Tylosin

表2 泰乐菌素的定性和定量离子质谱条件Table 2 Precursor ions and product ions of the Tylosin in the positive ion mode
1.2.3 标准溶液的制备
准确称量20.00 mg泰乐菌素标准品于100 mL容量瓶中,用乙腈溶解定容,配置成浓度为200 μg·mL-1标准品储备液1,于4℃冰箱保存待用。移取1.0 mL储备液Ⅰ至100 mL容量瓶中,乙腈溶解并定容至刻线,配置成浓度为2 μg·mL-1标准品储备液Ⅱ。将储备液用用乙腈-0.2%乙酸(30∶70,V/V)溶液分别稀释为0.5、1、5、10和50 ng·mL-1等系列标准品工作液。
1.2.4 样品的提取和净化
准确量取0.5 mL血清至25 mL离心管中,加入2 mL 0.05 mol·L-1pH4 的乙酸铵溶液,加入 0.5 g NaCl,准确移取5 mL乙腈加入离心管中。旋涡振荡5 min,2 600 r·min-1离心 3 min。离心后取上清液2.5 mL置于另一15 mL离心管中,50℃氮吹至尽干。
采用Sep-Vac C18固相萃取柱进行净化。3 mL甲醇活化固相萃取(SPE)小柱,5 mL水平衡小柱,用2.5 mL 0.05 mol·L-1pH 4的乙酸铵溶液溶解浓缩的样品通过固相萃取柱,再用每次1 mL的乙酸铵溶液2次重复溶解样品,通过SPE小柱。待样品全部经过SPE小柱后,减压抽干30 s。用5 mL 5%氨水-甲醇溶液洗脱,洗脱液接于15 mL离心管中,50℃氮吹至尽干。
浓缩后的样品残渣,用1 mL流动相-乙腈:0.2%乙酸(30∶70)震荡溶解,过0.22 μm滤膜,转移至进样瓶。
2 结果与分析
2.1 选择性
试验分别选用了五组来自不同源猪的血清进行分析,结果表明经过(1.2.4)样品的提取和净化处理后,血清中并没有干扰物质对此检测方法造成影响,且该血清可作为空白血清进行试验。标准品图和血清样品图见图2。
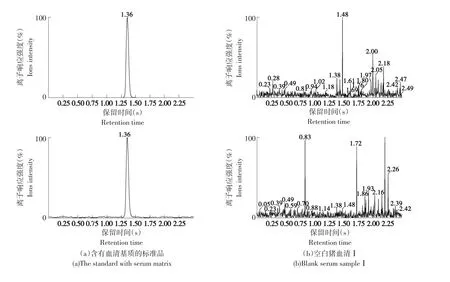

图2 含有血清基质的标准品图及空白血清样品图Fig.2 MRM chromatogram of porcine serum and added with Tylosin standard
2.2 标准曲线与线性范围
选取0.5、1、5、10和50 ng·mL-15个浓度配置成以血清为基质的标准溶液。平行做两组进行测定,以药物浓度(ng·mL-1)为横坐标,以相应的峰面积为纵坐标绘制标准曲线。可以看出泰乐菌素在0.5~50 ng·mL-1范围内呈现良好的线性关系,相关系数(R2)均大于0.9994。线性方程及相关系数见表3。

表3 猪血清中泰乐菌素标准曲线Table 3 Standard curve of Tylosin in swine serum
2.3 灵敏度与精密度
对于测定猪血清中的泰乐菌素的精密度与重现性的考察,将配置好的一定浓度血清为基质的标准品溶液,根据特征离子质量色谱峰信噪比(S/N)>3为方法最低检出限,为 0.06 ng·mL-1,(S/N)>10 为方法最低定量限为0.2 ng·mL-1。在同一天内对不同添加浓度的泰乐菌素对照品血浆各5份进行分析测定;连续5 d对不同添加浓度的泰乐菌素对照品血浆进行测定。日间与日内RSD均>13.5%,结果见表4。
2.4 回收率
添加一定量标准溶液于0.5 mL空白血清样品中,3个水平的标准添加的质量浓度分别相当于5、10和50 ng·mL-1的残留量,每一浓度水平下作5个平行样。添加后按照“2.3和2.4”节所述步骤进行提取、净化,UPLC-MS/MS测定,回收率在73%~84%之间。结果见表4。
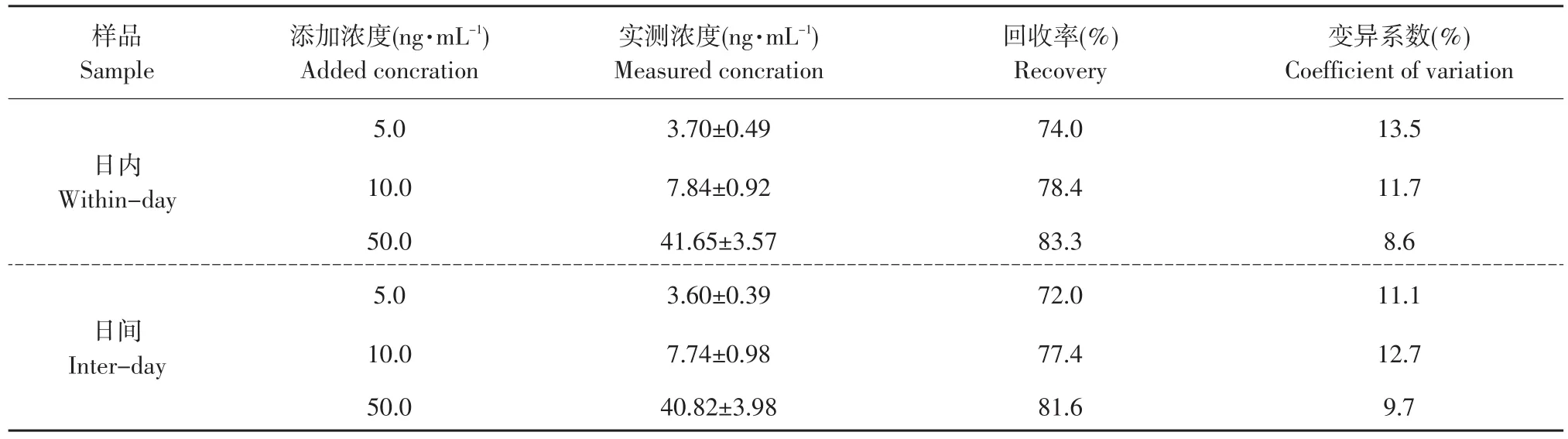
表4 猪血清中泰乐菌素的日间、日内差异和回收率结果(n=5)Table 4 Within-day and inter-day accuracy and recovery of Tylosin tartrate in porcine serum(n=5)
3 讨论
在检测方法选择上,内标法是相对准确的方法,但是泰乐菌素的同位素-D内标难以获得。若选择其他物质作为内标化合物的话,即使是结构相近,但是ESI接口方式本身就造成了不同化合物间的电离程度不同,因而本试验采用了混有血清基质的标准品以基质标的方式,外标法进行定量。大量样品分析时,与内标法相比,本方法在样品的预处理上较简单,同时节省了使用内标化合物的成本。
本试验采用5 μg·mL-1泰乐菌素标准溶液在电喷雾正离子模式下进行母离子全扫描,确定准分子离子[M+H]+,优化锥孔电压。然后以准分子离子为母离子对其子离子进行全扫描,选取丰度较强的3对子离子,优化其碰撞能量、脱溶剂气温度、脱溶剂气流量等质谱参数。由于样品基质会对泰乐菌素电离造成影响,当预处理方法完成后,采用混有血清为基质的标准溶液经质谱分析,再最终选择出丰度最强的两对子离子。母离子[M+H]+(m/z 916.9),两个子离子碎片为失去部分糖结构的[M+H]+(m/z 772.4),和质子化的结构碎片[M+H]+(m/z 174.4)作为MRM参数。
采用ESI+方式进行监测离子,酸性流动相有利于泰乐菌素的电离。乙酸铵作为流动相能很好的控制待分析物的峰型,但与乙酸相比抑制了泰乐菌素电离。为了获得更高的灵敏度,实验选用了0.2%乙酸作为流动相。采用ACQUITY UPLC BEH C18柱分离样品,1.7 μm的填料颗粒在分离血清样品时,由于样品基质复杂,使用等度洗脱时,易造成内源性物质在色谱柱上的蓄积从而降低色谱柱效影响色谱峰峰形,所以在本试验中选择梯度洗脱,减少内源性物质的蓄积使得峰形更锐,并且使色谱柱的寿命大大增长。
试验在前处理过程中,对血清样品的净化采用了固相萃取方式。泰乐菌素为中等极性,因而试验选用采用Sep-Vac C18柱和Osisa HLB柱进行样品净化,采用乙酸铵溶解样品通过小柱,偏酸性的环境有利于泰乐菌素在C18这种填料的固相萃取小柱上吸附。C18为反向柱,可利用其溶剂强度的变化控制泰乐菌素在小柱上的保留,实验中选用洗脱能力极性由弱到强的甲醇和乙酸乙酯作为洗脱液,但其效果不佳,改换为碱性甲醇后回收效果很好。其可能原因是碱性环境破坏了泰乐菌素的配体结合形式,使其分子极性增强,在C18柱上的保留行为发生改变而容易被洗脱。与C18小柱相比HLB具有强吸附作用,但同时必须以更强洗脱强度的进行洗脱,使用两种SPE小柱的结果无明显差别,因而选用了价格较低的Sep-Vac C18柱进行试验。
4 结论
本文建立了一种超高效液相色谱-串联质谱(UPLC-MS/MS)法对猪血清中泰乐菌素进行检测,通过对检测指标的考察,试验方法检测限达到0.2 ng·mL-1,有较好的准确度和精密度,方法回收率符合检测要求。本方法样品的提取和净化操作简单,可以对血清中微量泰乐菌素进行快速鉴别和测定。能够建立一种快速、简单、廉价、高效和严格的方法来检测猪血清中的泰乐菌素残留情况,并为药物代谢动力学提供了可靠的检测方法。
[1] Blackwell P A,Holten,Lützh ft H C,et al.Ultrasonic extraction of veterinary antibiotics from soils and pig slurry with SPE clean-up and LC-UV and fluorescence detection[J].Talanta,2004,64(4):1058-1064.
[2] Leal C,Codony R,Compa ó R,et al.Determination of macrolide antibiotics by liquid chromatography[J].J Chromatogr A,2001,910(2):285-90.
[3] 李俊锁,邱月明,王超.兽药残留分析[M].上海:上海科学技术出版社,2002:413-458.
[4] Youn-Hwan Hwang,Jong-Hwan Lim,Park BK,etal.Simultaneous determination of various macrolides by liquid chromatography/mass spectrometry[J].Journal ofVeterinary Science,2002,1(2):103-108.
[5] Granja,R.Nino,A.Zucchetti.R.Determination of erythromycin and tylosin residues in honey by LC/MS/MS.[J].Journal of Aoac International,2009,92(3):975-980.
[6] Benetti C,Dainese N,Biancotto G,et al.Development and validation of a method to quantify and confirmtylosin residues in honey using liquid chromatography-tandem mass spectrometric detection.[J].Analytica Chimica Acta,2004,520(1):87-92.
[7] M.Herrera,H.Ding,R.McClanahan,etal.Quantitative determination of tilmicosin in canine serum by high performance liquid chromatography-tandem mass spectrometry[J].J Chromatography B,2007,857(1):9-14.
[8] 徐锦忠,吴宗贤,杨雯筌,等.液相色谱-电喷雾串联质谱测定蜂蜜中8种大环内酯类药物残留[J].分析化学,2007,35(2):166-170.
[9] Dubois M,Fluchard D,Sior E,et al.Identification and quantification of five macrolide antibiotics in several tissues,eggs and milk by liquid chromatography-electrospray tandem mass spectrometry[J].J Chromatogr B,2001,753(2):189-202.
[10] Draisci R,Palleschi L,Ferretti E,et al.Confirmatory method for macrolide residues in bovine tissues by micro-liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2001,926(1):97-104.
[11] Codony R,Compano R,Granados M,et al.Residue analysis of macrolides in poultry muscle by liquid chromatographyelectrospray mass spectrometry[J].Chromatogr A,2002,959(1-2):131-41.
