民猪群体氟烷基因频率检测及序列多态性分析
2011-08-08王希彪黄宣凯兰晓明刘建明
魏 巍,王希彪,黄宣凯,张 野,兰晓明,刘建明,暴 国
(东北农业大学动物科学技术学院,哈尔滨 150030)
1991年Fujii发现猪应激综合症(Porcine stress syndrome,PSS)是兰尼定受体基因(Ryanodine recetor gene RYR1)突变所致[1],此突变是隐性突变,并认为此突变基因即为氟烷隐性基因(Haln)。PSS易导致猪应激而突然死亡或产生PSE肉[1],给养猪业造成巨大的经济损失,美国每年约损失2.3~3.2亿美元[2]。研究表明Haln基因对猪的胴体性状呈加性效应[3],可使猪胴体重增加2%~3%,但又会减少窝产仔数和增加PSE肉的发生率[4-5]。
我国地方猪种携带Haln基因较少,李来记报道的二花脸猪Haln基因的频率为0.57%、民猪Haln基因的频率为15.62%、五指山和香猪Haln基因的频率为0;陈蕴颖等报导的内江猪、版纳猪和五指山小耳猪Haln基因的频率也为0;方美英报道的姜曲海猪、内江猪、桃园猪和香猪Haln基因的频率为0,民猪Haln基因的频率为10%[6-8]。近年来对中国地方猪种Haln基因的研究,越来越多的采用测序的方法,如赵中权等分析了藏猪Haln基因序列及其多态性[9];李来记等对二花脸、香猪MHS基因的DNA序列进行了比较[10];帅素容等分析了内江猪、太湖猪、成华猪和雅南猪Haln基因序列并与国外猪种做了对比分析[11],而民猪在此方面的研究一直未见报道。民猪具有抗逆性强、肌内脂肪含量高、肉质优良、高繁殖力等优点,其优良特性引起海内外的重视[12],在世界地方猪种排行榜中名列第四位[13],2000年将其列入国家畜禽品种保护名录[14]。因此本文对Haln基因在民猪群体中的分布进行了检测并测定了民猪Haln基因的序列,为合理利用Haln基因和民猪选种选配提供理论依据。
1 材料与方法
1.1 试验材料
试验样品采自黑龙江省兰西县民猪保种基地,共48头民猪个体。另外还查找了国内外不同品种猪Haln基因的相同区段,序列来源与编号见表1。
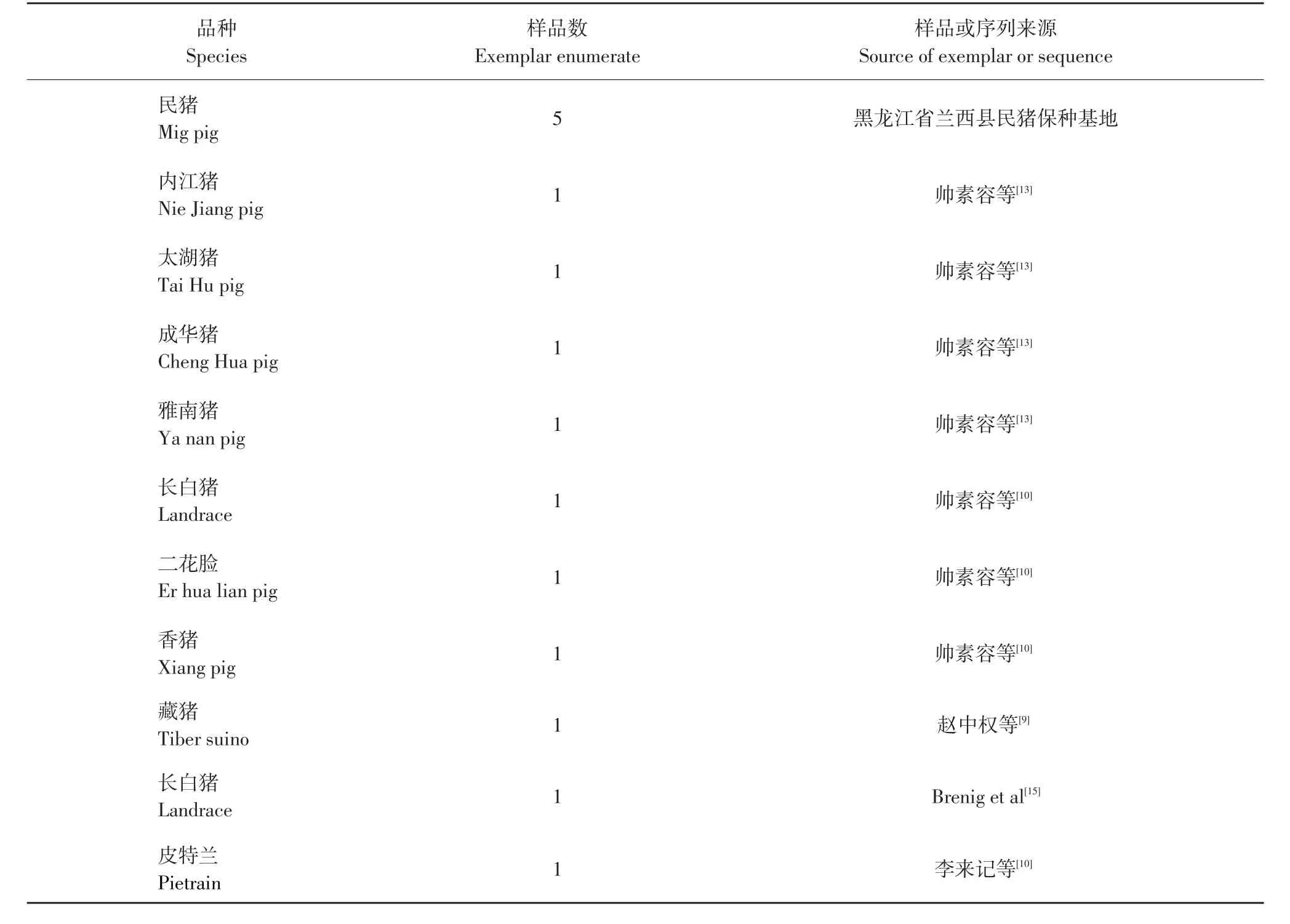
表1 试验样品或序列来源Table 1 Source of experimental samples or sequences
1.2 方法
1.2.1 取样
用耳号钳采集少量耳组织,装入盛有75%酒精的离心管中,带回实验室-20℃保存备用。
1.2.2 DNA提取
1.2.2.1 配制裂解液
试验用裂解液为本实验室改良的配方,100 mL猪耳组裂解液的配制方法如下:1 mol·L-1Tris-Cl(pH 8.0)5 mL,0.5 mol·L-1EDTA(pH 8.0)20 mL,2 mol·L-1NaCl 5 mL,10%SDS 10 mL,1%Pr-k 1 mL。
1.2.2.2 基因组DNA的提取
蒸馏水清洗耳组织并剪碎→55℃过夜消化耳组织→加入等体积的酚∶氯仿∶异戊醇=25∶24∶1混合液,颠倒萃取20 min→4 ℃,7 500 r·min-1离心10 min,取上清液至一干净的1.5 mL离心管中→加入等体积的酚:氯仿∶异戊醇=25∶24∶1混合液,颠倒萃取20 min→4 ℃,7 500 r·min-1离心10 min,取上清液至一干净的1.5 mL离心管中→加入等体积的氯仿∶异戊醇=24∶1混合液,颠倒萃取20 min→4℃,7 500 r·min-1离心10 min,取上清液至一干净的1.5 mL离心管中→加入2倍体积的预冷的无水乙醇,-20℃放置30 min→4 ℃,12 000 r·min-1离心15 min,弃上清→加入2倍体积的预冷的75%乙醇,4℃,12 500 r·min-1离心5 min;弃上清→晾干后,加入100 mL 0.1×TE,55℃溶解DNA→-20℃保存备用。
1.2.2.3 基因组DNA的检测
用1.0%Agarose凝胶电泳检测DNA的完整性,用紫外分光光度计测定其在OD260和OD280的光度值,通过OD260/OD280计算原液的纯度,通过OD260×稀 释 倍 数 ×50(ng·mL-1)计 算 原 液 浓度,-20℃保存DNA原液。
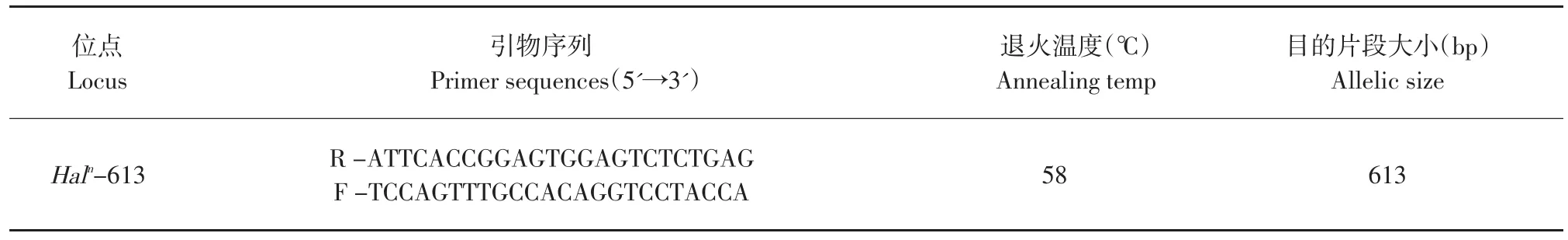
表2 引物序列、退火温度及目的片段大小Table 2 Sequences,annealing temperature and size of motive frag
1.2.3 Haln基因的PCR扩增
引物序列采用Fujii等的研究成果[1],由上海生物工程技术服务有限公司合成,具体信息见表2。
PCR扩增反应液(25 μL)组成如下:基因组DNA(100 ng·μL-1)2 μL,dNTP(2.5 mmol·mL-1) 2 μL,10×buffer 2.5 μL,Haln-613-F(10 pmol·mL-1)1 μL,Haln-613-R(10 pmol·mL-1)1 μL,Taq酶(5 U·μL-1)0.4 μL,加水补足至25 μL。PCR反应程序:95℃ 5 min,30×(95℃ 45 s,58℃ 30 s,72℃45 s,72℃10 min,4℃保存。取PCR产物于1.2%Agarose凝胶电泳,切取600 bp左右处的片段,回收纯化目的DNA,送至上海生物技术服务有限公司测序。
1.2.4 酶切
采用Hha Ι内切酶对扩增的Haln基因613 bp片段进行酶切,酶切反应体系组成如下:Hha Ι(10 U·μL-1)限制性内切酶 0.35 μL,10×buffer 2 μL,PCR产物5 μL,ddH2O补足至10 μL。酶切反应条件:37℃水浴4 h[16]。酶切产物用1.2%Agarose凝胶电泳,GoldView(GD)染色、凝胶成像仪成像拍照分析。
1.3 统计分析
用BioEdit等软件分析所测样本的序列,并与其他10个品种(系)的Haln基因相比寻找突变位点。
2 结果与分析
2.1 基因组DNA提取结果
从猪耳组中提取的基因组DNA浓度约为2 735 ng·μL-1,其纯度在1.7~1.9范围之内,1%Agarose凝胶电泳图谱中观察,是一条光滑整齐的条带(见图1)。

图1 DNA电泳图谱Fig.1 Electrophoresis pattern of DNA
2.2 Haln-PCR扩增结果
经PCR特异性扩增的目的片段全长为613 bp,由电泳图谱可见无杂带(见图2)。
2.3 Haln-Hha I酶切结果
结果见图3。
PCR产物经限制性内切酶Hha Ι消化获得的Haln基因座位3种基因型的特征带型为:HalNHalN(NN)为500 bp和113 bp 2条带;HalNHaln(Nn)613 bp、500 bp和113 bp 3条带;HalnHaln(nn)只有1条613 bp带(见图3和表3)。
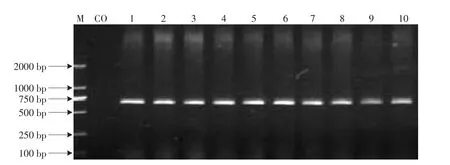
图2 Haln基因PCR扩增产物1%琼脂糖凝胶电泳图Fig.2 Electrophoresis pattern of PCR products of halothane gene

图3 民猪Haln基因PCR产物Hha I酶切电泳Fig.3 Electrophoersis pattern of Hha I-RFLP of halothane gene's PCR products in Min pig

表3 民猪群体的Haln基因座位的基因型频率和基因频率Table 3 Genotypic frequency and gene frequency in halothane gene of Min pigs
2.4 PCR产物序列分析
对HalNN型民猪、太湖猪、内江猪、成华猪、雅南猪、长白猪、二花脸、香猪、藏猪、长白猪和皮特兰猪的含C1843在内的614 bp Haln基因片段进行了序列分析与品种(系)间的比较,民猪Haln基因序列如下(见图4和表4)。

图4 民猪Haln基因PCR产物序列Fig.4 Sequence of PCR products of halothane gene in Min pig
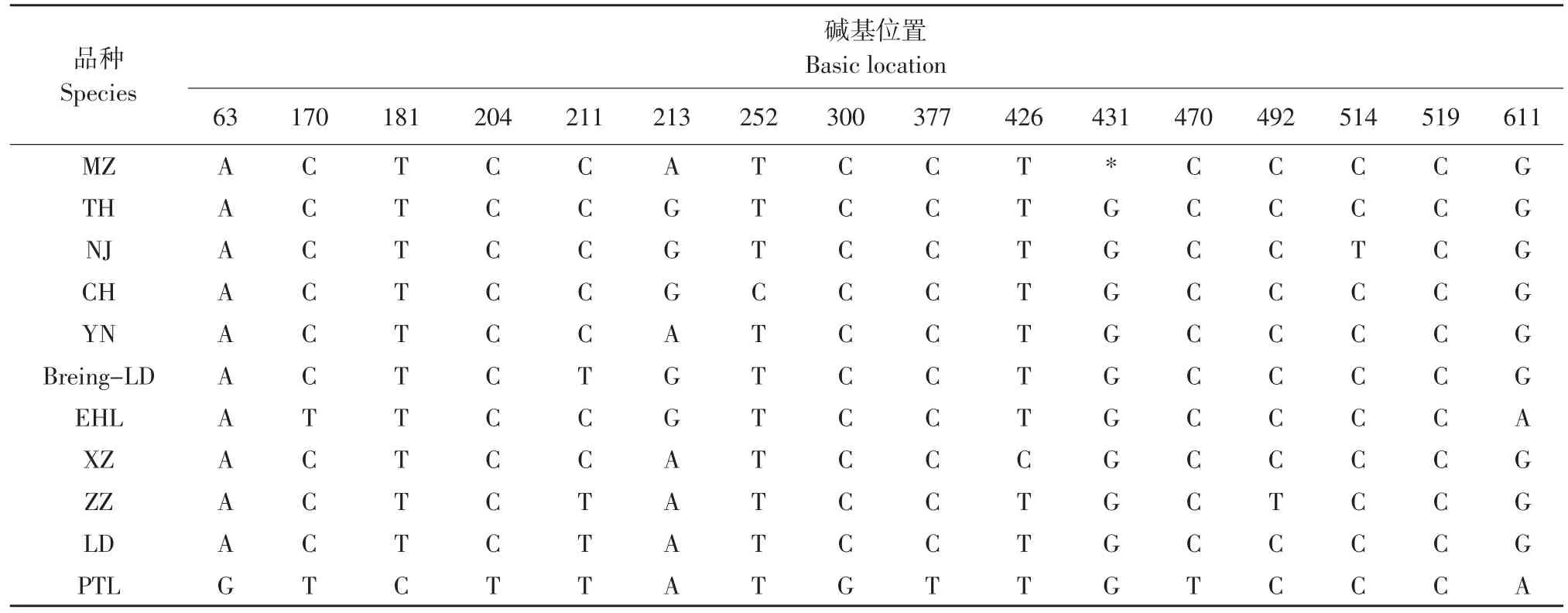
表4 11个品种猪Haln基因部分片段DNA序列变异位点Table 4 Mutation sites in Halngene amino acid sequence of 11 varieties pigs
3 讨论
自Fujii等确定了猪Haln基因的核苷酸序列和突变位点以来[1],PCR-RFLP技术检测Haln基因型变得日趋完善[17],有的国家已建立了猪Haln基因的DNA检测方法[18-20],并在大范围内对猪育种群体进行了Haln座位的基因型分析[18],对有效控制猪群的Haln基因频率起到了重要的作用[20]。虽然我国Haln基因DNA检测技术和分子生物学分析刚刚起步,但随着国外优良品种的引入和我国猪遗传改良的进一步深入,以及瘦肉品种、品系的培育,Haln基因的研究将引起重视,并将得到应用和发展。
3.1 不同品种猪Haln基因座位的基因频率
本研究中民猪的Haln基因频率与国内报道有一定的差异,比方美英(10%)[8]、李来记(15.62%)[10]报道的Haln基因频率稍大,这可能是由于随机抽样,隐性Haln基因的样本过于集中,使试验数据较高;或者是由于该样本处于保种群体中,长期的近交使得Haln基因频率增加。Fujii等证明了长白、杜洛克、皮特兰等品种的Haln基因具有同一起源[1],而关于民猪Haln基因的起源还未被证实,有待进一步研究。
3.2 不同品种Haln基因序列的种间差异
Fujii等通过对皮特兰猪和约克夏猪的HalncDNA全序列比较[1],发现18个单碱基的差异。本文通过对不同品种(系)Haln基因序列比较分析,发现不同品种(系)间Haln612序列存在差异:皮特兰猪C1843→T1843;皮特兰A1437→G1437;二花脸和皮特兰C1544→T1544;皮特兰 T1555→C1555;皮特兰 C1582→T1582;长白-Brenig、藏猪和长白C1585→T1585,太湖猪、内江猪、成华猪长白-Brenig和二花脸A1588→G1588;成华猪 T1626→C1626;皮特兰 C1674→G1674;皮特兰 C1751→T1751;皮特兰 C1800→T1800;皮特兰 C1844→T1844;内江猪C1888→T1888;二花脸和皮特兰G1981→A1981。在所比较的11个猪品种(系)间Haln基因的DNA序列差异均为单核苷酸的替换,未发现多碱基和大片段的插入、缺失和移框突变。除Fujii等确定的C1843→T1843的突变造成氨基酸替代(Arg615→Cys615)与猪PSS有关外,其他的引起氨基酸改变的碱基突变与猪PSS的关系还有待证实[1]。而本研究中所发现的品种间13个突变大部分可能属于品种特异性改变,与猪PSS的发生是否有关还有待进一步分析。
4 结论
本试验通过PCR-RFLP方法检测了民猪群体中Haln基因的基因型频率和基因频率,结果表明民猪在长期的保种过程中HalnHaln型基因频率有所增加,n基因频率稍有升高。在比较民猪与其他品种猪Haln基因序列的区别时,发现皮特兰与民猪的差异最大,内江猪与民猪的差别最小。这个结果可以很有效的说明皮特兰猪肉质较差,而民猪肉质较好的原因。在实际生产中Haln基因给猪肉生产者和猪肉加工者带来了巨大的损失,因此,通过遗传育种选育抗应激的猪种具有实际意义。
[1] Fujii J,Otsu K and Zorzato F,et al.Identification of a mutation in porcine ryanodine receptor associated with malignant hyperthermia[J].Scinece,1991,253:448-451.
[2] Brening B,Brem G.Molecular clocuing and analyais of the potcine"haloinabane"gene[J].Areh Tiera Dummeratcaf,1992,3215:129-135.
[3] 赵秀娟,帅素容.氟烷基因研究进展概述[J].畜禽业,2002(7):10-12.
[4] 蒋思远,熊远著,邓昌彦,等.猪氟烷基因与成产性状关系的初步研究[J].中国畜牧杂志,1995(5):20-21.
[5] 蒋思远,熊远著,邓昌彦,等.猪RYR1基因的PCR-RFLP分析和氟烷基因利用的研究[J].中国畜牧杂志,1997,33(2):9-10.
[6] 李来记.猪MHS基因分子遗传学基础与应用研究[D].北京:中国农业大学,1996.
[7] 陈蕴颖,步宏,李幼平,等.中国内江猪的氟烷基因型[J].华西医科大学学报,1999,30(2):117.
[8] 方美英,姜志华,刘红林,等.不同猪种中氟烷基因频率调查分析[J].浙江农业大学学报,1999,11(3):145-147.
[9] 赵中权,帅素容,杨显彬,等.藏猪氟烷基因PCR-RFLP和序列多态性分析[J].农业生物技术学报,2008,16(1):51-54.
[10] 李来记,张沅,李宁.猪恶性高热综合征(MHS)基因群体检测及部分片段DNA序列研究[J].中国畜牧兽医学报,1996,16(6):540-545.
[11] 帅素容,李学伟,赵秀娟,等.中国6个地方猪种与3个外种猪氟烷基因PCR产物序列比较研究[J].中国畜牧杂志,2005,41(2):12-15.
[12] 中国猪品种志.中国猪品种志[M].上海:上海科学技术出版社,1986.
[13] 郑兆利,王亚波,高健,等.民猪的杂交利用及产品开发的研究[J].中国猪业,2006,24(5):90-91.
[14] 农业部.国家级畜禽品种资源保护名录[S].北京中国畜牧兽医信息网,2001.
[15] Brenig B,Brem G.Genomic organization and analysis of 5’end of the porcine ryanodine receptor gene(yry1)[J].FEBS Letter,1992,298(2-3):277-279.
[16] Nakajima E,Matsumoto T,Yamada T,et al.Technicai note:use of a PCR-RFLP for detection of a point mutation in the swine ryanodine receptor(RYR1)gene[J].J Anim Sci,1996,74:2904-2906.
[17] Qtsu k,Philips M,Khanna V.Refinement of diagnostic assays for a probable causal mutation for porcine and human malignant hyperrhermin[J].Genomics,1992,13:835-836.
[18] Hughes I,Moran C,Nicholas F.PCR genotypiag of the rynnodine receptorgene forputative causalmutatton formalignant hyperthermta in Australian pig[J].J Anim Breed Genet,1992,109:466-476.
[19] Zhang X,Shen H,Cory C,et al.Demonstratron of the mutation associated wtth porcme stress syndrome[M].Ohnishi S T,Ohnishi T A genete membrane drsease.Boca Raton:CRC Press,1994:273-292.
[20] Dicksou D.DNA testmg helps British brtng better pig to market[J].Nature,1993,22(3):662-688.
