猪ATIC基因SNPs位点分析和表达规律的研究
2011-08-08李金玲李海涛高丽峰杨秀芹
李金玲,李海涛,高丽峰,杨秀芹,刘 娣,2*
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.黑龙江省农业科学院,哈尔滨 150086)
猪肉是我国最主要的食用肉类。近几年来,随着人们生活水平的不断提高,消费者对猪肉产品的要求也逐渐从量向质转变,猪肉肉质的风味、营养和安全成为了人们评定猪肉品质的重要标准。目前,国内外大量研究表明,氨基酸(谷氨酸和甘氨酸效果最明显)、肌苷酸和肌内脂肪与肉质风味密切相关。其中,肌苷酸是构成肌肉鲜味和香味的主要成分之一[1],其鲜味强度是等量谷氨酸钠的30倍[2]。目前,国际上已把肌苷酸含量作为影响肉质的重要指标[3-4]。因而影响肌苷酸生成的各种基因都是肉质性状潜在的候选基因。
ATIC基因是编码肌苷酸合成十步反应中最后两步反应的酶基因。1995年Broad将绵羊的ATIC基因定位于2号染色体上[5]。人类的ATIC基因cDNA全长1 776 bp[6]。ATIC基因已在家鸡中进行了较为深入的研究。Ni等克隆了鸡ATIC基因的cDNA序列,全长2.3 kb[7]。本研究拟在分子水平上对民猪、北京黑猪、大白猪和长白猪的ATIC基因进行研究,探讨不同品种猪之间风味特性的差异与ATIC基因的关系,为寻找与猪肉风味品质性状紧密连锁的有效分子遗传标记奠定基础。
1 材料与方法
1.1 材料
长白猪65头、大白猪84头均来自东北农业大学原种猪培育中心;北京黑猪50头来自大庆采油四场猪场;东北民猪30头来自黑龙江省兰西种猪场。
1.2 方法
1.2.1 样品的采集、基因组DNA和总cDNA的制备
民猪、北京黑猪、大白猪、长白猪4个猪种的基因组DNA样品为实验室保存样品。3头民猪购自黑龙江省农业科学院畜牧研究所,对其进行断颈宰杀,采集子宫、背肌、肠、肺、脾脏、肝脏、心脏、脂肪、腿肌共9种组织和器官样品。按照Trizol Reagent总RNA提取试剂盒操作说明提取这9种组织的总RNA,利用Promega公司的RQ1 RNase-Free DNase处理提取的总RNA,排除基因组DNA的影响,利用紫外分光光度计测定总RNA的浓度和纯度,利用1.4%变性琼脂糖凝胶电泳检测总RNA的质量,PrimeScript RT reagen Kit说明书方法反转录成cDNA。
1.2.2 引物的设计
根据GenBank上发表的人ATIC基因的DNA序列(GenBank No:NC_000002)和猪 mRNA序列(GenBank No:NM_001130736)进行比对,找到ATIC基因的外显子6,并设计PCR-SSCP多态性分析引物P1F/P1R;根据ATIC基因的mRNA序列设计Real time PCR扩增引物C1、C2,引物的相关信息见表1。

表1 引物相关信息Table 1 Information of primers
1.2.3 多态性检测
以民猪、北京黑猪、大白猪、长白猪共214头个体DNA为模板;进行PCR-SSCP反应,凝胶浓度为18%;电泳结束后,进行银染,显色。
1.3 ATIC基因的表达分析
1.3.1 Real-time PCR反应体系的建立
根据宝生物工程(大连)有限公司的SYBR®Premix Ex TaqTM II试剂盒构建20 μL反应体系,采用两步法Real-time PCR反应程序,每个样本重复3次,根据标准曲线以及荧光曲线Ct值计算定量结果。
1.3.2 定量标准曲线的绘制
分别取已制备的猪9种组织cDNA样品(50 ng·μL-1)各1 μL进行混合,利用宝生物工程(大连)有限公司的EASY Dilution试剂按10倍浓度梯度稀释为5、500、50、5、0.5 pg·μL-1。分别取 2 μL,对1 pg~100 ng的cDNA制作标准曲线。
1.3.3 数据分析
BLAST方法进行同源性比对,使用SPSS软件进行t检验和χ2检验、用PIC_Calc 0.6软件进行PIC值计算。
2 结果与分析
2.1 PCR-SSCP检测结果
P2F/R引物的扩增产物经PCR-SSCP检测后,共发现三种基因型,两种纯合型分别命名为AA、BB。对两种纯合型个体进行克隆测序发现,A等位基因在452、477、488 bp处的核苷酸分别为A、A、G;B等位基因在452、477、488 bp处的核苷酸分别为G、G、A(见图1)。
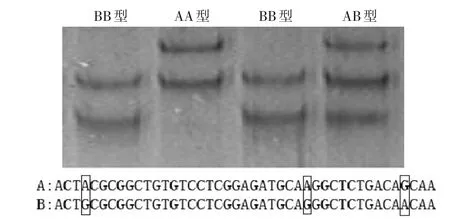
图1 PCR-SSCP电泳图谱Fig.1 PCR-SSCP electrophoresis pattern
2.2 群体遗传学分析
针对以上PCR-SSCP检测结果,分析各基因型在北京黑猪、长白猪和大白猪等猪种中的分布规律。各品种的检测个体数、基因型频率、基因频率、多态信息含量(PIC)等统计参数值(见表2)。
χ2独立性检验表明在所检测的各多态位点,不同基因型在民猪、北京黑猪、长白猪和大白猪等4个品种间的分布存在极显著差异(P<0.01)。χ2分割检验结果见表3。
2.3 ATIC基因在不同组织中的表达情况
2.3.1 Real-time PCR定量检测民猪9种组织中ATIC基因的表达
经过内参β-actin对猪9种组织中ATIC基因表达量的校正,发现ATIC基因在肝脏、腿肌、肺等组织中表达量较高,按照表达量从高到低依次为:肝脏>腿肌>肺>心脏>脾脏>脊肌>脂肪>肠>子宫,各组织表达谱及统计分析结果(见图2)。

表2 不同品种猪ATIC基因的基因型频率和基因频率Table 2 Allele ferquencies and genotype frequencies of ATIC among different swine breeds
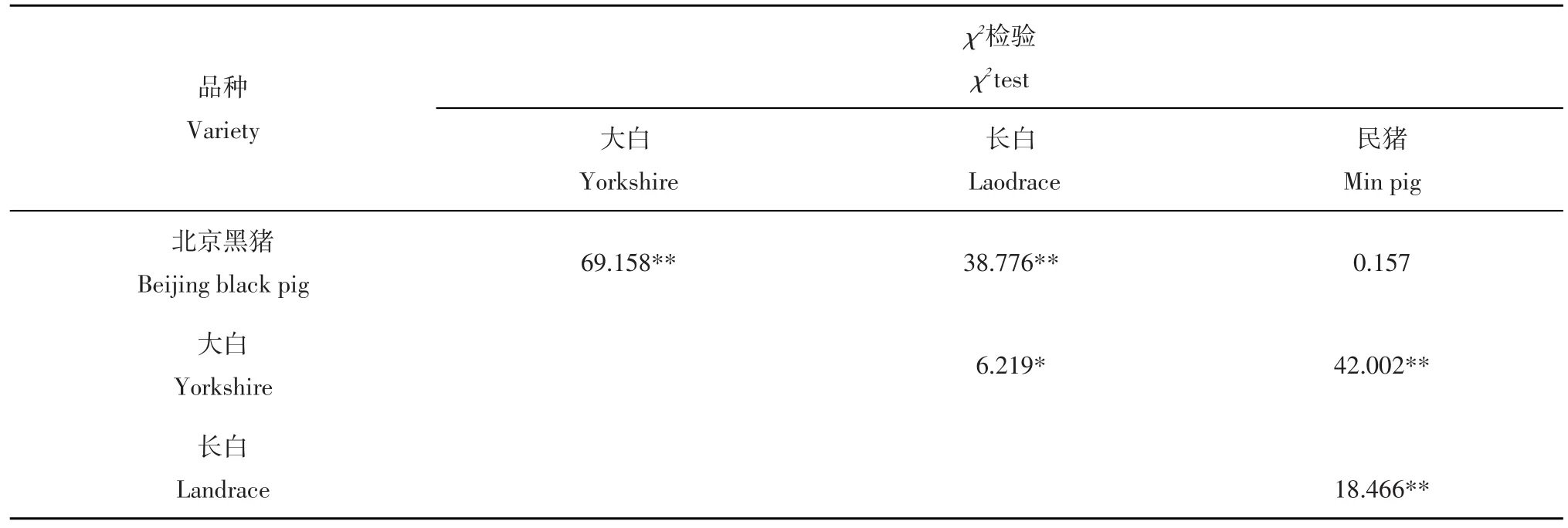
表3 ATIC各基因SNP位点在不同群体中的基因型分布的χ2检验Table 3 Chi-square testing of ATIC gene for genotype distribution of SNPs between breeds
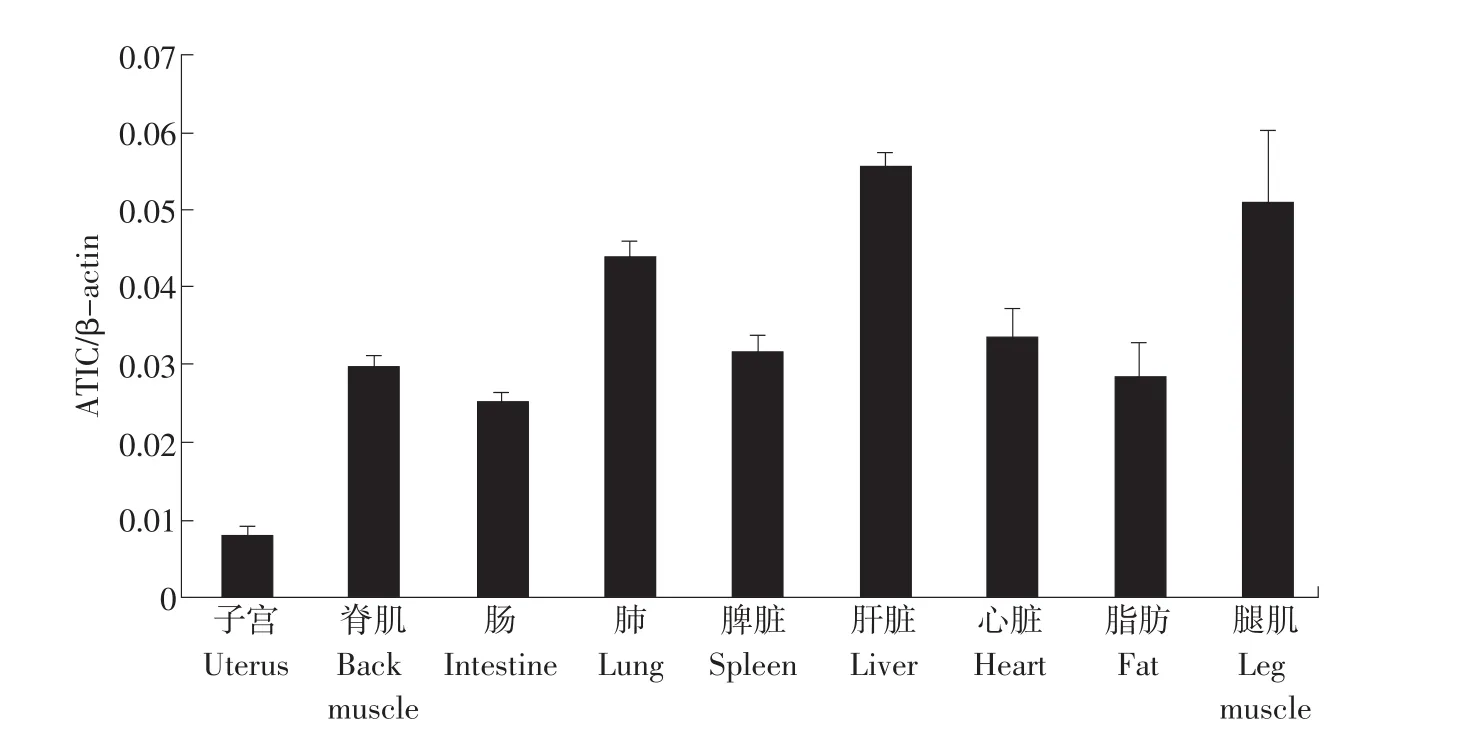
图2 民猪9种组织中ATIC基因的表达情况Fig.2 Expression of ATIC in nine kinds of tissues of pig
3 讨论
肌苷酸合成过程中涉及10种酶,其中ATIC是具有氨基咪唑氨甲酰核苷酸转甲酰基酶和次黄嘌呤核苷酸环水解酶催化活力的双功能酶,并且是唯一一个编码两种酶催化活力的双功能酶[9]。在鸡中对ATIC基因与肉质风味关系研究有很多,研究表明,该基因多态性与肌苷酸含量有关[10]。2005年,刘长青对部分鸡种ATIC基因cDNA全序列进行分子扫描,认为该基因是影响鸡肉风味性状的主效基因或是控制此性状主效基因的连锁标记基因[8];2008年束婧婷对5个鸡种的ATIC基因进行分子扫描,认为该基因可能是控制鸡肉风味性状的主效基因或与主效基因连锁[10]。
本文通过对猪ATIC基因外显子6进行多态位点扫描,并应用PCR-SSCP技术进行遗传学分析,发现不同基因型在民猪、北京黑猪、长白猪和大白猪等4个猪种间的分布存在着极显著差异(P<0.01)。并通过实时荧光定量PCR方法检测了ATIC基因在各组织中的表达差异,研究发现肝脏、腿肌、肺等组织中高表达,其中以肝脏中的表达量最高。从这一结果可以看出,肝脏在肌苷酸合成过程中具有重要的生理作用。
在本试验所检测4个猪种中长白猪和大白猪均以A等位基因为主,其中大白猪没有检测到B等位基因,而我国地方猪种民猪和北京黑猪则以B等位基因为主。多态信息含量(PIC)的分析结果表明长白猪和大白猪均为低度多态(PIC<0.25),而民猪和北京黑猪为中度多态(0.25<PIC<0.5),表明民猪和北京黑猪的遗传基础比较广泛,遗传多样性好于长白猪和大白猪。
在本研究所检测到的三个突变位点中,两处为错义突变,一处为非错义突变,其中452 bp处的错义突变造成了氨基酸极性的改变,由亲水性的半胱氨酸代替了疏水性的酪氨酸。477 bp处为非错义突变,488 bp处的错义突变造成丝氨酸被天冬酰胺替代。
由于缺乏相应个体肌苷酸含量的数据,本研究所得多态位点是否是不同猪种肉质风味差异的影响因素之一尚有待于进一步验证。
[1] 陈国宏,李慧芳,吴信生,等.泰和乌骨鸡肌肉肌苷酸含量变化规律及其遗传力估测[J].扬州大学学报:农业与生命科学版,2002,23(2):29-32.
[2] 陈继兰.鸡肉肌苷酸和肌内脂肪含量遗传规律及相关候选基因的研究[D].北京:中国农业大学,2004.
[3] 岳永生,唐辉.优质肉鸡定量标准的探讨[C].第九次全国动物遗传育种学讨论会论文集,北京:中国农业科技出版社,1997:348-351.
[4] Fuijmura S.Identification of tuste-active component components in the meat of the Japanese native chicken,Hinaidori and broilers and the effent of feeding treatments on taste-active components[J].Animal Food Science,1998,50(2):99-158.
[5] Broad T E,Lewis P E,Burkin D J,et al.Thirteen loci physicallyassigned tosheep chromosome 2 by cell hybrid analysis and in situ hybridization[J].Mammalian Genome,1995,6(12):862-866.
[6] Elizabeth A,Rayl Barbara A.The human purH gene product,5-aminoimidazole-4-carboxamide ribonucleotideformyl-transferase/IMPcyclohydrolase.Cloning,sequencing,expression,purification,kinetic analysis,and domain mapping[J].Journal of Biological Chemistry,1996,271(4):2225-2233.
[7] Ni L,Guan K,Zalkin H,et al.De novo purine nucleotide biosynthesis:cloning,sequencing and expression of a chicken PurH cDNA encoding 5-aminoimidazole-4-carboxamide-ribonucleotide transformylase-IMP cyclohydrolase[J].Gene,1991,106(2):197-205.
[8] 刘长青.山东地方鸡种风味特性的候选基因ADSL和ATIC的研究[D].曲阜:曲阜师范大学,2005:56-66.
[9] 张海艳,于太永,关伟军.肌苷酸形成机理及其含量影响因素浅析[J].山西:山西农业大学,2004,6(3):17-21.
[10] 束婧婷.鸡肌苷酸候选基因遗传效应及表达规律研究[D].扬州:扬州大学,2008:78-79.
