大蒜素对白色念珠菌感染的免疫抑制小鼠IL-4和IgG产生水平的影响
2011-08-07胡国伟
胡国伟,董 群
(皖南医学院 微生物学与免疫学教研室,安徽 芜湖 241002)
白色念珠菌是医院真菌感染最常见的致病菌,可引起人类皮肤黏膜、内脏各系统感染。近年来,由于免疫抑制剂的大量应用,肿瘤放疗、化疗、侵入性治疗、器官移植的开展,以及滥用广谱抗生素导致的菌群失调,白色念珠菌的感染率较以往有明显增加[1]。目前,治疗深部真菌感染药物为化学性药物,但在长期治疗和重复给药过程中容易引起耐药菌株的出现,而且具有不同程度的副作用。实验证明大蒜素具有广谱抗微生物的活性,包括抗细菌活性、抗真菌活性,尤其抗白色念珠菌具有抗寄生虫和抗病毒的活性[2,3]。我们通过观察大蒜素对白色念珠菌感染模型鼠脾细胞IL-4、血清IgG产生水平的影响,进一步探讨其预防和治疗白色念珠菌的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康BALB/C雄性小鼠30只,6~8周龄,体量20~22 g,由南京市江宁区青龙山动物繁殖场提供,动物合格证号:SCXK(苏)2008.0010。
1.1.2 供试菌株 本实验使用的白色念珠菌(Candida.Albicans,C.albicans)标准菌株购自广州市微生物研究所。
1.1.3 药物及试剂 大蒜素胶囊购自江苏正大清江制药有限公司;环磷酰胺购自山西普德药业有限公司;小鼠IgG检测试剂盒购自南京凯基生物科技发展有限公司;小鼠IL-4试剂盒购自南京欣博盛生物科技发展有限公司;Biospin真菌基因组DNA提取试剂盒购自大连宝生物科技发展有限公司;引物1,2[4]:根据真菌内转录间隔区(ITS)设计通用引物一对,由大连宝生物技术有限责任公司合成,ITS1:5'-tccgtaggtgaacctgcgg-3',ITS4:5'-tcctccgcttattgatatgc-3'。
1.1.4 仪器 二氧化碳(CO2)恒温培养箱(上海市跃进医疗器械一厂,型号:TC 2323型);酶标仪(郑州博塞生物工程有限责任公司,型号:2000型);高速冷冻离心机(上海良平仪器仪表有限公司);PCR仪(英国Techne公司),Gel Doc1000凝胶成像系统(Bio Rad公司),电泳仪(Bio Rad公司)。
1.2 方法
1.2.1 白色念珠菌培养及菌液的制备 将白色念珠菌标准菌株接种到改良沙氏(Sabourand's)固体培养基上(1 L蒸馏水中加入葡萄糖40 g,蛋白胨10 g,琼脂18 g,高压灭菌112℃ 15 min,待培养基冷却至50℃左右时加入青霉素20 U/ml,链霉素40 U/ml),37℃细胞培养箱中培养48 h后,经无菌生理盐水洗下制成菌悬液,血球计数板调整菌液浓度为2×107/ml,4℃冰箱保存备用。
1.2.2 小鼠免疫力低下模型的建立[5]30只小鼠实验前3 d腹腔一次性注射环磷酰胺200 mg/kg,每只0.2 ml,制备免疫力低下小鼠模型。
1.2.3 实验分组及处理 将30只免疫力低下小鼠随机分为3组,每组10只。预防组小鼠每天灌服1次 25 mg/(kg·d)大蒜素 0.4 ml×7 d,其余两组灌服等量生理盐水7 d;第8天各组小鼠尾静脉接种2×107/ml白色念珠菌菌液0.2 ml,同时给予预防组和治疗组分别灌服25 mg/(kg·d)大蒜素0.4 ml×7 d,感染组灌服等量生理盐水7 d。
1.2.4 小鼠脾细胞悬液的制备 无菌取出各组脾脏。将脾脏置入无菌平皿中的不锈钢筛网(100目/cm2)上,加入5 ml Hanks液,用玻璃注射器针芯充分研磨,经网制成单细胞悬液,1 000 rpm离心10 min,弃上清,加Tris-NH4Cl 2 ml吹打去除红细胞,不完全RPMI-1640液洗2次,再用完全RPMI-1640液充分重悬细胞,即为脾细胞悬液。
1.2.5 用双抗体夹心ELISA法测定小鼠脾细胞悬液IL-4水平以及血清IgG的水平 具体操作严格按试剂盒说明书程序进行。
1.2.6 白色念珠菌DNA的抽提 各组小鼠于尾静脉注入白色念珠菌液次日分别摘眼球取血,严格按照Biospin真菌基因组DNA提取试剂盒说明书提取DNA。
1.2.7 白色念珠菌引物扩增的实验 用设计的白色念珠菌引物对各样本进行PCR扩增并均采用50 μl反应体系,反应体系为:10×反应缓冲液5 μl;DNA 模板 2 μl;Taq 酶(5 U/μl)0.2 μl;dNTP mixture(2.5 mmol/L)4 μl;引物各 2 μl;其余为双蒸水。PCR条件为:94℃预变性5 min;94℃变性1 min,50℃退火1 min,72℃延伸7 min,35个循环;反应结束后,产物于4℃保存,等待电泳。
1.2.8 PCR扩增产物检测 取各扩增产物8 μl与2 μl上样缓冲液(4∶1)混匀后,依次点样于1%琼脂糖凝胶上(含 EB 0.5 μg/ml),在1×TAE 电泳缓冲液中进行电泳,以DL-2000为分子量标准,5 V/cm电压电泳。当溴酚兰至适当位置后,切断电源,在紫外线和BIO-RAD凝胶成像分析系统上进行分析和拍照。
2 结果
2.1 免疫抑制模型小鼠的建立 小鼠经注射环磷酰胺后均无自然死亡现象,次日各组小鼠出现喜静、少动、饮食明显减少、多尿、皮毛欠光滑等现象,与临床上免疫力低下患者纳差、消瘦、懒动乏力等症状相似。
2.2 白色念珠菌感染模型鼠的建立 无菌条件下,取出各组小鼠的血液标本。按照前述的方法,分离、抽提白色念珠菌DNA和PCR扩增,于1%琼脂糖凝胶上检测。结果显示除阴性对照未见条带外,其余各样本均可扩增出分子量大小约为500 bp特异性条带。见图1~3。
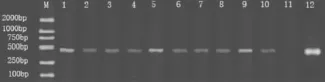
图1 预防组小鼠PCR扩增产物电泳图Fig 1 Eelectropherogram of PCR products in preventive group

图2 治疗组小鼠PCR扩增产物电泳图Fig 2 Eelectropherogram of PCR products in treatment group

图3 感染组小鼠PCR扩增产物电泳图Fig 3 Eelectropherogram of PCR products in infective group
2.3 小鼠脾细胞悬液IL-4水平 由表1可见,预防组与感染组比较,IL-4水平增高显著,两组之间差异显著(P<0.01)。治疗组与感染组比较,IL-4水平增高显著,两组之间差异显著有统计学意义(P<0.01)。预防组和治疗组之间IL-4水平比较,也有明显的统计学意义(P<0.01)。
表1 各组小鼠脾细胞悬液IL-4水平(±s)Tab 1 IL-4 level of cultural liquid of spleen cells for each group(±s)

表1 各组小鼠脾细胞悬液IL-4水平(±s)Tab 1 IL-4 level of cultural liquid of spleen cells for each group(±s)
两两比较采用q检验,两组间字母不同表示P<0.05;两组间字母相同表示P﹥0.05
组别 n IL-4表达水平(pg/ml) F值 P值预防组 10 26.51 ±1.45a治疗组 10 17.29±1.23b 405.70 <0.01感染组 10 10.45 ±1.09c
2.4 小鼠血清IgG水平 由表2可见,预防组与感染组比较,IgG水平增高显著,两组之间差异有显著统计学意义(P<0.01)。治疗组与感染组比较,IgG水平增高显著,两组之间差异有显著统计学意义(P<0.01)。预防组和治疗组之间IgG水平比较,也有明显统计学意义(P<0.01)。
表2 各组小鼠血清IgG水平(±s)Tab 2 Serum level of IgG for each group(±s)

表2 各组小鼠血清IgG水平(±s)Tab 2 Serum level of IgG for each group(±s)
两两比较采用q检验,两组间字母不同表示P<0.05;两组间字母相同表示P>0.05
组别 n IgG表达水平(pg/ml) F值 P值预防组 10 0.2106 ±0.0248a治疗组 10 0.1589±0.0158b 54.05 <0.01感染组 10 0.1169 ±0.0145c
3 讨论
白色念珠菌是寄居在正常人体消化道、呼吸道和女性生殖道黏膜的正常菌群,一般不致病,仅在长期的粒细胞减少、血液系统恶性肿瘤、长期应用糖皮质激素、骨髓移植或实体器官移植及AIDS等情况下致机体免疫力减弱时,大量白色念珠菌的入侵可能发病。有资料表明应用生物反应调节剂(Biological Response Modifer,BRM)防治深部真菌感染是可行的方法。传统BRM如BCG、IL2、转移因子等均存在着程度不同的毒副作用及价格较昂贵等缺点,使之在临床应用上受到一定的限制。而大蒜是百合科葱属植物蒜地下鳞茎,主要功效成分是蒜氨酸,具有广谱抗菌消炎作用,我室前期的研究[6~9]已证实其具有提高机体细胞免疫功能等作用,但对体液免疫功能有无影响尚不知。
IgG是体液免疫应答产生的一种最主要保护性抗体,血清中含量最高,半衰期长,在机体防御机制中发挥抗感染、中和毒素及调理作用,且有保护黏膜的作用[10]。IL-4由T细胞产生能促进B细胞的增殖、分化和抗体的生成,可增强B细胞介导的体液免疫应答,因此,IL-4又称B细胞生长因子(B cell growth factor,BGCF)。本实验将大蒜素经口灌服小鼠,观察体液中IgG、IL-4含量的变化。结果发现,大蒜素能提高治疗组和预防组小鼠IgG和IL-4水平,尤以预防组的效果最明显,提示大蒜素亦可增强体液免疫功能。
[1]廖万清,吴绍熙.病原真菌生物学研究与应用[M].第1版.北京:化学工业出版社,2006:106-107.
[2]ANKRI S,MIRELMAN D.Antimicrobial properties of allicin from garlic[J].Microbes Infect,1999,11(2):125 -129.
[3]BAKRI IM,DOUGLAS CW.Inhibitory effect of garlic extract on oral bacteria[J].Arch Oral Biol,2005,50(7):645 -651.
[4]GUIVER M,LEVI K,OPPENHEIM BA.Rapid identification of candida species by TaqMan PCR[J].Journal of clinical pathology,2001,54(5):362 -366.
[5]赵喜新,阎杜海,王和平,等.环磷酰胺引致的小鼠白细胞减少模型及动学分析[J].上海实验动物科学,1998,18(1):12-14.
[6]熊延靖,董群.大蒜素抗白色念珠菌感染的免疫学机制[J].中国临床药理学与治疗学,2010,15(8):866-870.
[7]龚钰清,陈悦,任泽久,等.氟康唑胶囊联合大蒜素注射液治疗慢性乙肝重型肝炎合并真菌感染的疗效分析[J].中国现代医学杂志,2006,16(2):276 -280.
[8]徐翼,方峰.大蒜素对小鼠脾细胞TH1/TH2类细胞因子表达的影响[J].云南中医学院学报,2003,26(4):20 -22.
[9]LAMM DL,RIGGS DR.Enhanced immunocompetence by garlic;role in bladder cancer an other malignancies[J].J Nutr,2001,131(3):1067-1070.
[10]KANG H,REMINGTON J S,SUZUKI YET,et al.Decreased resistance of Bcell deficient mice to infection with Toxopiasma gondii despite unimpaired expression IFN-gamma,TNF-alpha and inducible nitric oxide synthase[J].J Immunol,2000,164(10):2629 -2634.
