人重组α干扰素联合顺铂诱导骨肉瘤细胞凋亡的研究
2011-08-07陈国富丁婷婷王明丽尹宗生
陈国富,丁婷婷,赵 俊,王明丽,尹宗生
(1.繁昌县人民医院 骨科,安徽 芜湖 241200;2.安徽医科大学 微生物学教研室,安徽 合肥 231001;3.安徽医科大学第一附属医院 骨科,安徽 合肥 231001)
1957年,英国国立医学研究所的Isancs和Lindenman在研究病毒的干扰现象时发现一种可溶性物质,进一步研究表明,这一物质能够抑制多种病毒在细胞内的增殖,于是命其名为干扰素(interfern,IFN)[1]。IFN是在干扰素诱导因素作用下,由细胞的基因控制产生的,具有抗病毒、抗肿瘤和调节免疫反应等一系列作用的高活性、多功能的糖蛋白[2,3]。在干扰素抑制肿瘤的作用中,抑制骨肉瘤的作用是最有成效的。骨肉瘤是临床上最常见的一种恶性骨肿瘤,具有较强的局部侵袭及远处转移的能力。这一特性不但增加了病灶手术切除的难度,而且由于患者出现早期、多发转移而丧失了手术治疗的时机[4,5]。Todesco 等[6]在临床应用干扰素治疗骨肉瘤患者取得了令人鼓舞的疗效。他们总结认为干扰素对肿瘤切除术后残余灶的复发转移具有较好的防治作用。干扰素根据其来源和结构,可将其分为α、β、γ三种类型,近年来,还发现了ω、τ等类型的干扰素。长期以来,人们一直认为IFNγ对肿瘤治疗起主要作用,而IFNα主要起抗病毒作用,但近期越来越多的研究表明IFNα可明显抑制肿瘤细胞的生长。为探讨IFNα在人骨肉瘤细胞增殖中的作用,本研究以体外培养的人骨肉瘤细胞MG-63为研究对象,观察IFNα以及联合应用顺铂对骨肉瘤细胞增殖和凋亡的影响,以期为IFNα治疗骨肉瘤提供实验依据。
1 材料与方法
1.1 试剂 rhIFN-α 购自安科公司,噻唑蓝[3-(4,5-dimethyldiazol-2-yl)-2,5 diphenyl Tetrazolium Bromid,MTT]购自华美生物工程公司,Hoechest 33258购于Sigma公司。
1.2 细胞株及培养 人骨肉瘤细胞MG-63购自中科院上海细胞库。于37℃、5%CO2饱和湿度培养于含10%胎牛血清(杭州四季青生物工程有限公司)DMEM(Gibco公司)中,0.25%胰蛋白酶消化传代。
1.3 实验方法
1.3.1 实验分组 实验分为8组:分别为对照组、10 000 IU/ml rhIFN-α 组、1 000 IU/ml rhIFN-α 组、100 IU/ml rhIFN-α 组、顺铂(5 μg/ml)联合应用10 000 IU/ml rhIFN-α 组、顺铂(5 μg/ml)联合应用1 000 IU/ml rhIFN-α 组、顺铂(5 μg/ml)联合应用100 IU/ml rhIFN-α 组、单独应用顺铂(5 μg/ml)组。1.3.2 MTT法检测细胞增殖活性 将浓度为2×104个/ml骨肉瘤细胞,接种于96孔平底培养板中,100 μl/孔。待细胞贴壁后分别设对照组和不同浓度药物组,每组设8个复孔。在药物作用48 h后,每孔加MTT 20 μl,培养4 h后弃去上清液,每孔加入DMSO 100 μl,震荡摇匀,使孔内蓝紫色甲簪结晶充分溶解,酶标仪(λ=490 nm)测吸光度值(A490)。
细胞抑制率(%)=(对照组A值-实验组A值)/对照组A值×100%
1.3.3 Hoechst 33258荧光染色检测细胞凋亡 收集各组药物处理48 h的MG-63细胞,PBS冲洗后用新鲜配制1∶3混合的冰醋酸/甲醇固定液固定15 min,吸出固定液后重复固定一次。吸除固定液室温干燥。8 μg/ml Hoechst 33258室温染液滴加到固定好的细胞上,室温避光染色30 min。双蒸水冲洗后晾干、封片,荧光显微镜下观察细胞形态。凋亡细胞呈染色质高度凝聚、边集,胞核裂解为碎块,凋亡小体形成。
1.3.4 DNA ladder法检测细胞凋亡 收集贴壁及悬浮细胞,按酚-氯仿-异戊醇的方法提取细胞基因组DNA。紫外分光光度计测定260 nm光吸收值。DNA上样量为5 μg/lane,经2%琼脂糖凝胶电泳,50 V 1 h,0.5 μg/ml溴化乙锭染色,紫外灯下观察DNA条带并拍照。
1.3.5 流式细胞仪单染检测细胞凋亡 将MG-63细胞接种于6孔板,附壁后当细胞于6孔板生长汇合至70%~80%时,分别加入各组药物,培养48 h后,用细胞刮刀刮下细胞,吹匀,形成单细胞悬液,离心后沉淀用PBS冲洗后用预冷的70%乙醇固定,碘化丙啶(PI)染色后上机测定凋亡率,每孔重复4次×2孔(n=8)。
2 结果
2.1 rhIFN-α以及联合应用顺铂对MG-63细胞增殖的抑制效应 MTT实验结果显示,单独应用rhIFN-α 组中,10 000 IU/ml rhIFN-α 对细胞增殖抑制情况较明显,抑制率达到(34.12±2.11)%,1 000 IU/ml rhIFN-α和100 IU/ml rhIFN-α组对细胞增殖抑制情况较上组弱,说明大剂量 rhIFN-α可抑制MG-63细胞增殖,小剂量效果不明显;单独应用顺铂组对细胞增殖抑制情况也较明显,达到(24.74±2.22)%;顺铂联合应用干扰素α组对细胞增殖抑制情况非常明显,分别达到(69.41±1.72)%、(58.81 ±2.23)%、(48.23 ±1.12)%,而且增殖抑制率较单独应用顺铂与单独应用干扰素α组增殖抑制率之和还要高。说明rhIFN-α可促进MG-63细胞对顺铂化疗敏感性(详见表1)。
表1 MTT法检测干扰素对MG-63细胞生长抑制情况结果(±s,n=8)Tab 1 Results of MTT assay of interferon on the MG-63 cell growth inhibition(±s,n=8)

表1 MTT法检测干扰素对MG-63细胞生长抑制情况结果(±s,n=8)Tab 1 Results of MTT assay of interferon on the MG-63 cell growth inhibition(±s,n=8)
*与对照组比较,P<0.05
组别 OD 抑制率(%)0.85 ±0.065 10 000 IU/ml干扰素 0.56 ±0.121* 34.12 ±2.11 1 000 IU/ml干扰素 0.74 ±0.142* 12.94 ±1.82 100 IU/ml干扰素 0.81 ±0.137 4.73 ±1.21顺铂 +10 000 IU/ml干扰素 0.26 ±0.098* 69.41 ±1.72顺铂 +1 000 IU/ml干扰素 0.35 ±0.141* 58.81 ±2.23顺铂 +100 IU/ml干扰素 0.44 ±0.078* 48.23 ±1.12顺铂 0.64 ±0.062* 24.74 ±2.22 F=55.684 P=0.正常对照组03
2.2 rhIFN-α以及联合应用顺铂对MG-63细胞形态观察结果 分别将各组药物加入已长满单层的MG-63细胞,作用48 h后,在相差显微镜下观察。正常对照组细胞形态良好呈梭形,界限不清楚。rhIFN-α对MG-63细胞凋亡作用呈剂量依赖性,10 000 IU/ml rhIFN-α组出现明显的细胞凋亡状态,表现为细胞间隙增大,细胞固缩,并有部分细胞出现空泡化;1 000 IU/ml rhIFN-α 组和 100 IU/ml rhIFN-α组未发现明显的细胞改变。单独应用顺铂药物组细胞凋亡现象与10 000 IU/ml rhIFN-α组类似;而顺铂联合应用干扰素α各剂量组细胞现象均十分明显,细胞大量死亡、脱落,只有很少部分细胞继续贴壁,而且贴壁细胞也出现圆缩、脱落等明显细胞改变(如图1)。

图1 rhIFN-α及顺铂作用细胞后形态学观察结果Fig 1 Results of cell morphology affected by rhIFN-α and cisplatin
2.3 荧光染色法观察干扰素α以及联合应用顺铂诱导MG-63细胞凋亡 分别将各组药物加入已长满单层的MG-63细胞,作用48 h后,Hoechst 33258染色发现正常对照组细胞核蓝染,形态良好呈圆形,染色较均一。MG-63细胞对rhIFN-α凋亡作用呈剂量依赖性,10 000 IU/ml rhIFN-α组出现明显的细胞凋亡状态,表现为大量细胞核固缩,并有部分细胞核出现碎裂,出现凋亡小体,1 000 IU/ml rhIFN-α组和100 IU/ml rhIFN-α组未发现明显的细胞改变。单独应用顺铂药物组细胞凋亡现象与10 000 IU/ml rhIFN-α组类似,部分细胞固缩,但细胞病变程度较10 000 IU/ml rhIFN-α组弱。顺铂联合应用rhIFN-α组细胞凋亡现象最明显,细胞凋亡程度与干扰素剂量呈明显依赖性,顺铂(5 μg/ml)联合应用10 000 IU/ml rhIFN-α组表现为细胞大量死亡、脱落,只有很少部分细胞继续贴壁,而大多数贴壁细胞核出现固缩、核物质碎裂等凋亡改变。顺铂(5 μg/ml)联合应用1 000 IU/ml rhIFN-α 组和顺铂(5 μg/ml)联合应用100 IU/ml rhIFN-α组出现类似凋亡改变,只是程度稍轻(图2)。

图2 荧光染色检测凋亡结果(荧光染色×200)Fig 2 The results of fluorescence staining to detect apoptosis(fluorescence staining×200)

图3 DNA ladder法检测凋亡结果Fig 3 The results of DNA ladders to detect apoptosis
以上结果表明大剂量干扰素α可促进MG-63细胞凋亡,小剂量效果不明显。而且rhIFN-α可增加MG-63细胞对顺铂化疗敏感性。
2.4 DNA ladder法检测rhIFN-α以及联合应用顺铂诱导MG-63细胞凋亡 不同药物处理MG-63细胞48 h的DNA凝胶电泳结果(图3)提示:rhIFN-α对MG-63细胞凋亡作用呈剂量依赖性,随药物浓度增高,DNA条带(DNA ladder)亮度增加,10 000 IU/ml rhIFN-α组出现典型的梯形DNA条带,1 000 IU/ml rhIFN-α 组和100 IU/ml rhIFN-α 组 DNA ladder
条带没有10 000 IU/ml rhIFN-α组清晰。单独应用顺铂药物组DNA ladder条带也不清晰。顺铂联合应用rhIFN-α各剂量组,均可见清晰的DNA ladder条带。结果表明:10 000 IU/ml rhIFN-α可直接诱导骨肉瘤细胞凋亡,1 000 IU/ml和100 IU/ml rhIFN-α诱导骨肉瘤细胞凋亡不明显,但各剂量的rhIFN-α均可明显促进顺铂诱导的骨肉瘤细胞凋亡。
2.5 流式细胞仪检测MG-63细胞凋亡结果 与对照组相比,100 IU/mlrhIFN-α组未出现明显的细胞凋亡情况(P>0.05);10 000IU/ml rhIFN-α组细胞凋亡情况较明显,凋亡率达到(32.12±0.34)%(P<0.05);单独应用顺铂组细胞凋亡率达到(25.35±0.46)%(P <0.05);顺铂联合应用 rhIFN-α 组对细胞凋亡率最高(P<0.05)。具体结果见表2。
表2 流式细胞仪法检测rhIFN-α对MG-63细胞凋亡情况结果(±s,n=8)Tab 2 Flow cytometry assay results on apoptosis of MG-63 cells(±s,n=8)
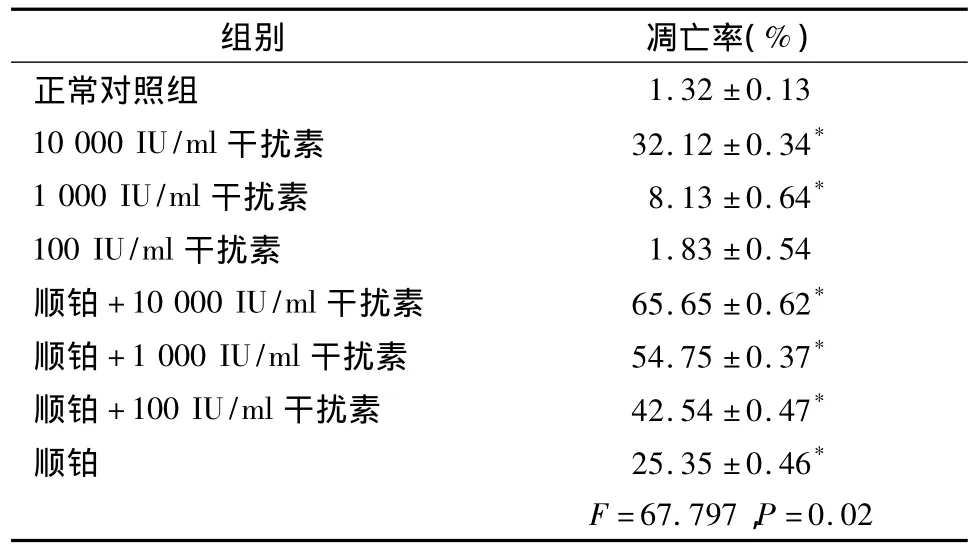
表2 流式细胞仪法检测rhIFN-α对MG-63细胞凋亡情况结果(±s,n=8)Tab 2 Flow cytometry assay results on apoptosis of MG-63 cells(±s,n=8)
*与对照组比较,P<0.05
组别 凋亡率(%)1.32 ±0.13 10 000 IU/ml干扰素 32.12 ±0.34*1 000 IU/ml干扰素 8.13 ±0.64*100 IU/ml干扰素 1.83 ±0.54顺铂 +10 000 IU/ml干扰素 65.65 ±0.62*顺铂 +1 000 IU/ml干扰素 54.75 ±0.37*顺铂 +100 IU/ml干扰素 42.54 ±0.47*顺铂 25.35 ±0.46*F=67.797,P正常对照组=0.02
3 讨论
IFN是一类重要的细胞因子,它参与调节细胞的生长,具有广谱抗病毒、免疫调节以及抗肿瘤活性。在临床上已广泛应用于恶性肿瘤及病毒性疾病的治疗。干扰素的抗肿瘤活性包括对肿瘤组织的直接和间接作用。前者指干扰素可直接抑制肿瘤细胞增生,促进细胞凋亡,后者通过调节带瘤宿主的免疫反应来抑制肿瘤[7,8]。干扰素有多种型别,根据其来源和结构,可将其分为α、β、γ三种类型,长期以来人们一直认为IFNγ可抑制肿瘤细胞生长,并且已应用于肿瘤临床治疗。已有大量的临床和基础报道IFNγ对肿瘤的生长及转移有一定的抑制作用,IFNγ可以通过调节机体的免疫功能、抑制肿瘤血管增生、激活体内的多种肿瘤杀伤细胞如细胞毒性T淋巴细胞及自然杀伤细胞等间接发挥抗肿瘤活性[9]。此外,IFNγ也可直接抑制肿瘤细胞的增殖与分化,杀伤肿瘤细胞,这种作用机制可通过瘤体内直接注射干扰素而得以证实[10,11]。
近来有大量的实验表明,干扰素α可以通过促进细胞凋亡而起到抗增生的作用。例如:IFNα可以引起一些B细胞源性的淋巴细胞和骨髓瘤细胞凋亡[12]。Peter等[13]学者发现 IFNα 是通过 TNFα 介导的凋亡作用而杀死肿瘤细胞的。还有学者发现IFNα可引起肿瘤细胞TNFα的分泌增加,但是内源性的TNFα在无IFNα的情况下并不能引起细胞的死亡。另有研究显示被 TNFα刺激的细胞通过caspase活化而引起凋亡,但同时通过NF-kB途径引起合成的IAP(inhibitors of apoptosis)则显示抗凋亡作用。IFNα抑制IAP的产生继而使细胞对TNFα的促凋亡效应敏感而引起细胞凋亡[14]。
本实验通过单独应用重组人α干扰素以及联合顺铂作用于骨肉瘤细胞MG-63,检测其对MG-63细胞凋亡和侵袭转移能力的影响,来探讨重组人α干扰素治疗骨肉瘤的可行性及关系,并研究其可能的作用机制。研究发现10 000 IU/ml rhIFN-α可直接诱导骨肉瘤细胞凋亡,1 000 IU/ml和100 IU/ml rhIFN-α诱导骨肉瘤细胞凋亡不明显,但各剂量的干扰素均可明显促进顺铂诱导的骨肉瘤细胞凋亡,故我们认为重组人α干扰素提高了MG-63细胞对顺铂药物的敏感性。本实验结果提示重组人α干扰素在骨肉瘤的治疗中可能有很广阔的应用前景。
[1]YE BO-GEN,GENG XIAO-PING.Interferons therapy in hepatocellular carcinoma and its mechanism[J].international journal of surgery,2007,34(5):326 -329.
[2]KILADJIAN JJ,CHOMIENNE C,FENAUX P.Interferon-alpha therapy in bcr-abl-negative myeloproliferative neoplasms[J].Leukemia,2008,22(11):1990 -1998.
[3]GAZITT Y,KOLAPARTHI V,MONCADA K,et al.Targeted therapy of human osteosarcoma with 17AAG or rapamycin:Characterization of induced apoptosis and inhibition of mTOR and Akt/MAPK/Wnt pathways[J].Int J Oncol,2009,34(2):551 -561.
[4]AKIYAMA T,DASS CR,CHOONG PF.Novel therapeutic strategy for osteosarcoma targeting osteoclast differentiation,bone-resorbing activity,and apoptosis pathway[J].Mol Cancer Ther,2008,7(11):3461-3469.
[5]SAKAMOTO A,IWAMOTO Y.Current status and perspectives regarding the treatment of osteo-sarcoma:chemotherapy[J].Rev Recent Clin Trials,2008,3(3):228 -231.
[6]TODESCO A,CARLI M,IACONA I,et al.All transretinoic acid and interferon alpha in the treatment of a patient with resistant metastatic osteosarcoma[J].Cancer,2000,89(12):2661 - 2666.
[7]MAZZOLINI G,MURILLO O,ATORRASAGASTI C,et al.Immunotherapy and immunoescape in colorectal cancer[J].World J Gastroenterol,2007,13(44):5822 - 5831.
[8]ZHAO P,ZHU YH,WU JX,et al.Adenovirus-mediated delivery of human IFNgamma gene inhibits prostate cancer growth[J].Life Sci,2007,81(9):695 - 701.
[9]SUN Q,BREWER N,DUNHAM K,et al.Interferon-gamma expressing EBV LMP2A-specific T cells for cellular immunotherapy[J].Cell Immunol,2007,246(2):81 -91.
[10]VAN ROY M,WIELOCKX B,BAKER A,et al.The use of tissue inhibitors of matrix metalloproteinases to increase the efficacy of a tumor necrosis factor/interferon gamma antitumor therapy[J].Cancer Gene Ther,2007,14(4):372 -379.
[11]MCCULLOUGH CT,TURA BJ,HARRISON DJ.c-Myc partially mediates IFNgamma-induced apoptosis in the primary hepatocyte[J].Int J Exp Pathol,2007,88(3):129 - 136
[12]KILADJIAN JJ,CHOMIENNE C,FENAUX P.Interferon-alpha therapy in bcr-abl-negative myeloproliferative neoplasms[J].Leukemia,2008,22(11):1990 -1998.
[13]PETER K,ANDREW R,JOSEPH R,et al.Response of hairy cells to IFN-α involves induction of apoptosis through autocrine TNF-αand protection by adhesion[J].Blood,2002,100:647 -653.
[14]YUAN XW,ZHU XF,LIANG SG,et al.Interferonalpha enhances etoposide-induced apoptosis in human osteosarcoma U2OS cells by a p53-dependent pathway[J].Life Sci,2008,82(7 - 8):393 -401.
