抗腹泻性贝毒软海绵酸多克隆抗体的制备与检测
2011-08-07胡乐琴柳俊秀何培民
胡乐琴,汪 卿,柳俊秀,何培民
(上海海洋大学水产与生命学院,上海 浦东 201306)
腹泻性贝毒素是多醚类赤潮藻毒素,其成分主要有软海绵酸(okadaic acid,OA)、鳍藻毒素(dinophysis toxins,DTX)。OA是蛋白磷酸酶PP1(Protein Phosphatase)和 PP2A(ser/thre Protein Phosphatase 2A)的特异性抑制剂,通过特异性地作用于蛋白磷酸酶PP1和PP2A抑制酶的去磷酸化,引起信号传导途径的变化,造成机体中毒[1]。OA还是肿瘤促进因子,可引致DNA加合物形成[2]。对水体和贝类产品进行毒素快速检测是预防藻毒危害的有效方法。
免疫学检测技术利用抗原与抗体专一、特异性结合的特点对样品进行检测,是一种高度灵敏高度特异的检测方法。1964年Johnson等首次成功制备了抗STX的多克隆抗体,后Adachi M等人[3]进入了藻毒素的单抗研究。目前市场上已经有几种藻毒素的免疫检测试剂盒和试纸条,用于藻毒素的快速检测。
关于大田软海绵酸单克隆抗体的制备在国内已有报道[4],但尚未见到多克隆抗体的研究。有关大田软海绵酸多克隆抗体的制备与检测报告如下。
1 材料与方法
1.1 试验材料 试验动物:雄性新西兰白兔,体重为2~2.5kg,购自中国科学院上海生物研究所抗体中心。大田软海绵酸(OA)标准品购自北京伊普瑞斯科技有限公司。用甲醇稀释成100ng/μL贮存于-20℃冰箱备用;牛血清白蛋白(BSA)、卵清蛋白(OVA),N-羟丁二酰亚胺(N-hydroxysuccinimide)、N,N双环乙烷碳二亚胺(N,N-dicyclohexylcarbodiimide,DCC)、N,N-二甲基甲酰胺(N,N-dimethy-formamide,DMF)、福氏完全佐剂、福氏不完全佐剂、邻苯二胺(OPD)等为Sigma公司产品;辣根过氧化物酶标记羊抗兔Ig-HRP和底物TMB-H2O2购于上海生工生物工程技术服务有限公司,GelDoc凝胶成像仪购自Bio-Rad,NC膜购自Sigma公司,TTBS购自Invitrogen-Dynal。
1.2 完全抗原的制备 OA与BSA偶联的方法是按参考文献[5]进行,仅将文献中的载体蛋白牛甲状腺球蛋白(BTG)改用牛血清白蛋白(BSA)。具体方法如下:取4.5mg N一羟丁二酰亚胺、9mg N,N-双环乙烷碳二亚胺溶于30mL MES缓冲液(0.05 mol/L,0.5mol/L NaCl,pH 值5.0),充分溶解,取50μL加入到100μL含1mg OA的DMSO溶液中,25℃反应15min;另称取3mg BSA,用500μL磷酸盐缓冲液(PBS)(0.01mol/L pH 值7.4)溶解;将上述活化的OA和10μL吡啶加入BSA溶液中,在室温条件下轻速搅拌6h,再放置4℃冰箱过夜。第2天取出,分别用0.01mol/L pH值9.5的碳酸盐缓冲液和0.01mol/L pH值7.4PBS透析,分装、-20℃保存,用作免疫抗原。
1.3 偶联效果的检测 用乙醇精确配制OA标准溶液,用0.01mol/L pH值7.4PBS配制BSA的标准溶液。称取一定量的OA-BSA溶于PBS中,用Braford法测其蛋白质的浓度。根据此浓度调整OABSA溶液中蛋白质的浓度,使其与PBS一致。取2 mL OA溶液(10μg/mL)、取2mL BSA溶液(1mg/mL)和2mL OA-BSA溶液,以PBS为空白对照,用紫外分光扫描仪在波长200~500nm的范围内逐一扫描它们吸收光谱,在最大吸收峰处的波长测定吸光值,参照文献[6]估算OA与BSA的偶联比。
1.4 动物的免疫 取雄性新西兰白兔(体重为2~2.5kg)2只(07160#和07161#),按以下程序免疫。免疫流程:用OA-BSA与福氏佐剂混合,乳化后,皮下和皮内多点注射进行免疫。OA-BSA的剂量为0.6mg/次·兔。首次免疫用福氏完全佐剂,再次免疫用不完全福氏佐剂。免疫的间隔时间为3周。第3次免疫后1周,给兔放血,待血液凝固后放37℃温箱1h,然后4℃冰箱过夜。第2天用4℃低温离心机3000r/min收集上清液即为多克隆抗体。
1.5 抗体纯化 采用饱和硫酸铵法纯化抗体[6],再用亲合层析柱进一步纯化。-20℃冰箱保存备用。
1.6 抗血清效价的测定-间接ELISA 间接竞争ELISA测定方法:包被抗原设置二组,一组包被抗原为OA-BSA;一组包被抗原为BSA。每个包被抗原做3个待测样品:免疫前血清;免疫后抗血清;免疫后抗血清加BSA中和。检测方法:用包被缓冲液将包被抗原稀释成2μg/mL的浓度,在酶标板每孔中加入100μL,做3个重复。密封后4℃ 过夜,弃去包被抗原,洗涤液洗涤3次,加入200μL封闭液37℃ 温育1h。每孔加入100μL待测抗血清,37℃温育2h,弃去抗血清,洗涤液洗涤3次;每孔加入100μL酶标二抗工作液(羊抗兔Ig-HRP),37℃温育1h,弃去酶标二抗工作液 ,洗涤液洗涤3次;每孔加入100μL底物溶液(TMB-H2O2),37℃避光显色15min后,每孔加入50μL 2mol/L H2SO4终止液终止反应,在酶标仪上读取450nm的吸光度值。
每组设置空白对照(本底),方法是以稀释液代替待测血清进行反应。
1.7 抑制率检测 先用甲醇溶解OA标准品,再用去离子水稀释成不同浓度OA稀释液,浓度分别为6.25、5、2.5、1.25、0.625、0μg/L,分别取各浓度标准品溶液50μL和血清稀释液50μL封闭孔内,竞争反应2h。其余步骤与间接ELISA法相同,测定OD值,计算达到50%抑制率时的OA质量浓度值(IC50值),确定单抗对OA的亲和性。抑制率的计算公式如下:抑制率=(1-OD450sam/OD450max)×100%
其中,OD450sam表示竞争性孔的OD值,OD450max表示未加药物抑制的孔的OD值。
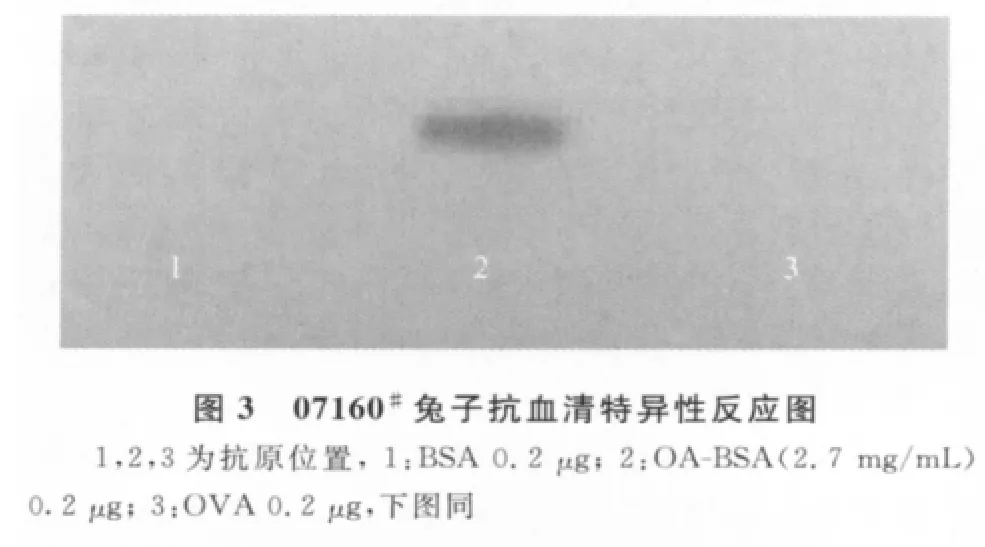
1.8 Dot Blot检测OA-BSA兔抗血清特异性反应Dot-blot检测方法如下:将BSA、OA-BSA、OVA直接点于NC膜上,点样量均为0.2μg。用含5%脱脂奶粉的TTBS(w/v)溶液4℃封闭2h,滴加一抗(1∶~,用5%BSA in TTBS(w/v)稀释)4℃过夜。TTBS洗脱1min,重复洗脱4次。滴加二抗羊抗兔IgG(H+L)-HRP(1∶~),37℃孵育2 h,TTBS洗膜10min 4次,TBS洗膜10min,按ECL试剂盒说明进行显色,GelDoc凝胶成像仪采集图象。以PBS代替一抗作为阴性对照。
2 结果与分析
2.1 免疫抗原偶联效果 图1为OA-BSA免疫抗原偶联效果的紫外扫描鉴定结果。从图1可见,OA与BSA经DCC反应后,其产物OA-BSA的紫外吸收图谱与载体BSA相比,吸收峰和吸收曲线均发生了改变。其中,OA-BSA吸收峰在262nm处,与OA的吸收蜂相同,而BSA吸收峰在280nm处;OA-BSA的蛋白浓度与BSA相同,但OA-BSA最大吸收峰值大约是BSA两倍。可见OA与BSA已发生结合,且OA与BSA的结合率大约为18。
2.2 抗血清效价测定结果 ELISA检测多抗血清效价结果如表1。表1所示结果表明,来自07160#和07161#兔的抗血清中含有针对OA的抗体。因为用BSA中和后的抗血清,对BSA呈阴性反应,而对OA-BSA仍呈较强阳性反应。
2.3 抑制率测定结果 以吸光率B/B0(B是OA不同标准浓度的OD值,B0是OA(标准浓度的OD值)为纵坐标,以OA不同浓度×10的对数值为横坐标,绘制标准抑制曲线见图2,进行回归分析。经计算McAb对OA的IC50为2.852ng/mL。

图1 偶联物及产物紫外扫描图

图2 OA间接竞争ELISA工作曲线
2.4 Dot Blot结果 OA-BSA兔抗血清特异性反应检测结果如图3、图4。从图中可知,抗血清与BSA、OVA均无反应,而与OA-BSA有反应,说明抗血清为OA特异抗体。

表1 第3次免疫后兔抗OA抗体ELISA方法检测

3 讨论
酶免疫测定技术具有高度特异性和优良的稳定性,并且可以被开发成简便实用的试剂盒和试剂条,成为药物检测和毒素检测中具有研究和开发前景的热点,而获得高质量的抗体是实现免疫分析检测的核心和基础。
通常相对分子质量小于1,000的物质是不具有免疫原性的,需要与载体蛋白偶联形成结合物后才具有免疫原性。OA为多聚醚类小分子化合物,相对分子量为804.5,不具有直接产生抗体的特性,而需要偶联到大分子的载体上。目前,常用来作为小分子人工抗原的载体蛋白有牛血清蛋白(BSA)、卵清蛋白(OVA)、钥孔血蓝蛋白(KLH)、人IgG及人工合成的多聚赖氨酸(PLL)等。于光、卢士英[6]等(2006)将OA与人IgG偶联制备免疫原 OA-人IgG,其免疫效果很好。Shiro Matsuura[7](1994)也采用人IgG作为载体制备免疫原OA-人IgG,用其研制的抗体建立的ELISA,最低的检测限为30ng/mL。Nuria M Llamas[8](2007)用 OA 与牛甲状腺球蛋白偶联制备免疫原制备多抗,建立免疫生物传感器检测OA技术,OA50%抑制的质量浓度为148 ng/g。本文采用OA与BSA偶联制备免疫原,用其研制的多抗,经间接ELISA鉴定,OA50%抑制的质量浓度为2.852ng/mL,抗体质量较好,特异性反应强,可作为制备检测试剂的材料。
[1]Svensson S,Särngren A,Förlin L.Mussel blood cells,resistant to the cytotoxic effects of okadaic acid,do not express cell membrane p-glyprotein activity (multixenobiotic resistance)[J].Aquat Toxicol,2003,65(1):27-37.
[2]García C,Truan D,Lagos M,et al.Metabolic transformation of dinophysistoxin-3into dinophysistoxin-1causes human intoxication by consumption of o-acyl-derivatives dinophysistoxins contaminated shellfish[J].J Toxicol Sci,2005,30(4):287-296.
[3]Sako Y,Adachi M.Specific Monoclonal Antibodis and DNA Porbes for the Identification of the Toxic Dinoflagellate Genus Alexandrium[M].Harmful marine algal blooms.Pairs:Technique ct documentation-lavoisier,intercept ltd,1995:77-81.
[4]卢士英,周玉,李岩松,等.大田软海绵酸单克隆抗体ELISA检测方法的建立[J].中国兽医学报,2007,27(3):336-339,411.
[5]Nuria M Llamas,Linda Stewart,Terry Fodey & H,et al.De-velopment of a novel immunobiosensor method for the rapid detection of okadaic acid contamination in shellfish extracts[J].Anal Bioanal Chem,2007,389:581-587.
[6]杨利国,魏平华,郭爱珍,等.酶免疫测定技术 [M].南京:南京大学出版社,1998:279-281.
[7]Shiro Matsuur,Hiroshi Kita and Yutaka Takagaki.Specifity of mouse Monoclonal Anti-Okadaic Acid and Antibodies to Okadaic Acid and Its Analogs among Diarrhetic shellfish Toxins[J].Biosci biotech biochem,1994,58(8):1471-1475.
[8]Nuria M Llamas,Linda Stewart,Terry Fodey &.H,et al.Development of a novel immunobiosensor method for the rapid detection of okadaic acid contamination in shellfish extracts[J].Anal Bioanal Chem,2007,389:581-587.