颈椎终板软骨细胞凋亡的检测及相关意义
2011-08-07陈贵月崔海文崔树科樊永胜赵先进姚卫红高旭红郭侃凯
王 鑫,陈贵月,崔海文,崔树科,樊永胜,赵先进,姚卫红,高旭红,郭侃凯
颈椎间盘退变是颈椎病发生发展的病理基础,但具体的退变机制目前尚不明确。终板作为椎间盘的组成部分之一,在髓核营养交换和椎间盘应力保护方面起重要作用。近年来研究证实,退变终板中存在较高的细胞凋亡率[1-2],但细胞凋亡在椎间盘退变中的作用有待进一步深入研究。本研究采用脱氧核糖核苷酸末端转移酶介导的缺口末端标记(terminal deoxynucleotidyl transferasemediated dUTP nick end labeling,TUNEL)法和咔唑分光光度法分别检测退变及外伤颈椎终板软骨细胞的细胞凋亡指数和髓核蛋白多糖含量,分析其相关关系,进而探讨颈椎终板软骨细胞凋亡在椎间盘退变中的作用。
1 材料与方法
1.1 颈椎间盘组织的选择及处理
1.1.1 病例纳入与排除标准 退变组纳入标准:(1)MRI显示相应节段髓核信号异常;(2)影像学显示有明确的间盘突出;(3)术后病理检查[3]示相应椎间盘已发生明显退变。剔除标准:排除外伤性颈脊髓损伤患者。外伤组纳入标准:(1)明确的颈椎外伤史;(2)影像学检查可见颈椎骨折、脱位、颈脊髓信号改变。剔除标准:(1)MRI显示病变节段相邻椎间盘信号异常者,推断该节段间盘已经发生退变;(2)术后病理检查示椎间盘已发生明显退行性改变者。
1.1.2 一般资料 我院骨科2009年1月至2010年6月行颈椎前路手术的患者中符合纳入标准者共54例,获取颈椎间盘组织标本61份。其中退变组标本取自手术治疗的35例脊髓型颈椎病患者,男25例,女10例,平均年龄52.2岁。病变节段:C3~C47例 ,C4~C512例,C5~C617例,C6~C73例,单节段病例31例,双节段病例4例。行单节段间盘切除前路融合固定术29例,单节段间盘切除、人工椎间盘置换术2例,双节段间盘切除前路融合术4例。外伤组标本取自手术治疗的19例颈椎创伤患者,均为男性,平均年龄38.8岁。病变节段:C2~C31例,C3~C44例,C4~C57例,C5~C66例,C6~C74例,单节段病例16例,双节段病例3例。行单节段间盘切除前路融合16例,椎体次全切除3例。
1.1.3 标本的处理 术中所取标本为终板软骨及髓核组织,生理盐水冲洗后分送检验科及病理科保存待检。
1.2 主要试剂和仪器
细胞凋亡原位检测试剂盒、脱氧核糖核酸酶(南京凯基生物科技有限公司),木瓜蛋白酶、D-葡萄糖醛酸、咔唑(中国医化集团上海分公司),恒温水浴锅(上海医疗设备厂),光学显微镜(Olympus公司,日本),CO2恒温培养箱(Thermo公司,美国),组织切片机(Leica公司,德国),病理图文分析系统(济南丹吉尔电子有限公司)。
1.3 方法
1.3.1 终板软骨及髓核细胞的光镜观察 组织切片常规脱蜡,梯度乙醇逐级水化,苏木素染色后自来水冲洗,伊红复染,梯度乙醇逐级脱水,二甲苯透明,中性树胶封片,光镜下观察两组颈椎终板软骨及髓核的细胞形态、分布及数量,计算细胞密度:100倍镜下随机观察计数5个视野,记录各样本终板及髓核细胞数,取其平均值为细胞密度。
1.3.2 TUNEL法检测终板及髓核细胞的细胞凋亡指数 实验步骤:(1)石蜡切片常规脱蜡,梯度乙醇脱水;(2)将切片浸入浓度为0.01 mol/L的枸椽酸盐缓冲液(pH=6.0)中,并置于医用高压锅内,沸煮2.5 min,室温冷却,PBS漂洗3次;(3)蛋白酶K 37℃消化30 min;(4)过氧化氢甲醇30 μL/片,室温封闭10 min;(5)滴加TdT酶反应液30 μL/片,37℃避光湿润反应 60 min,PBS 漂洗 3次;(6)滴加Streptavidin-HRP工作液,4℃避光湿润反应过夜,PBS漂洗3次;(7)滴加新鲜配制的DAB工作液,低倍光镜下控制显色时间,显色适度后流水冲洗终止反应,苏木素复染,自来水冲洗返蓝,梯度乙醇逐级脱水,二甲苯透明,中性树胶封片。
阳性对照组在步骤4后用DNase(1 mg/mL)消化10 min后加入TUNEL反应混合液;阴性对照组不加TdT酶反应液。以细胞核中有棕黄色颗粒者为阳性凋亡细胞。随后分别计算两组的细胞凋亡指数:100倍光镜下随机观察计数5个视野,记录阳性及阴性凋亡细胞数,以阳性凋亡细胞数除以细胞总数所得数值为凋亡指数。
1.3.3 咔唑比色法检测髓核蛋白多糖含量 实验步骤:(1)髓核切片,置于20 mL试管中,加丙酮2次,各于6 h后弃去丙酮,乙醚37℃脱脂24 h;(2)蒸馏水冲洗3次,烘箱50℃,恒温4 h;(3)电子天平精确称量标本10 mg,置于试管中,加入木瓜酶消化液0.5 mL,60℃消化7 h(每2 h搅拌1次);(4)冷却至室温后加入浓度为20%的三氯醋酸0.5 mL,室温放置2 h;(5)离心(3500转/分)5 min,取上清液50 μL,加入蒸馏水5000 μL,取500 μL,冰水浴中加浓硫酸3000 μL,震荡后100℃水浴20 min,加100 μL咔唑,测530 nm吸光值(OD值)。
1.4 统计学方法
所有数据采用SPSS 10.0统计软件处理,数据以均数±标准差表示。对两组之间颈椎终板及髓核的细胞密度、凋亡指数以及OD值比较采用独立样本t检验,P<0.05认为差异有统计学意义。采用Pearson法对颈椎终板细胞凋亡指数与终板细胞密度、髓核细胞凋亡指数以及髓核蛋白多糖含量之间的关系进行相关分析。
表1 两组终板和髓核细胞密度比较(±s)

表1 两组终板和髓核细胞密度比较(±s)
组别退变组外伤组t值P值n 3317终板细胞密度15.2±5.924.5±10.34.1000.000髓核细胞密度6.4±3.511.3±7.23.2300.002
2 结果
2.1 光镜观察结果
苏木精—伊红染色后获取有效切片50份,其中退变组33份,外伤组17份。外伤组颈椎终板软骨细胞呈圆形、椭圆形,散在或成对分布,细胞排列整齐,胞核大小均匀,着色较深,胞浆染色较淡(图1A);髓核中可见较多的脊索细胞和类软骨细胞(图1B)。退变组终板细胞数量减少,出现大量软骨空陷窝(图1C);髓核胶原纤维增多,脊索细胞和类软骨细胞减少,细胞周围出现大量空泡(图1D)。比较两组的终板细胞密度和髓核细胞密度,差异均具有统计学意义(P<0.05,表1)。
2.2 终板、髓核细胞凋亡指数
TUNEL染色后去除消化过程中掉片严重、影响观察结果的切片,对44份(退变组28例,外伤组16例)有效切片统计比较终板细胞凋亡指数;对43份(退变组26例,外伤组17例)有效切片统计比较髓核细胞凋亡指数。凋亡软骨细胞表现为软骨陷窝内细胞核棕黄或棕褐染色,伴或不伴核染色质边集或核碎裂;非凋亡细胞胞核蓝染(图2A~2C)。髓核切片中髓核细胞密度少于终板,细胞稀疏而基质丰富,可见散在分布的TUNEL阳性细胞(图2D,2E)。比较退变组和外伤组的终板细胞凋亡指数和髓核细胞凋亡指数,差异均具有统计学意义(P<0.05,表2)。进一步排除年龄因素对细胞凋亡的影响,选择两组中年龄在35~50岁的患者21例(退变组11例,外伤组10例),如表3所示,组间年龄差异无统计学意义(P>0.05),而两组终板软骨细胞凋亡指数的差异仍有统计学意义(P<0.05)。
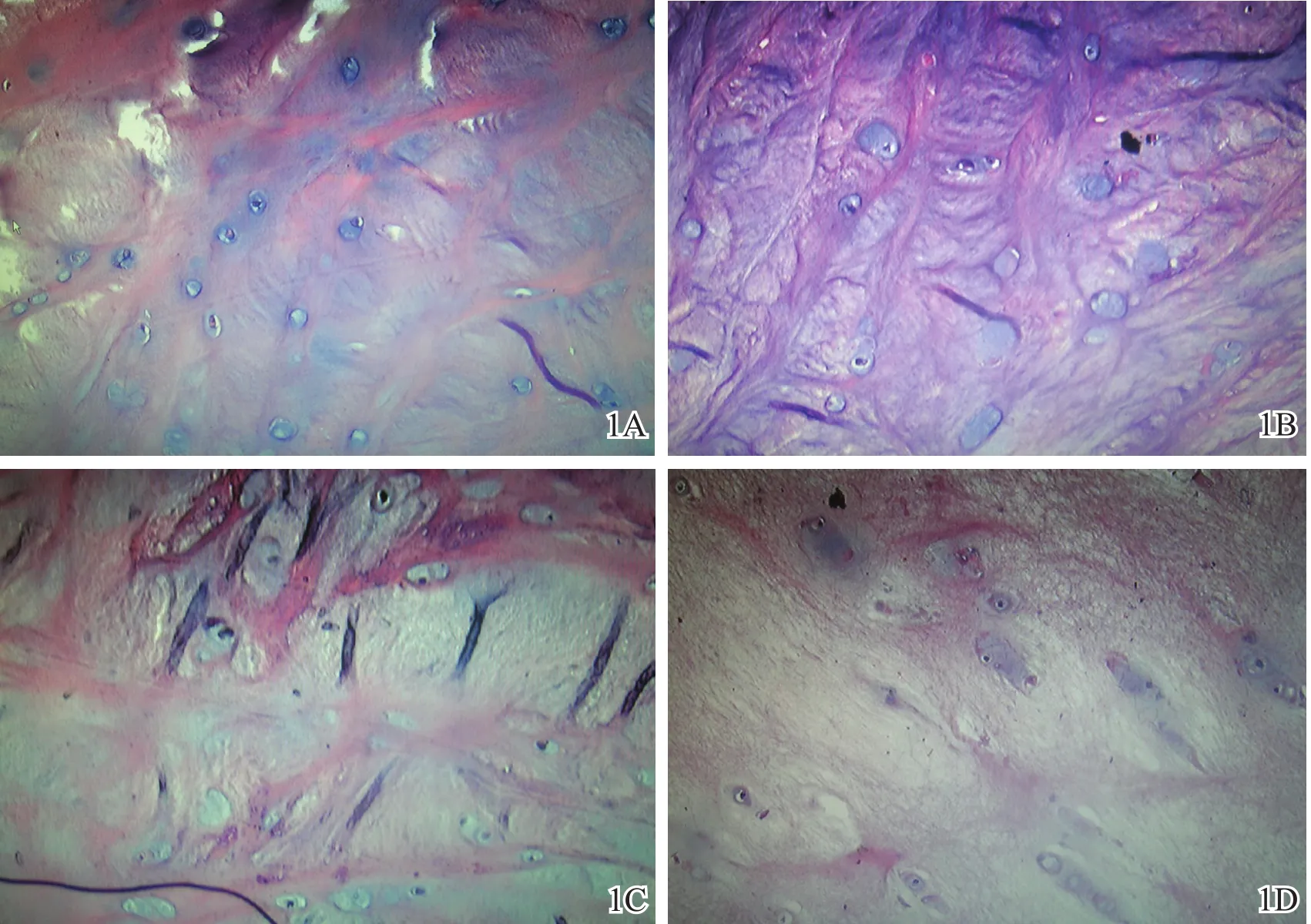
图1 苏木精—伊红染色结果
表2 两组终板、髓核细胞凋亡指数比较(%,±s)

表2 两组终板、髓核细胞凋亡指数比较(%,±s)
组别退变组外伤组t值P值终板细胞凋亡指数34.6±16.1(n=28)20.1±9.3(n=16)3.2920.002髓核细胞凋亡指数11.7±3.3(n=26)8.5±4.5(n=17)2.6860.010
2.3 髓核蛋白多糖含量
共获取有效标本33份,其中退变组21份,外伤组12份,比较两组髓核蛋白多糖OD值,差异有统计学意义(P<0.05,表4)。
2.4 终板细胞凋亡指数的相关分析
Pearson相关分析结果显示,颈椎终板的TUNEL染色阳性细胞率与终板细胞密度、髓核蛋白多糖含量之间呈负相关(r=—0.805,P=0.001;r= —0.677,P=0.023),与髓核TUNEL阳性细胞率之间呈正相关(r=0.758,P=0.003)。
表3 排除年龄因素影响后两组终板细胞凋亡指数比较(±s)

表3 排除年龄因素影响后两组终板细胞凋亡指数比较(±s)
组别退变组外伤组t值P值n 1110年龄40.20±6.9738.80±6.350.4790.637终板细胞凋亡指数32.80±12.3022.3±8.502.2520.036
表4 两组髓核蛋白多糖OD值比较(±s)

表4 两组髓核蛋白多糖OD值比较(±s)
组别退变组外伤组t值P值n 2112 OD值0.288±0.0280.330±0.0503.1090.004
3 讨论
颈椎病发生发展的根本原因是颈椎间盘退变,而椎间盘退变的病因目前尚不明确。既往研究多集中于髓核和细胞因子[4-5],近年来软骨终板在椎间盘退变过程中的病理变化及其转归逐渐受到关注。软骨终板为薄层透明软骨,位于椎体上、下表面与椎间盘的纤维环和髓核之间,由软骨细胞和细胞外基质组成,在髓核营养交换和椎间盘应力保护方面起重要作用,是椎间盘主要的营养途径[6]。软骨细胞是软骨终板中惟一的细胞类型,其功能状态直接影响软骨终板的功能。与细胞产生一样,细胞凋亡是机体自然的生理过程,两者并存且维持动态平衡,以保持机体正常的生理功能和内外环境稳定。近年来研究发现退变终板中存在较高的细胞凋亡率。王拥军等[7]通过建立动静力失衡颈椎间盘退变模型发现,退变组终板软骨细胞凋亡指数明显增高。Ariga等[8]研究证实,病变鼠椎间盘软骨终板内存在凋亡细胞;随着年龄和外在压力的增加,细胞密度显著降低,凋亡细胞明显增多;细胞凋亡越明显,软骨终板消失越快。刘列等[9]的报道显示,退变颈椎间盘组织中终板软骨细胞凋亡率较对照组显著增高,阳性细胞率与细胞密度呈负相关。本研究的比较结果亦显示,退变组终板软骨细胞凋亡率明显高于外伤组,因而推测终板细胞凋亡在颈椎间盘退变的发生发展过程中可能扮演重要角色。

图2 TUNEL染色结果
随着凋亡的发生,终板内活细胞数量减少,残存细胞活性降低,终板的结构和组化成分发生改变,Ⅱ型胶原蛋白含量随之降低,蛋白多糖丢失,水分减少,软骨终板通透性下降,终板钙化[10];此外,终板细胞凋亡可造成终板软骨细胞血管内皮生 长 因 子(vascular endothelial growth factor,VEGF)及其受体表达水平降低,软骨下骨髓血管生成减少[11],管腔变细。其所导致的软骨钙化及其终板下血管袢减少,还将引起髓核营养通路受阻,椎间盘内营养减少及代谢废物聚集,椎间盘内的pH值、氧分压、渗透压等因子发生异常变化,导致髓核细胞在异常应力、缺氧、炎症因子[12-13]等因素作用下发生凋亡,细胞数量减少。本实验结果显示,终板细胞凋亡指数与髓核细胞凋亡指数之间呈正相关,而据相关报道证实,终板退变早于髓核退变[14],因而推测终板可能是椎间盘退变的启动因素,终板软骨细胞凋亡增加可通过多种途径诱导髓核细胞发生凋亡。
蛋白多糖由髓核细胞分泌合成,是髓核基质的重要成分。蛋白多糖分子中带有大量负电荷,其与胶原及弹性蛋白结合,能调节基质大分子间的有效孔径,控制带电溶质在椎间盘中的分布和转运,对保持椎间盘组织和外界环境间的物质交换具有重要作用。蛋白多糖含量降低亦是椎间盘退变的生化改变之一,其含量多少可以作为椎间盘退变严重的指标之一。Hoogendoorn等[15]推测,终板软骨细胞可合成髓核基质物质,终板细胞凋亡增加可能是髓核蛋白多糖含量降低的原因之一;亦有学者认为,终板细胞凋亡可引起髓核内环境的改变,进而激活髓核内基质金属蛋白酶[16],造成蛋白多糖降解增加,髓核蛋白多糖含量降低。本研究结果显示,终板软骨细胞凋亡指数与髓核蛋白多糖含量、髓核细胞密度均呈负相关,提示终板细胞凋亡带来的终板结构和组化改变可能通过抵制髓核基质物质形成、阻碍髓核营养通路、改变髓核内环境等机制,对髓核的细胞凋亡和蛋白多糖合成造成重要影响。
本实验研究采用临床病例标本,组间各因素变量不可能达到完全齐同。为减小实验误差,本实验采用较大样本进行比较,即便如此,仍不能完全避免误差;本实验研究方法为横断面研究,证实了退变组终板细胞存在较高的凋亡率,而终板细胞凋亡导致髓核细胞减少、髓核蛋白多糖含量减少的结论基于统计分析及理论推导。如进行动物实验,添加实验干预,诱导终板细胞凋亡,再进行相关指标检测,则可得出明确的因果关系,这需要在今后的工作中进一步完善。
[1]吴靖平,朱斌,丁磊,等.大鼠椎间盘软骨终板退变与细胞凋亡的形态计量学研究[J].复旦学报:医学版,2010,37(2):140-145.
[2]徐宏光,陈学武,王弘,等.椎体终板软骨细胞凋亡与椎间盘退变的相关性研究[J].中华医学杂志,2008,88(3):194-197.
[3]Masuda K,Aota Y,Muehleman C,et al.A novel rabbit model of mild,reproducible disc degeneration by an anulus needle puncture:correlation between the degree of disc injury and radiological and histological appearances of disc degeneration[J].Spine,2005,30(1):5-14.
[4]杨志高,张帆,陈智,等.退变颈椎椎间盘髓核中磷酸化p38 MAPK的表达[J].第二军医大学学报,2010,31(7):739-743.
[5]项耀钧,沈洪兴,沈茜,等.脊髓型颈椎病退变椎间盘局部炎性细胞因子的变化[J].第二军医大学学报,2003,24(7):788-790.
[6]Oki S,Matsuda Y,Shibata T,et al.Morphologic differences of the vascular buds in the vertebral endplate:scanning electron microsopic study[J].spine,1996,21(2):174-177.
[7]王拥军,施杞,李家顺,等.退变大鼠颈椎间盘细胞凋亡的实验研究[J].中国矫形外科杂志,2002,10(13):1311-1313.
[8]Ariga K,Yonenobu K,Nakase T,et al.Mechanical stess-induced apoptosis of endplate chondrocytes in organ-cultured mouse intervertebral discs:an ex vivo study[J].Spine,2003,28(14):1528-1533.
[9]刘列,王胜波,赵花,等.颈椎间盘退变过程中细胞凋亡与Bax,Caspase-3的表达[J].第四军医大学学报,2008,29(13):1191-1194.
[10]王飞,江建明,王凤龙,等.退变腰椎软骨终板细胞生物学特征实验研究[J].南方医科大学学报,2010,30(4):871-874.
[11]王弘,陈学武,徐宏光,等.血管内皮生长因子及其受体在颈椎病椎体软骨终板中的表达变化[J].实用医学杂志,2008,24(8):1336-1338.
[12]Podichetty VK.The aging spine:the role of inflammatory mediators in intervertebral disc degeneration[J].Cell Mol Biol,2007,53(5):4-18.
[13]李洪涛,王德春,魏见伟.氧化应激对大鼠髓核细胞凋亡的影响[J].中国组织工程研究与临床康复,2009,13(20):3877-3881.
[14]Nerlich AG,Schleicher ED,Boos N.Immunohistologic markers for age-related changes of human lumbar intervertebral discs[J].Spine,1997,22(24):2781-2795.
[15]Hoogendoorn RJ,Helder MN,Wuisman PI,et al.Adjacent segment degeneration:observations in a goat spinal fusion study[J].Spine,2008,33(12):1337-1343.
[16]Magnier C,Boiron O.Nutrient distribution and metabolism in the intervertebral disc in the unloaded state:a parametric study[J].J Biomech,2009,42(2):100-108.
