一种基于荧光图像的体外抗肿瘤药物快速筛选方法
2011-08-06聂晓静赵筱萍
聂晓静,赵筱萍,王 毅
(1.浙江大学药学院,浙江 杭州310058;2.浙江中医药大学,浙江杭州310053)
随着天然产物大规模分离制备技术与高通量筛选技术的迅猛发展[1],天然产物已成为抗肿瘤药物筛选的重要来源之一[2]。常用的抗肿瘤活性体外筛选方法主要包括 3-(4,5-Dimethylthiazol-2-yl)-2,5-di-phenyltetrazolium bromide(MTT)法和Sulforhodamine B(SRB)法等,在实际应用中已取得了较大的成效[3]。但由于受到实验操作和检测方法的限制,难以满足迅速发展的新药研发对药物高通量筛选(HTS)的要求。因此,建立合理、高效、简便的抗肿瘤药物筛选新方法,对于抗肿瘤新药研发具有重要意义。
荧光标记技术因其具有简便、灵敏、稳定等特点[4],在生物医药领域得到了广泛应用,并已成为高通量筛选的关键技术之一。二乙酸荧光素(FDA)是一种常用荧光染料,能穿越细胞质膜后在胞内被酯酶水解,因为其水解产物不能自由通过质膜且能够发出荧光,因此,可用于活细胞标记并测定细胞活力[5]。本研究发展了一种基于FDA标记活细胞的抗肿瘤活性物质快速筛选方法,并运用该方法对中药乌药中抗肿瘤活性组分进行了初步筛选,为从复杂中药组分中快速发现抗肿瘤活性物质提供了新途径。
1 材料与方法
1.1 仪器与试药 细胞荧光显微图像获取平台由浙江大学药物信息学研究所开发,包括Leica DMI 6000 B(德国莱卡公司)倒置荧光显微镜、高精度可控电动平台、电荷耦合器(CCD)摄像头(Leica DFC 310 FX)和荧光图像拼接及识别软件,其基本原理与文献[6]类似。HP1100液相色谱系统,含二元梯度泵、自动进样器、柱温箱和DAD检测器。Finnigan LCQDeca XPplus质谱仪,配有电喷雾离子化源(ESI)。DMEM培养基、胎牛血清(FBS)购自Gibco公司。胰蛋白酶购自Sigma公司。荧光染料二乙酸荧光素(FDA)购自南京碧云天生物技术研究所。96孔细胞培养板购自Corning公司。阿霉素对照品购自中国药品生物制品检定所,纯度97.4%。乌药组分由浙江大学药物信息学研究所数字化中药组分库提供。
1.2 细胞培养 人肝肿瘤细胞HepG2购自中国科学院上海细胞库,置于95%O2和CO2的37℃恒温培养箱中,在含有10%新生牛血清的DMEM培养基中培养。
1.3 FDA浓度的选择 取处于对数生长期的HepG2细胞,按照3 000个/孔的密度接种于96孔细胞培养板中。常规培养24 h后,用含不同浓度FDA的 PBS标记细胞,每孔100 μl,FDA终浓度分别为:10、5、2.5、1.25、0.625、0.3125、0.15625 μg/ml,每个浓度设 3 个复孔,37℃,孵育15 min。弃上清,PBS洗2次,每次100 μl,立即置于显微镜下拍照,并统计各孔的荧光强度。
1.4 抗肿瘤药物快速筛选系统
1.4.1 基于荧光的抗肿瘤药物体外筛选方法
取处于对数生长期的HepG2细胞,以0.25%胰蛋白酶消化后,用培养液稀释至3×104个/ml,按照3 000个/孔的密度接种于96孔板中。常规培养24 h后,试验组每孔加入200 μl含待测组分的培养液,终浓度为50 μg/ml,每个组分设3个复孔。对照组加入等体积的含0.1%DMSO的培养液。培养24 h后,弃上清,每孔加入含 FDA 的 PBS 溶液(2.5 μg/ml)100 μl,37℃,孵育15 min。弃上清,PBS洗2次,每次100 μl,立即置于显微镜下拍照,并统计各孔的荧光强度。按照下面的公式计算药物对肿瘤细胞增殖的抑制率:抑制率(%)=(1-加药组荧光强度/对照组荧光强度)×100%。
1.4.2 方法学研究
1.4.2.1 线性范围 取处于对数生长期的HepG2细胞,以0.25%胰蛋白酶消化后,按照10 000、8 000、6 000、4 000、3 000、2 000、1 000、0个/孔的细胞密度梯度接种于细胞板中,每个密度设6个复孔。常规培养24 h后,用含FDA(2.5 μg/ml)的 PBS 标记细胞,每孔 100 μl,37℃,孵育15 min。弃上清,PBS洗2次,每次100 μl,立即置于显微镜下拍照,并统计各孔的荧光强度。以每孔的细胞个数为横坐标,荧光强度为纵坐标,绘制标准曲线,计算回归方程。
1.4.2.2 精密度 按常规方法接种肿瘤细胞,3 000个/孔。常规培养24 h后,依1.4.2.1中方法连续扫描整板60孔(舍弃边孔),并统计各孔的荧光强度,计算各孔荧光强度间的RSD,以考察该方法的精密度。
1.4.2.3 阳性药阿霉素抗肿瘤活性考察 按常规方法接种肿瘤细胞,3 000个/孔。培养24 h后,加药组每孔加入200 μl含不同浓度阿霉素的培养液,阿霉素的终浓度分别为:4、2、1、0.5、0.25、0.125、0.0625、0.03125 μmol/L,每个浓度设3个复孔。对照组加入相同体积含0.1%DMSO的培养液。培养24 h后,按1.4.1中方法测定阿霉素对肿瘤细胞增殖的抑制作用。
1.4.3 乌药组分抗肿瘤活性筛选按常规方法接种肿瘤细胞,3 000个/孔。培养24 h后,加药组每孔加入200 μl含乌药组分的培养液,乌药组分终浓度为50 μg/ml,每个组分设3个复孔。并分别以4 μmol/L的阿霉素和0.1%的DMSO为阳性对照和阴性对照。培养24 h,按1.4.1中方法测定药物对肿瘤细胞的增值抑制率。
1.4.4 活性组分的LC/MS分析 称取活性组分少量,用50%甲醇/水溶解至5 mg/ml,离心后,进样分析。色谱柱:ZORBAX SB-C18(250 mm×4.6 mm)。流动相:A:0.05%甲酸/水;B:乙腈。梯度洗脱程序为:5%溶剂B保持10 min,10~15 min内线性升至40%,15~60 min内线性升至100%。流速:0.8 mL/min。检测波长:254 nm。离子源:ESI;扫描范围100~1 500(m/z)。
2 结果
2.1 FDA浓度对荧光强度的影响 本研究考察了7个不同荧光染料浓度下的细胞荧光显微图像效果(如图1所示)。实验结果表明,在FDA浓度大于2.5 μg/ml时,均能满足镜下观察及后续图像处理要求,考虑到染料浓度过高可能会对细胞活力产生影响,故选择2.5 μg/ml为FDA染料浓度。
2.2 方法学研究结果 实验结果表明(如图2),每孔接种细胞数在0~10 000个每孔的范围内,荧光强度与接种细胞数线性相关,计算回归方程得 y=4665.2x+481815,r2=0.9858。连续扫描整个96孔板中60孔,发现其荧光强度变化值较小,其RSD为9.41%,表明该方法具有良好的板内精密度。
以阳性药阿霉素验证本方法的可靠性,实验结果如图3所示。结果表明,本方法能在比MTT和SRB法更短的时间内(24 h)测定药物对肿瘤细胞活力的影响,计算所得阿霉素抑制HepG2细胞增殖作用的IC50为1.78 μmol/L。
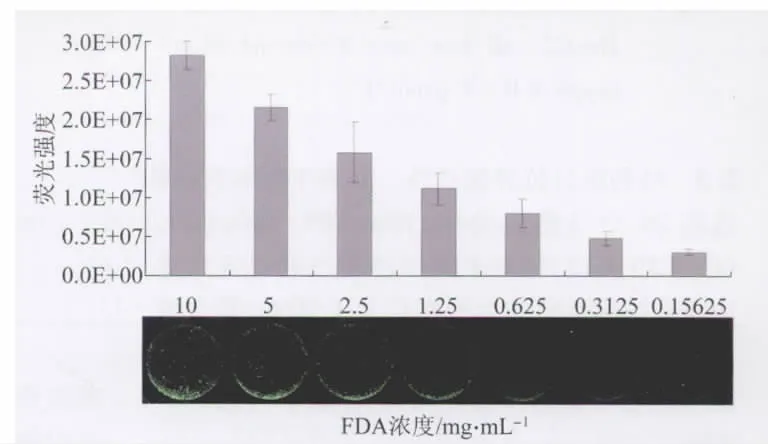
图1 不同FDA浓度对荧光强度的影响Fig.1 Effect of various FDA concentrations on fluorescence intensity
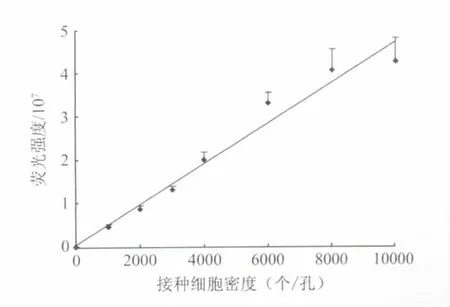
图2 细胞密度与荧光强度的线性关系曲线Fig.2 Linearity curve between cell numbers per well and fluorescence intensity
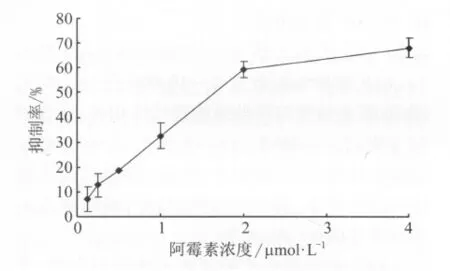
图3 不同浓度阿霉素对HepG2细胞增殖抑制作用的量效曲线Fig.3 Dose-response curve of DOX on HepG2 cell line over a concentration range of 0-4 μmol/L
2.3 乌药组分抗肿瘤活性 如表1所示,在筛选的 26 个乌药组分中,B08、B09、B10、C06、C09、C10、C12、C13、C14、C15 这 10 个组分对HepG2细胞增殖的抑制率均大于50%,其中组分C13和C15在50 μg/ml的浓度下,对肿瘤细胞增殖有较强的抑制作用,其抑制率均超过了90%。
2.4 活性组分分析结果 乌药组分C13、C15的LC/MS分析结果见表2,其中 m/z为312[M-H]-的分子离子峰,为抗肿瘤活性最强的两个乌药组分C13和C15中的共有峰。与文献相比对后初步推断该化合物为异波尔定碱。
3 讨论
本研究建立了一种基于细胞荧光显微图像的抗肿瘤活性物质快速筛选方法,并进行了染料浓度选择、线性范围与精密度研究等方法学考察。该方法应用于复杂中药组分中抗肿瘤活性成分的筛选,从26个乌药组分中筛选到两个组分具有较强的抗肿瘤活性,进一步的LC/MS分析结果提示其中的活性化合物可能为异喹啉类生物碱异波尔定碱(Norboldine)、新木姜子碱(Laurolitsine),其中 Norboldine和 Laurolitsine为光学异构体。已有研究表明,Norboldine对L1210和K562细胞有细胞毒作用[7],结合分析结果与文献报道,初步推断乌药中具有抗肿瘤活性的化合物为异波尔定碱(Norboldine)。
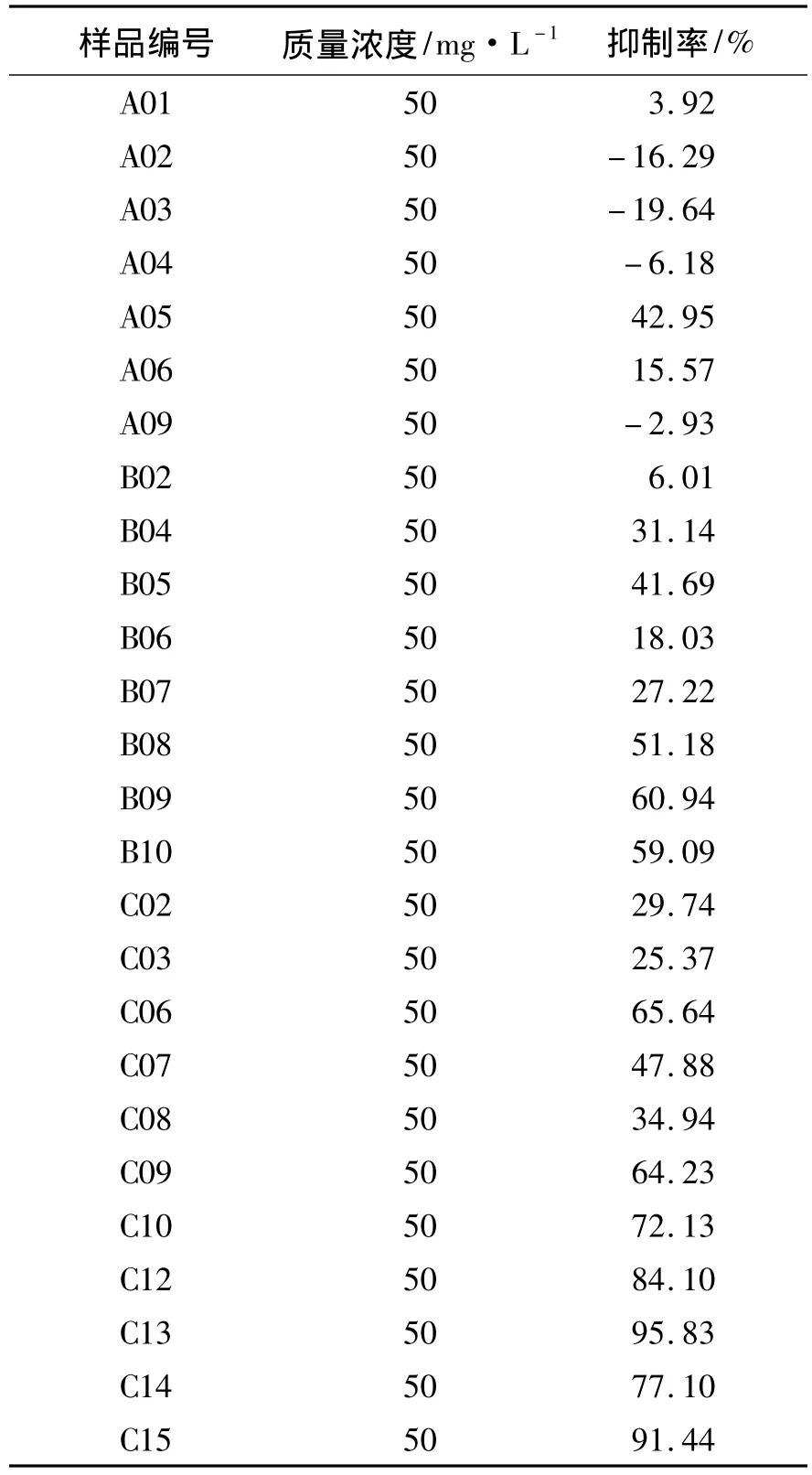
表1 乌药组分体外抗肿瘤活性(n=3)Table 1 Anti-tumor activity of components from Lindera aggregate in vitro(n=3)
传统的体外细胞毒测定方法如台盼蓝染色法、MTT法和SRB法等的动态范围均为1~2 logs[8-10],而本研究采用的FDA荧光标记活细胞法具有4logs的动态范围[11]。同时,本研究采用的细胞荧光图像收集平台具有自动化程度高、快速、灵敏等优点,因此也更适用于抗肿瘤活性物质的大规模筛选。此外,与传统的MTT和SRB法相比,本方法能够在更短的时间(24h)内反映出药物对肿瘤细胞损伤的量效关系,因而更适合于抗肿瘤活性物质的快速筛选。
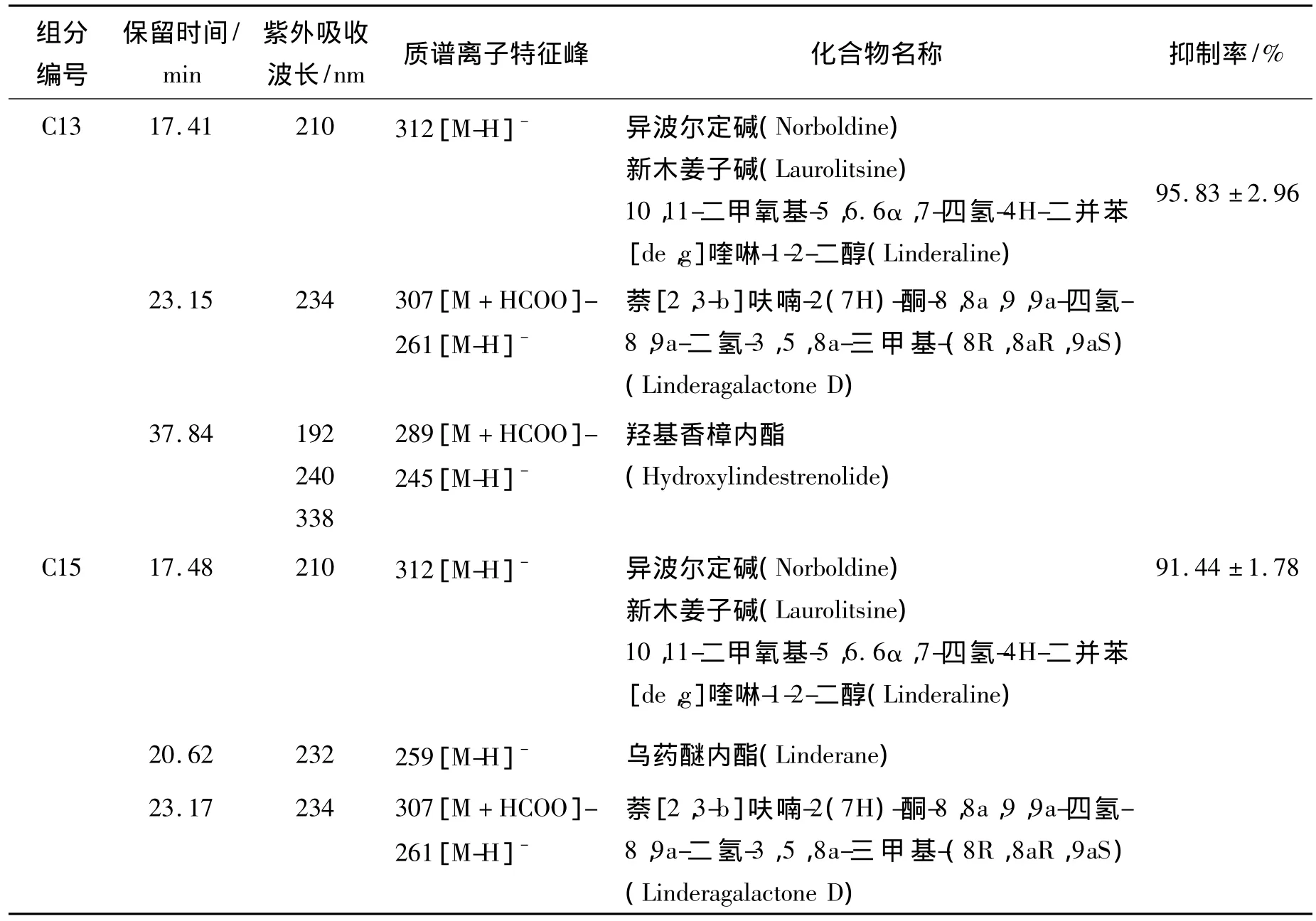
表2 乌药组分C13、C15的液相-质谱分析Table 2 LC/MS analysis of components C13 and C15 from Lindera aggregate
综上所述,本研究发展了一套基于荧光细胞图像自动收集与分析的抗肿瘤活性物质体外筛选方法。该方法快速、稳定并具有较好的线性范围,可用于从复杂中药组分中快速筛选抗肿瘤活性成分,为中药药效物质基础研究提供了新的研究手段。
[1]ZHU Hong-biao,CHEN Qi-gang,SUN Qiu,et al(褚洪标,陈琪冈,孙 秋,等).High throughput preparation fornaturalproductsamples [J].Yunnan Chemical Technology(云南化工),2003,30,58-60.(in Chinese)
[2]WU Zeng-ru,XU Xiao-jie(吴增茹,徐筱杰).Using affinity selection to screen new drugs in combinatorial libraries[J].Chinese Journal of Analytical Chemistry(分析化学),2002,30,101-106.(in Chinese)
[3]GU Lin-na,GU Hao(顾琳娜,顾 昊).Screening method foranti-cancernaturalproducts [J].Herald of Medicine(医药导报),2009,28,496-498.(in Chinese)
[4]HERTZBERG R,Pope A J.High-throughput screening:new technology for the 21stcentury [J].Curr Opin Chem Biol,2000,4:445-451.
[5]PROFFITT R T,TRAN J V,PATRICK REYNOLDS C.A fluorescence digital image microscopy system for quantifyingrelativecellnumbersin tissue culture plates[J].Cytometry,1996,24:204-213.
[6]JIN Y C,ZHAO X P,ZHANG Y F,et.al.A Three-Stage-Integrative (TSI) approach for the identification of hepatotoxic compounds from botanical products.[J].Int J Toxicol,2011,30(3):287-299.
[7]GAN L S,YAO W,MO J X,et al.Alkaloids from Lindera aggregate[J].Nat Prod Commun,2009,4,43-46.
[8]WEISENTHAL L M,MARSDEN J A,DILL P L.A novel dye exclusion method fro testing in vitro chemosensitivity of human tumors [J].Cancer Res,1983,43,749-757.
[9]SOBOTTKA S B,BERGER M R.Assessment of antineoplastic agents by MTT assay:partial underestimation of antiproliferative properties[J].Cancer Chemoth Pharm,1992,30,385-393.
[10]SKEHAN P,STORRENG R,SCUDIERO D.New colorimetric cytotoxicity assay for anticancer-drug screening[J].J Natl Cancer Inst,1990,82,1107-1112.
[11]KESHELAVA N,FRGALAT,KREJSAJ.A microcomputer fluorescence-based cytotoxicity assay for preclinical testing of combination chemotherapy.Methods in Molecular Medicine,vol.110:Chemosensitivity:Vol.1:In Vitro Assays[M].Humana Press,2005,139-153.
