酵母多糖致全身炎症反应综合征大鼠模型的制备
2011-08-06陆麒羽周裕洋王俊波翁家侃
陆麒羽,周裕洋,王俊波,王 琳,孟 璐,翁家侃,余 波,全 胜
(浙江大学城市学院临床医学系,浙江杭州310015)
全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)是感染或非感染因素作用于机体而引起的一种全身性炎症反应综合征。SIRS是常见的危重急症之一,并易发展成多脏器功能障碍综合征(Multiple organ dysfunction syndrome,MODS)甚至多脏器功能衰竭(Multiple Organ failure,MOF),病死率高达70%左右[1]。由于引起SIRS病因十分复杂以及确切的发病机制仍未完全明了,也缺乏理想的动物模型,因而对SIRS相关的实验往往无法得到良好的开展。
本实验通过酵母多糖-石蜡混悬液腹腔注射制作大鼠SIRS模型,力求制作与临床SIRS表现一致,又排除感染因素等外源性干扰因素,符合SIRS诊断标准的动物模型。
1 材料与方法
1.1 实验动物和分组 SD大鼠48只,5~7周龄,体重160~200 g,雌雄各半,由浙江大学医学院动物实验中心提供,恒温22℃室内饲养,正常光照时间8:00 a.m.-20:00 p.m.,无饮食饮水限制。动物实验操作时间为8:00 a.m.-16:00 p.m.。将SD大鼠随机分为正常对照组和模型实验组,模型实验组按不同浓度分为500 mg/kg、750 mg/kg、1 000 mg/kg组,每组12 只。
1.2 主要试剂和设备 酵母多糖(zymosan A)由SIGMA公司(z4250)提供;液体石蜡购自江西德成制药有限公司;TNF-α ELISA定量检测试剂盒由R&D公司提供,IL-6,IL-10 ELISA定量检测试剂盒由博士德生物有限公司提供。
1.3 动物实验 实验前18 h,SD大鼠开始禁食(不禁水),上午8时先称重、测直肠温度,将酵母多糖粉剂和液体石蜡混合,高频振荡15 min,然后在100℃水浴80 min灭菌,制成酵母多糖浓度为100 mg/ml的混悬液,用时以40℃水浴,高频振荡 15 min后以 500 mg/kg、750 mg/kg、1 000 mg/kg剂量分别对3组大鼠进行腹腔注射。对照组注射灭菌生理盐水。模型制作成功的标志根据胡森提供的动物SIRS的一般标准:①直肠温度较正常或伤前升高或降低1℃;②呼吸频率超过正常对照组2倍或PaCO2较对照值降低25%;③白细胞总数超过对照值的2倍或减少50%;④心率较对照值增加50%;⑤主要脏器病理学改变;⑥相关细胞因子改变[9]。根据实验条件以及数据的稳定性,本实验选择①③⑤⑥四项指标来观察SIRS模型是否成功。
1.4 大鼠SIRS模型观察指标和方法 观察24 h和48 h时各组大鼠的死亡率、一般情况、测量其直肠温度和白细胞计数,而后分别取各组大鼠的肝、肺组织,肉眼观察大体病变后,置于10%福尔马林中浸泡固定24h。然后石蜡包埋,切片,HE染色,光学显微镜下观察。
1.5 WBC计数 采用自动血细胞检测仪结合显微镜下手工技术,检测各实验组及对照组大鼠尾静脉血标本中的WBC总数。
1.6 细胞因子的检测 取各组24 h尾静脉血标本,按 TNF-α、IL-6、IL-10 ELISA 定量检测试剂盒提供的操作说明书,检测标本中TNF-α、IL-6、IL-10水平。
1.7 统计方法 所有实验数据均使用SPSS 16.0软件分析,计量资料以均数±标准差(±s)表示,多组计量数据统计采用方差分析(F检验),及组间对照t检验,P﹤0.05为差异具有显著统计学意义。
2 结果
2.1 大鼠的一般情况 对照组大鼠未出现明显的外观及体征改变,实验组大鼠在注射酵母多糖2h后,出现悚毛、气促、反应迟钝、蜷缩等现象,随注射剂量的增加体征改变越明显,并随着时间的延长而加重,重者出现紫绀、昏睡甚至死亡。
2.2 病死率 正常对照组与腹腔注射酵母多糖500 mg/kg组均无大鼠死亡,腹腔注射酵母多糖1 000 mg/kg组24 h死亡数增加不明显,而48 h死亡数较前三组均有明显增加,腹腔注射酵母多糖750 mg/kg组死亡数较前两组增加不明显。具体各组病死率如表1所示。
2.3 白细胞及体温改变 与正常组相比,实验b组、c组、d组24 h及48 h的体温与白细胞计数均降低,差异性非常显著(P﹤0.01),且降低的程度随酵母多糖悬液浓度的增加而增加。具体数值见表2。
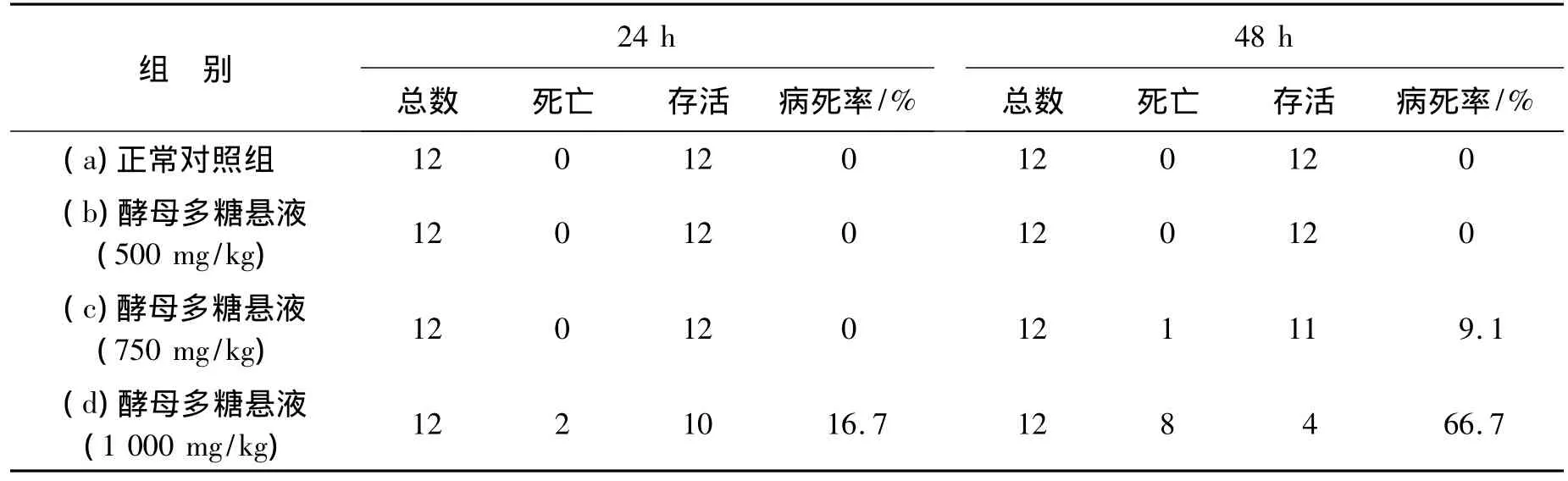
表1 各组大鼠死亡率Table 1 The mortality of rats in each group
表2 各组大鼠温度及白细胞计数统计(±s)Table 2 The temperatures and total WBC numbers of rats in each group(±s)
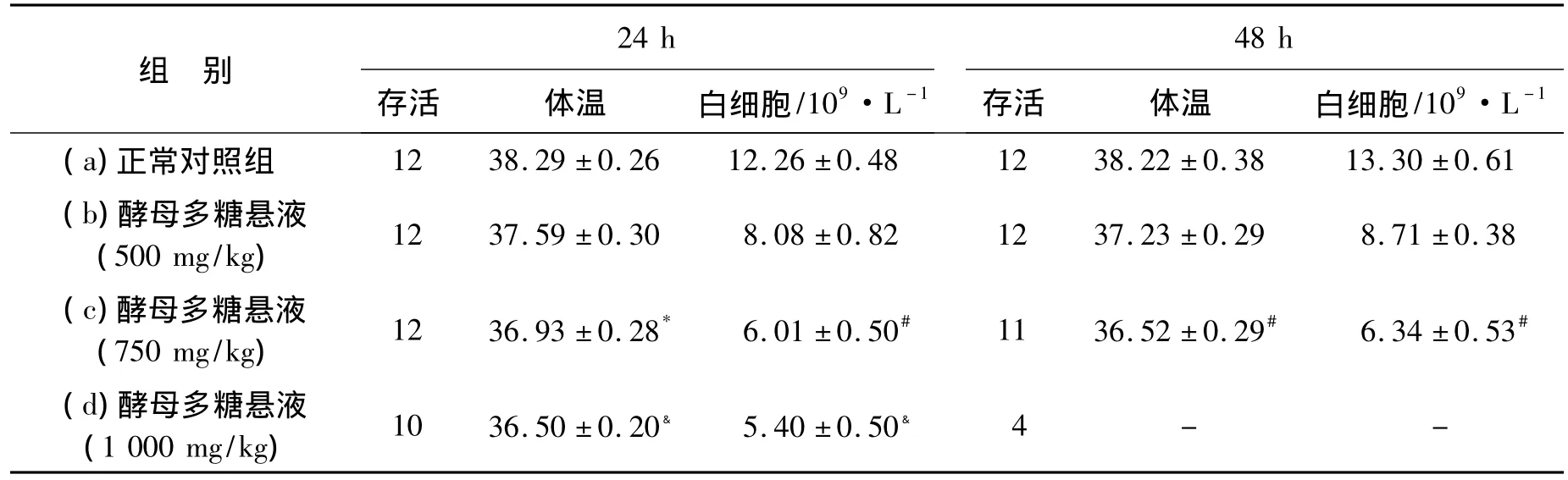
表2 各组大鼠温度及白细胞计数统计(±s)Table 2 The temperatures and total WBC numbers of rats in each group(±s)
48 h时c组大鼠有1只大鼠死亡,11只大鼠参与检测;24 h时d组有2只大鼠死亡,10只大鼠参与检测;48 h后剩余大鼠数小于10只,其结果无统计学意义;24 h时b、c、d各组和48小时b、c各组的体温及白细胞计数与正常对照组(a)比较均为有显著性差异,P<0.01;24、48 h时c组与b组比较,体温及白细胞计数均有明显下降,*P<0.05,#P<0.01;24 h时d组与c组比较,体温及白细胞计数又有明显下降,﹠P<0.01.
组 别24 h存活 体温 白细胞/109·L -1 48 h存活 体温 白细胞/109·L -1(a)正常对照组 12 38.29±0.26 12.26±0.48 12 38.22±0.38 13.30±0.61(b)酵母多糖悬液(500 mg/kg) 12 37.59±0.30 8.08±0.82 12 37.23±0.29 8.71±0.38(c)酵母多糖悬液(750 mg/kg) 12 36.93±0.28* 6.01±0.50# 11 36.52±0.29# 6.34±0.53#(d)酵母多糖悬液(1 000 mg/kg) 10 36.50±0.20﹠ 5.40±0.50﹠4--
2.4 重要脏器病理形态学改变
2.4.1 肺脏 正常对照组大鼠肺组织结构完整,肺泡腔清晰,肺泡隔无水肿、细胞浸润等改变;腹腔注射酵母多糖悬液各组大鼠均出现不同程度的肺泡腔内充血、出血;气管上皮纤毛脱落;肺泡间隔增宽,充血、水肿,血管扩张,大量红细胞、单核巨噬细胞及中性粒细胞浸润,部分肺泡腔塌陷。见图1。
2.4.2 肝脏 正常对照组大鼠肝细胞排列整齐,大小一致,细胞核圆形居中,核膜清晰无明显改变;腹腔注射酵母多糖悬液各组大鼠均出现不同程度的肝小叶中央静脉及周围肝窦明显扩张淤血;肝细胞明显肿胀、胞浆疏松或积水变性,但未见明显灶性坏死。见图2。
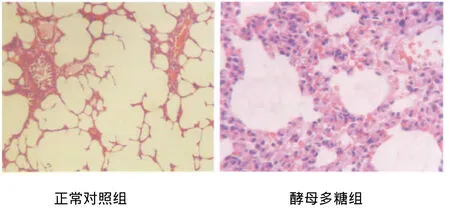
图1 正常对照组与酵母多糖组大鼠肺组织病理形态学改变Fig.1 The histopathological change of lung in control group and zymosan group
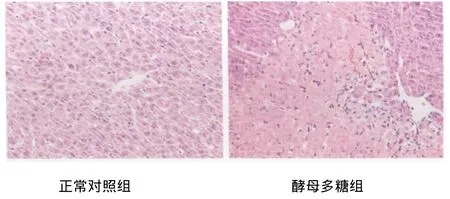
图2 正常对照组与酵母多糖组大鼠肝组织病理形态学改变Fig.2 The histopathological change of liver in control group and zymosan group
2.5 各组细胞因子水平比较与正常对照组比较:实验c组、d组中 TNF-α、IL-6、IL-10 均有显著升高(P <0.01);b组 TNF-α、IL-6均有显著升高(P<0.01),IL-10水平与正常对照组相比无统计学差异(P﹥0.05)。具体数值见表3。
3 讨论
全身炎症反应综合征(SIRS)是由感染因素和(或)非感染因素引起机体全身性、系统性瀑布样持续过度释放炎症因子所致,而脓毒症是感染因素引起的SIRS。过去认为,在脓毒症中微生物为炎症反应的触发物,机体的病理生理反应是由微生物引起的。但目前多项研究证实,脓毒症是病菌引发的反应和机体自身的病理生理改变两方面共同参与的[5]。感染并不是炎症反应的唯一原因。此外,触发因素不能完全影响炎症反应强弱。在Hukkanen的实验中,损伤的最终表现是由机体的免疫力、体质和基因决定的。免疫反应从某种程度上来说是基因的表现型,对于相同的损伤因素,某种特定实验动物易受到严重损伤,而其它的能自行恢复健康。同样的危险因素,高反应的实验动物发展为SIRS的机率大于细胞免疫反应低的[2]。因此可以推测,损伤因素和患者本身的身体素质决定了炎症反应的结局[3]。
表3 大鼠血清TNF-α、IL-6、IL-10水平比较(±s)Table 3 The cytokine levels of rats in each group(±s)
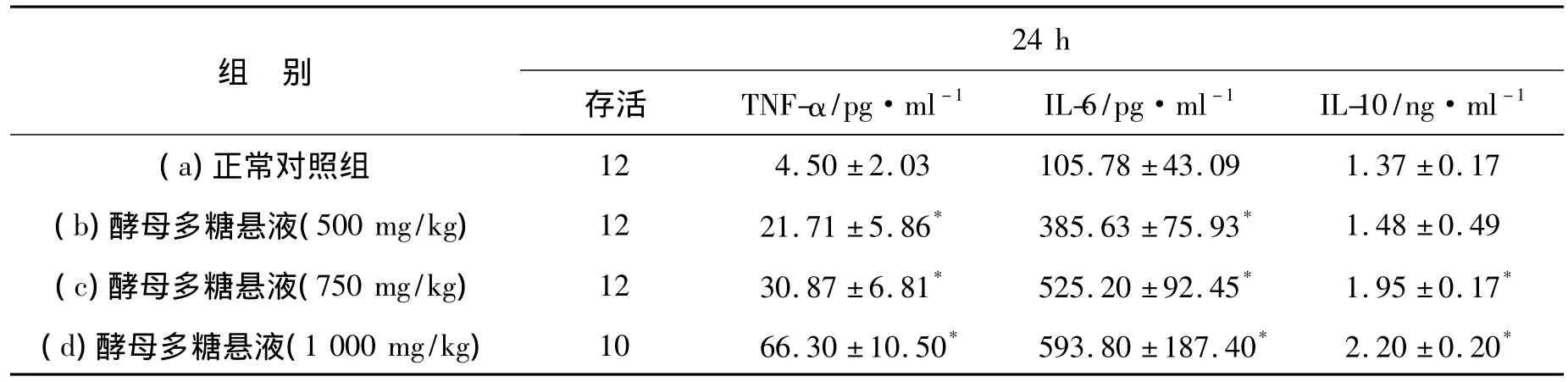
表3 大鼠血清TNF-α、IL-6、IL-10水平比较(±s)Table 3 The cytokine levels of rats in each group(±s)
24 h时d组2只大鼠死亡,10只大鼠参与检测;b、c、d组TNF-α,IL-6,IL-10检测值分别与正常对照组(a)比较,*P<0.01.
组 别24 h存活 TNF-α/pg·ml-1 IL-6/pg·ml-1 IL-10/ng·ml -1 12 4.50±2.03 105.78±43.09 1.37±0.17(b)酵母多糖悬液(500 mg/kg) 12 21.71±5.86* 385.63±75.93* 1.48±0.49(c)酵母多糖悬液(750 mg/kg) 12 30.87±6.81* 525.20±92.45* 1.95±0.17*(d)酵母多糖悬液(1 000 mg/kg) 10 66.30±10.50* 593.80±187.40* 2.20±0.20(a)正常对照组*
目前,制备MODS模型的实验研究较多,但SIRS模型的制作却很少。由于较高的死亡率,MODS引起了人们的高度重视,人们进行了大量MODS动物模型的干预研究,然而却在临床试验中却屡遭失败,死亡率未见下降。作为MODS的前期表现,我们认为SIRS的早期诊断、早期治疗更加重要。如果能在SIRS阶段进行有效的干预,可以从根本上减少MODS的发生,从而降低病死率[8]。
制备SIRS动物模型的方法很多,较常用的有盲肠结扎穿孔术(CLP),急性重症胰腺炎动物模型,细菌、LPS等诱导的SIRS模型[9]。这4种都引进了外源性感染因素,难以排除感染等外因干扰,不能完全反映上述所描述的SIRS本质。而酵母多糖是一种激活剂,它能激活补体系统、前列腺素、白三稀、血小板聚集因子、氧自由基、溶菌酶和巨噬细胞等[2],将其注入大鼠体内,会造成严重的腹腔炎症,但不引入外源性感染,为非感染因素引起的SIRS,与上述描述的SIRS无论是临床表现还是病理改变都较符合。此种炎症反应模型的可取之处在于致病因素简单明确,便于复制,具有明显的SIRS表现[9]。
腹膜是人体内面积最大的上皮组织,受到感染或非感染因素刺激时,易于诱发SIRS[11-12]。因此,本研究采用腹腔注射途径以酵母多糖-石蜡悬液作为刺激物,制备SD大鼠急性腹膜炎模型以诱发SIRS。当腹腔注射500 mg/kg酵母多糖的ZPS时,大鼠SIRS现象不明显,若注射剂量分别增加至含750 mg/kg和1 000 mg/kg时,均能有效诱导大鼠SIRS的发生,尤其是使用高剂量(1 000 mg/kg)时,可导致大鼠注射后48 h内出现高病死率,且多次试验结果均相似。
SIRS相关细胞因子种类繁多,包括TNF-α、IL-1、IL-2、IL-6、IL-10、IL-13 等,SIRS 时主要表现为上述因子失控性合成与释放、启动炎症反应级联放大并形成网络式交互作用[14-15]。在SIRS及 MODS发病过程中,以细胞因子TNF-α、IL-6、IL-10 最为重要[14-16]。TNF-α 是SIRS时启动炎症因子级联反应的始发因子,不仅可以激活各种炎性细胞,其本身也是一种致热原,同时还可降低血管张力、心肌收缩力及增加血管通透性[17-18]。Miyaoka 等[13]的研究显示外科手术后第一天患者IL-6和IL-10水平上升,且IL-6浓度以及IL-6与IL-10之比在SIRS患者中较非SIRS患者为高,由此得出检测血清TNF-α、IL-6与IL-10水平可作为一种预测SIRS的方法。
上述结果表明,酵母多糖诱导大鼠SIRS有剂量依赖性和高重复性,稳定可靠的大鼠SIRS模型可作为SIRS发病机制研究、药物筛选等的有效工具。
[1]BONE R C,BALK R A,CERRA F B,et al.Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis [J].American College of Chest Physicians/Society of Critical Care Medicine(TheACCP/SCCM)consensusconference committee Chest,1992,101:1644-1655.
[2]MARIA P,MELISSA E G,JOSEPH A S,et al.Role and regulation ofadipokines during zymosaninduced peritoneal inflammation in mice [J].Endocrinology,2008,149:4080-4085.
[3]R R HUKKANEN,H D LIGGIT,R D MURNANE,et al.Systemic inflammatory response syndrome in nonhuman primates culmmating in multiple organ failure, acute lung injury, and disseminated intravascular coagulation [J].Toxicologic Pathology,2009,37:799-804.
[4]R C BONE,MD.IMMUNOLOGIC DISSONANCE.A Continuing evolution in our understanding of the systemic inflammatory response syndrome(SIRS)and the multiple organ dysfunction syndromes(MODS) [J].Annals of Internal Medicine,1996,125(8):680-687.
[5]PER-OLOF N.The systemic inflammatory response syndrome:definitions and aetiology[J].BSAC,1998,41:1-7.
[6]JASON E,IAN G.Current concepts in the diagnosis and management of trauma-related sepsis [J].Trauma,2004,6:1-11.
[7]XI-PING ZHANG,HUA TIAN,DI-JIONG WU.Pathological changes in multiple organs of rats with severe acute pancreatitis treated by baicalin and octreotide[J].Hepatobiliary Pancreat Dis Int,2009,8(1):85-92.
[8]XU Peng,LI Shu-sheng(徐 鹏,李树生),The significance ofSystemicInflammatory Response Syndrome in Multiple Organ Dysfunction Syndrome[J].Journal of New Medicine(医学新知杂志),2006,16(2),106-108.(in Chinese)
[9]HU Sen,SHENG Zhi-Yong,ZHOU Bao-Tong(胡森,盛志勇,周宝桐).the research progress of animalmodelin Multiple Organ Dysfunction Syndrome[J].Chines Critical Care Medicine(中国危重病急救医学),1999,11(8),504-507.(in Chinese)
[10]LIU Hai-Tao,MENG Lu-Dan,WU Shu-Yue(刘海涛,蒙陆丹,吴曙粤).The report progress of Laboratory early-warning index for the early diagnosis to Systemic Inflammatory Response Syndrome and Multiple Organ Dysfunction Syndrome[J].Internal Medicine(内科),2008,3(1):89-91.(in Chinese)
[11]CHADZINSKA M,STAROWICZ K,SCISLOWSKA-CZARNECKA A,et al.Morphine-induced changes in the activity of proopiomelanocortin and prodynorphin systems in zymosan-induced peritonitis in mice[J].Immunol Let,2005,101:185-192.
[12]CUNNEEN J,CARTWRIGHT M.The puzzle of sepsis:fitting thepiecesoftheinflammatory response with treatment[J].AACN Clin Issue,2004,15:18-24.
[13]MIYAOKA K,IWASE M,SUZUKI R,et al.Clinical evaluation of circulating interleukin-6 and interleukin-10 levels after surgery-induced inflammation[J].J Surg Res,2005,125(2):144-150.
[14]RIEWALD M,RUF W.Science review:role of coagulation protease cascade in sepsis[J].Crit Care,2003,7:123-129.
[15]ELY E W,KLEINPELL R M,GOYETTE R E.Advances in the understanding of clinical manifestations and therapy of severe sepsis:an update for critical care nurses[J].AM J Crit Care,2003,12:120-133.
[16]FERRER T J,WEBB J W,WALLACE B H,et al.Interleukin-10 reduces morbidity and mortality in murine multiple organ dysfunction syndrome(MODS)[J].J Surg Res,1998,77:157-164.
[17]MORRIS P E,HITE R D,OHL C.Relationship between the inflammation and coagulation pathways in patients with severe sepsis:implications for therapy with activated protein C [J].Bio Drugs,2002,16:403-417.
[18]CHADZINSKA M, STAROWICZ K,SCISLOWSKA-CZARNECKA A,et al.Morphineinduced changes in the activity of proopiomelanocortin and prodynorphin systems in zymosan-induced peritonitis in mice [J].Immunol Let,2005,101:185-192.
