SIRNA抑制感染细胞模型中HCV复制的研究
2011-08-06邢小康何继亮
邢小康,何继亮,陈 智
(1.浙江大学医学院附属第一医院传染病诊治国家重点实验室,浙江杭州310003;2.浙江大学医学院环境医学系,浙江杭州310058)
丙型病毒性肝炎是由丙型肝炎病毒(Hepatitis C virus,HCV)感染导致的全球传染性疾病,也是导致肝硬化和肝癌的主要原因之一。目前,聚乙二醇干扰素联合利巴韦林治疗是丙型肝炎的标准治疗方案,但这种抗病毒疗法仅仅对部分患者有较好疗效,并且存在使用禁忌、个体差异和药物副作用等问题。因此,亟待开发新的安全有效的替代疗法。
RNA干扰是近些年来用于各种疾病干预的新的基因治疗方法。在抗HCV方面,RNA干扰虽尚未应用于临床,但在实验室研究中已经取得了一定的进展[1-3],研究主要集中在含有HCV全长或亚基因组复制子的稳定转染模型中进行,而对于在HCV病毒颗粒感染的细胞中能否有效抑制HCV复制未见报道。本研究通过构建HCV感染细胞模型,研究靶向 HCV NS5B基因的siRNA能否有效抑制HCV复制,通过检测siRNA对细胞内PKR基因的激活作用,进一步探讨病毒抑制是否通过PKR介导的固有免疫途径。
1 材料与方法
1.1 材料
1.1.1 细胞株及质粒 HCV全长基因组质粒pFL-JC1由美国Apath公司惠赠,Huh7.5.1细胞源自美国斯克利普斯研究所Scott Forrest教授,由上海巴斯德研究所钟劲教授提供。
1.1.2 主要试剂 DMEM培养基、胎牛血清、胰蛋白酶、Opti-MEM培养基购自GIBCO公司;脂质体Lipofectamine 2000和总RNA提取试剂Trizol Reagent购自Invitrogen公司;T7体外转录试剂盒购自 Promega公司;限制性内切酶XbaⅠ、绿豆核酸酶、蛋白酶K购自NEB公司;RNA纯化试剂盒购自Qiagen公司;HCV核心蛋白单克隆抗体购自美国Meridian Life Science公司;FITC标记的山羊抗小鼠IgG二抗购自Sigma公司;逆转录试剂盒、SYBR Green荧光定量PCR试剂盒购于Takara公司;IFNα-2b购于PBL(Pestka Biomedical Laboratories)公司;siRNA由广州锐博生物科技有限公司合成;荧光定量PCR扩增引物由上海生工生物工程有限公司合成。
1.1.3 主要仪器 荧光定量PCR仪(美国应用生物系统公司生产)、荧光显微镜成像系统(日本OLYMPUS公司生产)、CO2培养箱(美国Thermo公司生产)。
1.2 方法
1.2.1 细胞培养 Huh-7.5.1细胞用含10%胎牛血清的DMEM培养基在37℃、5%CO2饱和湿度的培养箱中培养。培养基中添加100 U/ml的青霉素和100 μg/ml的链霉素。
1.2.2 HCV RNA转录体的制备 取15 μg pFL-J6JFH-1质粒,用限制性内切酶XbaⅠ进行酶切反应,37℃孵育2 h,之后用琼脂糖凝胶电泳检测是否完全线性化。将酶切产物用绿豆核酸酶和蛋白酶K消化处理,然后用酚氯仿法抽提纯化 DNA,最后用12 μl H2O溶解 DNA,再经琼脂糖凝胶电泳检测并定量。然后取2 μg DNA模板,用T7体外转录试剂盒按照说明书操作进行体外转录。得到的RNA转录体经琼脂糖凝胶电泳检测并测定浓度。
1.2.3 HCV感染细胞模型的建立 转染前1天用0.25%胰酶消化收集细胞,接种于6孔细胞培养板,每孔加入2 ml含血清不含抗生素的DMEM培养基培养24 h,待细胞生长至60% ~70%汇合度时转染。转染时,以每孔4 μg HCV RNA用250 μl Opti-MEM培养基稀释,再以每孔5 μl脂质体用250 μl Opti-MEM培养基稀释并室温放置5 min,将稀释后的HCV RNA与脂质体轻轻混合,室温孵育20 min。然后每孔加入500 μl RNA-Lipofectamine复合物,轻摇混匀后置于细胞培养箱孵育。6 h后弃去培养液,每孔加入2 ml DMEM完全培养基继续培养。转染后第3天,收集细胞上清培养基,1 500 g离心5 min去除细胞碎片,置于-70℃保存。重新种植Huh-7.5.1细胞于六孔细胞培养板,待细胞达50% ~60%融合度时,每孔加入2 ml收集的细胞上清,培养箱中孵育6 h后用PBS清洗3次,加入完全培养基继续培养。
1.2.4 间接免疫荧光检测感染细胞中HCV核心蛋白的表达 用HCV感染细胞制备细胞爬片,取出爬片放入12孔板中,用PBS洗3次后加入4%多聚甲醛,室温固定15 min。弃去固定液,PBS洗3次。然后加入含10%FBS的PBS室温封闭 30 min。PBS洗 2次后用含0.1%Triton X-100封闭液稀释(1∶200)的一抗37℃孵育2 h,用PBS洗3次,加入二抗稀释液(1∶500),37℃避光孵育1 h,再用PBS避光洗4~5次。用甘油-PBS封片,立即在荧光显微镜下观察并拍照。
1.2.5 siRNA的设计 利用ABI在线设计程序,针对 HCV NS5B序列初步搜索出多条siRNA 序列,然后根据 Reynolds[4]提出的理性设计原则筛选得出最终的siRNA序列,委托广州锐博公司进行化学合成。siRNA序列如下:

1.2.6 RNA干扰试验 待感染细胞长满后,收集各孔细胞并混匀,接种于24孔板,脂质体转染siRNA。设9个NS5B siRNA组(浓度为4、40 和200 nmol/L,作用时间为 24 h、48 h 和72 h),并于三个时间点分别设空白对照、脂质体对照、无关siRNA对照以及IFNα-2b(1 000 IU/ml)组。转染方法同上,每组设3个复孔。
1.2.7 siRNA对PKR基因激活试验 siRNA转染正常Huh-7.5.1细胞。设空白对照组、3个siRNA 组(4、40和 200 nmol/L siRNA)和1 000 IU/ml IFNα-2b处理组。转染方法同上,每组设3个复孔。
1.2.8 总RNA提取及cDNA合成 胰酶消化后用1.5 ml离心管收集细胞,PBS离心清洗3次。每管加入500 μl Trizol,按照操作说明提取总RNA,最后用30 μl DEPC水溶解 RNA,紫外分光光度计测定浓度。取4 μl RNA按照逆转录试剂盒操作说明先去除基因组DNA,然后进行逆转录反应,反应体系为20 μl。
1.2.9 荧光定量PCR检测细胞内HCV RNA及PKR mRNA相对量 分别加入10 μl SYBR Ex Taq 酶、0.4 μl ROX 参比染料、0.4 μl上下游引物、6.8 μl H2O 和 2 μl cDNA 模板配成PCR 20 μl反应体系,于荧光定量PCR仪中进行扩增。用于检测HCV的引物位于HCV 5'UTR,上游序列:5'-GCGTTAGTATGAGTGTCG TG-3',下游序列:5'-TCGCAAGCACCCTATCAG-3';内参基因3-磷酸甘油醛脱氢酶(GAPDH)扩增引物,上游:5'-GAAGGTGAAGGTCGGAGTC-3',下 游:5'-GAAGATGGTGATGGGATTTC-3';PKR 扩增引物,上游:5'-TCTACGCTTTGGGG CTAA-3',下 游:5'-GCCATCCCGTAGGTCTGT-3'。扩增条件为:95℃ 30 s;95℃ 5 s,60℃34 s,共40个循环;PCR反应结束后进行熔解曲线分析。所有样品目的基因相对表达水平经内标基因GAPDH均一化处理后计算。
2 结果
2.1 HCV感染模型的建立 结果见图1。用间接免疫荧光试验可检测出HCV核心蛋白在被感染的Huh-7.5.1细胞中表达,但正常Huh-7.5.1细胞未检测出HCV核心蛋白的表达。

图1 被感染的Huh-7.5.1细胞中HCV核心蛋白免疫荧光检测结果Fig.1 HCV core protein expression in infected(lane1)and normal(lane2)Huh-7.5.1 cells detected by indirect immunofluorescence
2.2 siRNAs对感染细胞中HCV复制的抑制作用检测结果 结果见图2。脂质体组和无关siRNA组与对照组相比,HCV RNA水平均无明显差异(P>0.05)。24 h时,40 nmol/L与200 nmol/L siRNA组HCV RNA水平明显低于对照组(P<0.05)。48 h时,3个 siRNA组 HCV RNA水平与对照组相比均明显下降(P<0.01)。72 h时3个siRNA组HCV RNA水平与对照组相比也均明显下降(P<0.01)。3个浓度siRNA组之间均无明显差异(P>0.05)。48 h、72 h 3个siRNA组HCV RNA水平与相应的24 h组相比均显著下降(P<0.01)。
2.3 IFNα-2b对感染细胞中HCV的抑制作用的检测结果 结果见图3。1 000 IU/ml的IFN作用24 h HCV RNA水平明显低于对照组(P<0.05),48 h与72 h时HCV RNA水平与对照组相比差异非常显著(P<0.01)。48 h和72 h组与24 h组相比,HCV RNA水平下降更为明显(P<0.05)。
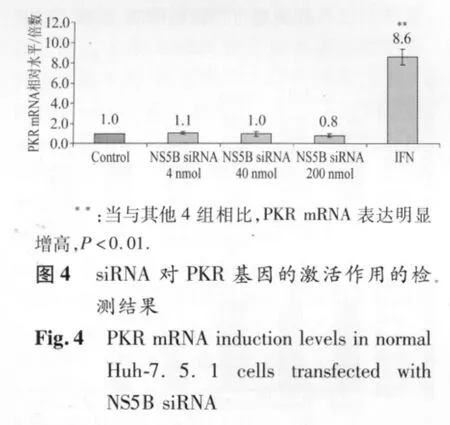
2.4 siRNA对PKR的激活作用的检测结果结果见图4。与对照组相比,3种浓度的NS5B siRNA所诱发的细胞内PKR mRNA水平无明显差异,但IFN处理组明显高于对照组和3个NS5B siRNA组(P<0.01)。
3 讨论
RNA干扰一种由双链RNA介导的序列特异性转录后基因沉默机制。长的双链RNA被细胞内的一种Ⅲ型核糖核酸酶Dicer剪切为21~23 bp的小干扰RNA(siRNA)分子[5-6],siRNA 继而与相关蛋白形成RNA诱导的基因沉默复合体(RISC)[7],其中反义链与mRNA同源序列结合,以序列特异性方式导致目标mRNA的降解[8]。HCV 是一种单股正链RNA病毒,其基因组RNA既可以作为复制模板又可以作为mRNA直接行使翻译功能,另外,HCV主要定植于肝脏这个核酸分子和病毒载体的理想靶向器官,这些特点决定了HCV-RNA可以作为siRNA的有效靶分子[9]。
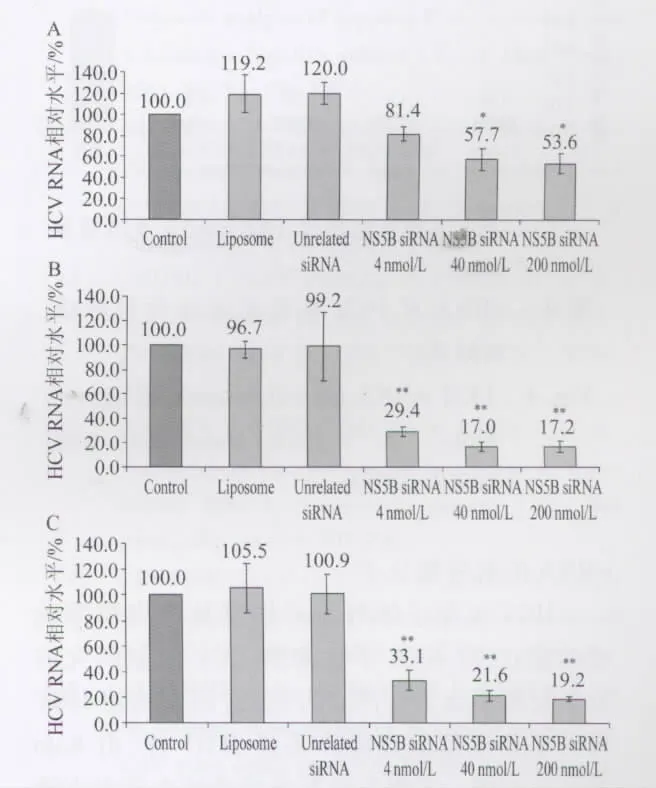
图2 siRNAs对感染细胞中HCV复制的抑制作用检测结果Fig.2 Effect of NS5B siRNA on HCV RNA levels in infected Huh-7.5.1 cells
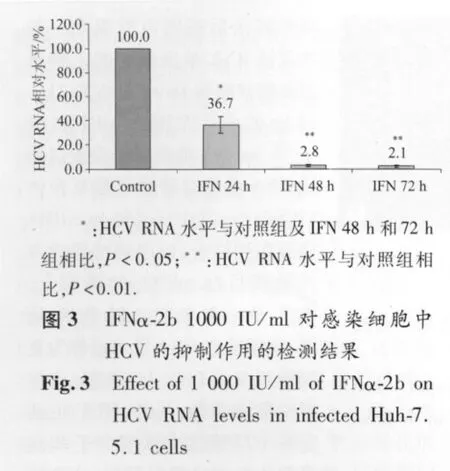
HCV复制子体外培养模型及感染模型的成功建立,对RNA干扰抑制HCV复制研究的发展发挥了巨大作用。目前,常用于构建HCV体外培养模型的克隆体系是JFH1株,由Kato等从日本的一名爆发性肝炎患者的血清中克隆得到[10]。常用的培养细胞为人肝癌细胞株Huh-7及其衍生细胞系Huh-7.5和Huh-7.5.1。Huh-7细胞是目前公认的可以支持HCV高水平复制的肝癌细胞株,Huh-7.5.1细胞是对含HCV复制子的 Huh-7.5细胞[11]用 IFNγ长期处理获得的[12]。Wakita等利用 HCV JFH1全基因组RNA转染Huh-7细胞,并证实了在此细胞中能够进行复制,但复制效率不高,产生的病毒颗粒感染性较低[13]。Lindenbach等构建了HCV 2a JFH1与J6的嵌合株pFL-JC1,并证实了比JFH1株转染Huh-7.5细胞具有更高的复制效率[14]。Zhong等则利用 JFH1 RNA转染Huh-7.5.1细胞,产生了具有高感染活性的病毒颗粒[12]。本研究用pFL-JC1转染Huh-7.5.1细胞后用上清孵育天然的Huh-7.5.1细胞,通过间接免疫荧光检测证实了天然Huh-7.5.1细胞成功被感染。由于HCV RNA瞬时转染细胞模型中病毒RNA的量过多(数据未显示),并不能模拟人体肝细胞真实被感染状态。因此,我们欲将RNA干扰试验在HCV感染模型中进行。
NS5B蛋白为RNA依赖的 RNA聚合酶(RdRp),是催化 HCV RNA合成的关键酶。HCV复制是以HCV基因组正链RNA为模板合成负链RNA,再以负链RNA为模板合成子代正链RNA。正因为RdRp对HCV复制的重要作用,NS5B不断被选择作为各种抗病毒治疗的重要靶位。我们根据Elbashir等提出的设计规则[15],结合 Reynolds提出的理性设计原则[4],针对NS5B基因序列设计出siRNA序列并化学合成,采用与脂质体形成复合物的方式转染被感染的Huh-7.5.1细胞。从总的结果来看,针对NS5B的siRNA可以有效抑制被感染的Huh-7.5.1细胞中的HCV复制。其中,40 nmol/L浓度的siRNA比4nmol浓度抑制率更高,而200 nmol/L浓度抑制效果相对40 nmol/L并没有提高,提示抗HCV的siRNA在较低剂量时即具有很高的基因沉默效率。在siRNA作用时间上,可以看出RNA干扰发挥最大效应的时间点在48 h,而72 h时干扰效率得到了维持,这与IFN的作用相一致。
在哺乳动物中,超过30 bp的双链RNA就可能会产生干扰素反应[16]。最初的研究认为siRNA足够短且足够特异性而不会激活机体的免疫系统,但是现在越来越多的证据显示siRNA也可以激活固有免疫,诱导干扰素产生。PKR介导的干扰素反应被认为是机体抵御病毒感染的重要途径。为了说明本研究中siRNA导致的病毒抑制是相对特异性的,而并非通过激活PKR基因的表达,我们检测了转染siRNA的细胞内PKR mRNA的变化。结果显示,3种浓度的siRNA均没有导致PKR mRNA表达量上调,而对照组IFN则导致PKR mRNA明显增加。但是,我们不清楚有无其他抗病毒蛋白被诱导而产生协助抑制病毒的作用。
尽管在感染细胞中,针对HCV NS5B的siRNA有效抑制了病毒复制,但靶向HCV其他基因区段的siRNA是否具有类似作用或更强的抑制效果还需要进一步研究。本研究中,siRNA的最佳抑制效率并没有达到IFN的药效,考虑存在病毒逃逸可能。IFN的药效显示siRNA对病毒尚有进一步的抑制空间,那么联合应用几种针对HCV不同基因区段的siRNA是否可以应对病毒逃逸策略而达到更好的抑制效率也需进一步探索。在siRNA应用于临床治疗之前,如何安全高效靶向运送siRNA药物仍然是我们面临的巨大挑战,虽然目前可以在体外或体内将siRNA通过病毒载体运送至细胞,但病毒载体缺乏器官特异性,且在人体中的安全性也有待研究。总之,尽管目前siRNA抗HCV的临床应用还面临诸多障碍,但随着整个RNA干扰技术的不断发展以及对HCV的深入认识,相信在不久的将来,RNA干扰有望成为慢性丙型肝炎新的治疗方法。
[1]KAPADIA S B, BRIDEAU-ANDERSEN A,CHISARI F V.Interference of hepatitis C virus RNA replication by short interfering RNAs[J].Proc Natl Acad Sci USA,2003,100(4):2014-2018.
[2]YOKOTA T,SAKAMOTO N,ENOMOTO N,et al.Inhibition of intracellular hepatitis C virus replication by synthetic and vector-derived small interfering RNAs[J].EMBO Rep,2003,4(6):602-608.
[3]SAKAMOTO N,TANABE Y,YOKOTA T,et al.Inhibition ofhepatitis C virus infection and expression in vitro and in vivo by recombinant adenovirus expressing short hairpin RNA [J].J Gastroenterol Hepatol,2008,23(9):1437-1447.
[4]REYNOLDS A,LEAKED,BOESEQ,etal.Rational siRNA design for RNA interference[J].Nat Biotechnol,2004,22(3):326-330.
[5]ELBASHIR S M,HARBORTH J,LENDECKEL W,et al.Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells [J].Nature,2001,411(6836):494-498.
[6]ELBASHIR S M,LENDECKEL W,TUSCHL T.RNA interference is mediated by 21-and 22-nucleotide RNAs[J].Genes Dev,2001,15(2):188-200.
[7]NYKANEN A,HALEY B,ZAMORE P D.ATP requirements and small interfering RNA structure in the RNA interference pathway [J].Cell,2001,107(3):309-321.
[8]HAMMOND S M,BERNSTEIN E,BEACH D,et al.An RNA-directed nuclease mediates posttranscriptional gene silencing in Drosophila cells[J].Nature,2000,404(6775):293-296.
[9]KHALIQ S,KHALIQ S A,ZAHUR M,et al.RNAi as a new therapeutic strategy against HCV [J].Biotechnol Adv,2010,28(1):27-34.
[10]KATO T,FURUSAKA A,MIYAMOTO M,et al.Sequence analysis of hepatitis C virus isolated from a fulminant hepatitis patient[J].J Med Virol,2001,64(3):334-339.
[11]BLIGHT K J,MCKEATING J A,RICE C M.Highly permissive cell lines for subgenomic and genomic hepatitis C virus RNA replication[J].J Virol,2002,76(24):13001-13014.
[12]ZHONG J,GASTAMINZA P,CHENG G,et al.Robust hepatitis C virus infection in vitro[J].Proc Natl Acad Sci USA,2005,102(26):9294-9299.
[13]WAKITA T,PIETSCHMANN T,KATO T,et al.Production of infectious hepatitis C virus in tissue culture from a cloned viral genome [J].Nat Med,2005,11(7):791-796.
[14]LINDENBACH B D,EVANS M J,SYDER A J,et al.Complete replication of hepatitis C virus in cell culture[J].Science,2005,309(5734):623-626.
[15]ELBASHIR S M,HARBORTH J,WEBER K,et al.Analysis of gene function in somatic mammalian cells using small interfering RNAs[J].Methods,2002,26(2):199-213.
[16]PERSENGIEV S P,ZHUX,GREENMR.Nonspecific,concentration-dependentstimulation and repression of mammalian gene expression by small interfering RNAs(siRNAs)[J].RNA,2004,10(1):12-18.
