HUH7.5.1细胞感染HCV观察干扰素治疗后MIRNA表达谱变化
2011-08-06邢小康宋广忠
鲁 兖,邢小康,宋广忠,陈 智
(1.浙江大学医学院附属第一医院传染病诊治国家重点实验室,浙江杭州310003;2.浙江大学医学院附属第二医院,浙江杭州310009)
丙型肝炎病毒(HCV)是引起肝脏病变和诱发肝癌的主要病原体之一,它极易变异,因此研制疫苗难度很大。而且其治疗方法有限,目前主要采用干扰素联合利巴韦林治疗的方法,但部分患者效果不甚理想。因此,探寻HCV在感染后是通过哪些方式复制的以及干扰素对HCV是如何作用的,就显得越来越重要了。
mi-RNA是一类长约22个核苷酸的内源性非编码单链RNA分子,自1993年第一个mi-RNA编码基因lin-4由Lee等在线虫体内发现以来,迄今为止结合基因克隆和各种生物信息学方法已经发现了5000余种mi-RNA,其中包括500余种人mi-RNA,它们在人类的基因表达上扮演着重要的角色[1]。一旦mi-RNA对基因表达的调控出了问题,就有可能导致疾病的发生。近来,许多研究表明mi-RNA参与多种病毒复制的调节,有些宿主和病毒都可以编码mi-RNA,并且两者都在调控病毒生存周期及病毒与宿主相互作用的过程中起到非常关键的作用。
目前已有报道,mi-RNA122可以与HCV基因组相互作用调节HCV的表达,当mi-RNA122被灭活,HCV复制水平明显降低[2]。那么,是不是有更多的mi-RNA可能与HCV的复制转录有关?干扰素究竟能在什么层面上对病毒发挥作用?为此,我们做了以下实验并结合文献,希望能筛选出与HCV感染和干扰素治疗有关的mi-RNA。
1 材料与方法
1.1 细胞及主要试剂 Huh7.5.1细胞来自美国斯克利普斯研究所Scott Forrest教授,由上海巴斯德研究所钟劲教授提供。质粒pFL-JC1由美国Apath公司惠赠。DMEM培养基、胎牛血清、胰蛋白酶、Opti-MEM培养基购于GIBCO公司;脂质体Lipofectamine 2000和总RNA提取试剂Trizol Reagent购于Invitrogen公司;T7体外转录试剂盒购于Promega公司;逆转录试剂盒、SYBR Green荧光定量 PCR试剂盒购于Takara公司;IFNα-2b购于PBL(Pestka Biomedical Laboratories)公司。
1.2 实验方法
1.2.1 细胞培养 把Huh-7.5.1细胞加入含10%胎牛血清的DMEM培养基中,于37℃、5%CO2饱和湿度的培养箱中培养。DMEM培养基中添加100 U/ml的青霉素和100 μg/ml的链霉素。
1.2.2 HCV感染细胞模型的建立及验证pFL-J6JFH-1质粒用T7体外转录试剂盒按照说明书操作进行体外转录,得到HCV RNA转录体。在6孔细胞培养板上接种Huh-7.5.1细胞,每孔中加入2 ml含血清不含抗生素的DMEM培养基培养24 h,当细胞培养达到60%~70%汇合度时,把HCV RNA转染进去。转染时,以每孔 2 μg HCV RNA 用 250 μl Opti-MEM培养基稀释,再以每孔5 μl脂质体用250 μl Opti-MEM培养基稀释,并室温放置5 min,将稀释后的HCV RNA与脂质体轻轻混合,室温孵育20 min以形成复合物。然后每孔加入500 μl RNA-Lipofectamine复合物,轻摇混匀后置于细胞培养箱孵育。6 h后弃去培养液,每孔加入2 ml DMEM完全培养基继续培养。转染后第3天,收集细胞上清培养基。把Huh-7.5.1细胞重新接种在6孔细胞培养板上,待细胞达50% ~60%融合度时,每孔加入2 ml收集的细胞上清,培养箱中孵育4 h后用PBS清洗3次,加入完全培养基继续培养。
孵育后第3天,用Trizol提取感染细胞内总RNA。按照逆转录试剂盒与荧光定量PCR试剂盒操作说明对细胞内HCV RNA进行扩增,同时利用正常Huh-7.5.1细胞作为对照。
1.2.3 IFN处理HCV感染细胞 IFNα-2b以1 000 IU/ml处理上述HCV感染细胞,48 h后再次利用荧光定量PCR检测细胞内HCV RNA水平。同时用未经任何处理的感染细胞作为对照。
1.2.4 microRNA表达谱分析 用384孔TaqMan Low Density Array(A板)分析3组样本的microRNA表达谱(参照试剂说明书)。方法为:配制PCR反应液 在1.5 ml离心管里依次加入 TaqMan Universal PCR Master Mix 450 μl,RT 产物 6 μl,无核酶水 444 μl(共计 900 μl);上样 将 100 μl PCR反应液加入到 TaqMan MicroRNA Array的各自通道(共8道),离心后封口。启动SDS v2.2程序运行384孔TaqMan Low Density Array默认的热循环条件,分析microRNA表达谱(A板)。
1.3 数据分析 采用2(-ΔΔCT)法分析组间microRNA的表达情况,筛选出差异表达的microRNAs。
2 结果
2.1 HCV感染细胞模型的建立 结果见图1。在感染的Huh-7.5.1细胞中成功地检测到了HCV RNA,而正常细胞组则无HCV RNA扩增。内标基因GAPDH的扩增曲线说明了样品均一性较好。
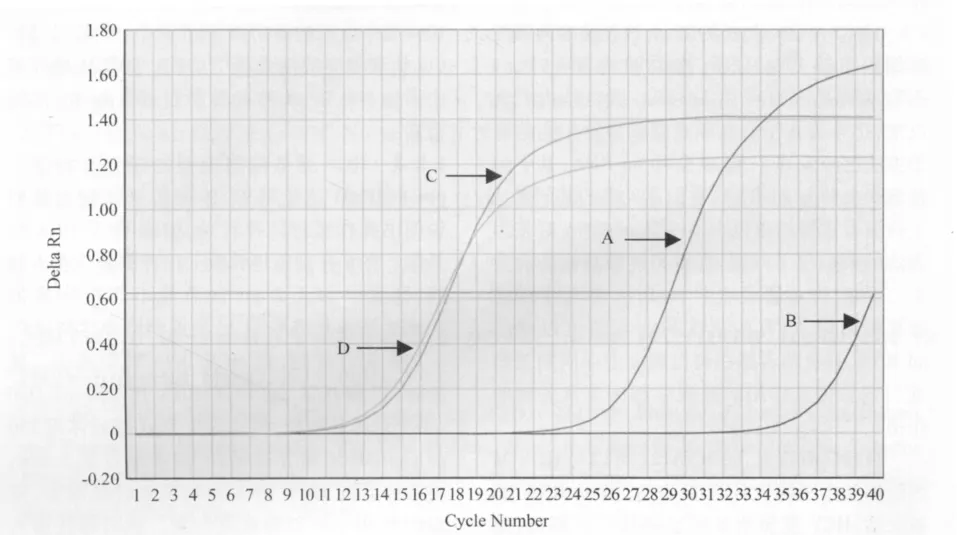
图1 感染细胞中HCV RNA荧光定量PCR扩增曲线Fig.1 FQ-PCR amplification curve of HCV RNA in infected cell lines
2.2 microRNA表达谱分析本研究结果 分为Huh7.5.1细胞对照组,HCV感染组和感染后干扰素治疗组,经筛选的microRNA表达谱见表1。
3 讨论
本研究分为Huh7.5.1细胞对照组、HCV感染组和感染后干扰素治疗组。通过miRNA芯片对已知的380个mi-RNA进行了检测,许多mi-RNA发生了变化。经过统计分析,我们发现其中有13种mi-RNA在HCV感染后表达上调,而在干扰素治疗后则出现下调,另外还有7种mi-RNA则在HCV感染后出现表达下调,而在干扰素治疗后则发生上调(见表1)。因此,这些变化的mi-RNA很可能与HCV病毒的感染和清除过程有一定的相关性,即它们的表达差异或许是因为病毒的感染和清除而被动发生改变,亦或者是它们的表达水平变化在HCV的病毒感染和干扰素清除病毒的过程中发挥着一定的调控作用。鉴于此,我们结合已报道的文献,在发生以上改变的mi-RNA中选取一些进行分析,推测它们与病毒的感染和清除可能存在着的联系。
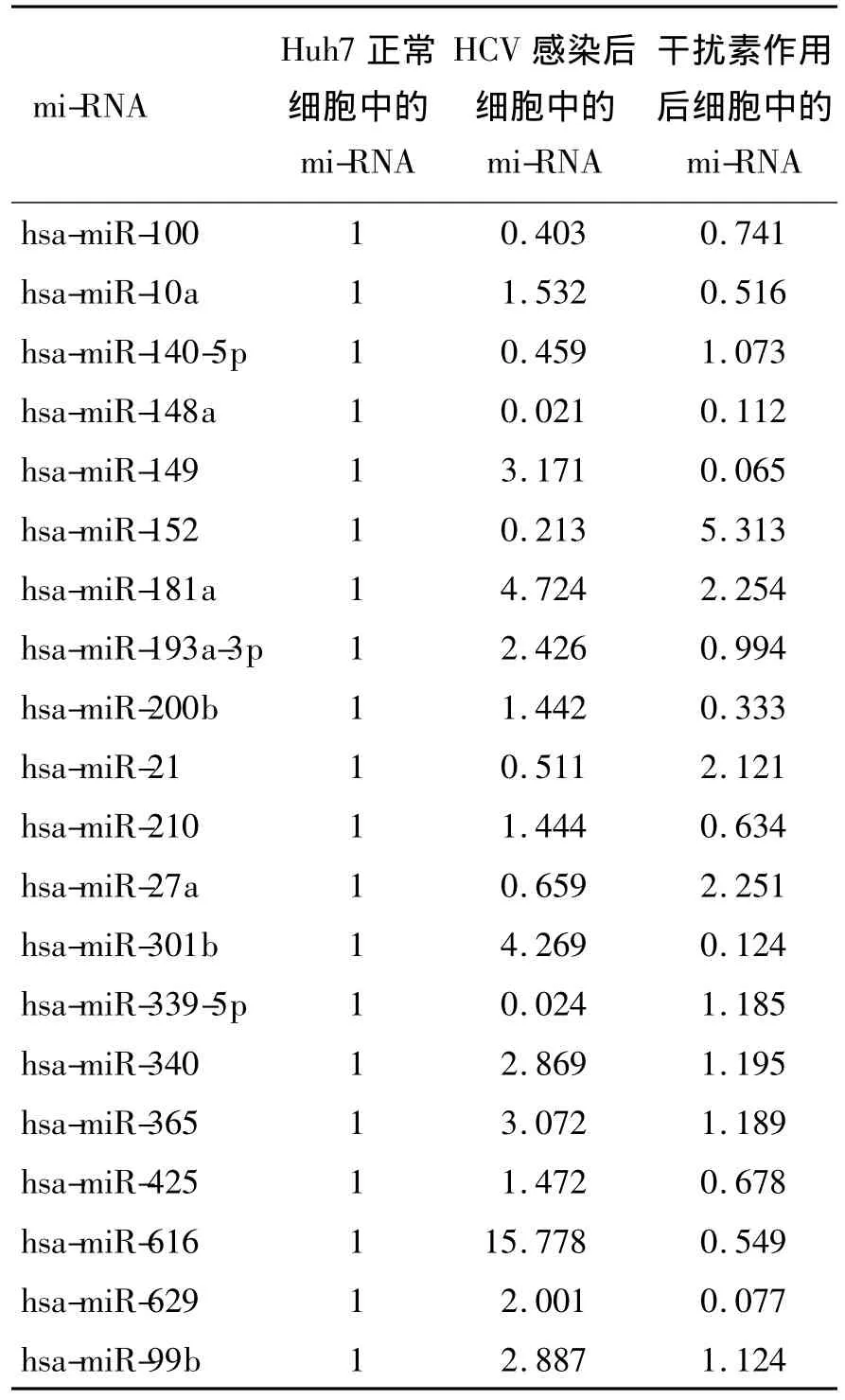
表1 经筛选的microRNA表达谱Table 1 Expression profiling of screened microRNAs
Varnbolt等研究发现,在HCV感染合并肝癌患者中miR-10a均出现异常表达,比正常水平上调2倍[3]。在本实验中,我们也发现,正常Huh7.5.1细胞经HCV感染后,miR-10a表达增加,上调至正常细胞的1.5倍,经干扰素作用后,miR-10a表达下降至正常细胞的一半。miR-10a位于染色体17q21,其直接作用位点是HOXA1。它的异常表达很可能是HCV导致肝癌的因素之一,具体机理目前尚未研究清楚,有待进一步深入研究。
mi-RNA21在细胞中有多个靶基因,在细胞的增殖、分化、凋亡中都起了重要的作用。它其中的一个作用位点在NFIB(nuclear factor I/B)上,NFIB是一个转录抑制因子,mi-RNA21能够抑制它的表达。结果中mi-RNA21的低表达会使NFIB蛋白高表达,可能与HCV病毒侵入导致宿主需要抑制它的转录有关[4-5]。同时在Marquez等的研究中发现,在慢性HCV感染的肝细胞中,SMAD7是TGF-β信号传导通路的抑制信号蛋白,有抑制肝纤维化的作用[6]。mi-RNA21的上调可通过抑制SMAD7来促进肝纤维化,而在我们的结果中,HCV感染后 mi-RNA21是下调的,而干扰素作用后却出现mi-RNA21上调。这一相反的现象值得我们进一步去研究其原因,是否mi-RNA21还针对其它信号通路,而该通路与HCV的感染和清除相关[7]。
mi-RNA149作用于 HIV病毒中的vpr基因,而vpr基因表达的vpr蛋白与反式激活病毒转录、转移病毒整合复合物的细胞核的一系列病毒生存的关键步骤有关。mi-RNA149高表达能抑制vpr蛋白的表达,从而达到抑制病毒复制的目的。在HIV病毒中存在hiv1-mir-H1,能够下调mi-RNA149的表达,从而促进HIV病毒的感染。在HCV中也许没有这种限制基因的存在,因此宿主细胞的mi-RNA149可能出于一种自我保护的机制呈现高表达,以对抗HCV病毒的入侵。干扰素作用后,但mi-RNA149却几乎消失。它与干扰素的作用关系需要进一步去发掘[8]。
mi-RNA152,有报道表明其过度表达会使HLA-G蛋白表达显著降低,HLA—G是非经典性人类白细胞抗原I类基因,主要分布在母体胎儿界面绒毛外细胞滋养层,可抑制NK细胞及T细胞杀伤活性,诱导T细胞凋亡,从而保护胎儿免受母体NK细胞及T细胞杀伤,在母胎免疫应答过程中发挥重要作用[9]。本实验中HCV感染后mi-RNA152呈现低表达,会否引起HLA-G蛋白上调以逃避宿主对感染HCV细胞的免疫杀伤作用。而干扰素作用后,它大幅上升,预示着机体对HCV感染细胞的免疫耐受的打破,从而更有效地杀伤感染细胞和清除HCV。
慢性HCV感染的机制尚不明确,但有间接证据表明,HCV感染会对细胞内线粒体有一定的损伤,并会引起一定程度的氧化应激。这一过程可能会导致细胞内一定程度的缺氧,而缺氧能够触发 mi-RNA210的表达[10-11]。因此,mi-RNA210可能在病毒感染过程中一定程度地缓解其造成的缺氧状况,这或许是机体自我保护的一种措施,但也可能是造成HCV感染慢性化的可能性原因之一。
目前,在病毒的感染、复制和转录及治疗等众多方面,mi-RNA已经受到越来越多的关注,且被认为是细胞内重要的调控因素之一。以上仅仅是我们结合文献对实验结果做出的一些初步分析,表1中其余的 mi-RNA未能找到与HCV及干扰素治疗相关的文献及报道,这些mi-RNA或许与HCV的感染与清除无关,也可能还有新的作用机制等待我们去发掘。因此下一步,我们将进一步结合文献选择其中与HCV可能相关性大的mi-RNA,对其进行人为的调控,观察HCV感染与清除的变化,以期对靶点和机制进行更深入的探究,同时结合临床HCV难治型病例,发现与干扰素治疗无效相关的可能机理,使mi-RNA在HCV治疗领域中发挥更大的作用。
[1]LIU Yan,WANG C M,LI Jin-yang,et al(刘 研,王春梅,李锦洋,等).Up-regulated expression of miS-181a in HepG2.2.15 cells transfected via fulllength hepatitis B virus genome [J].Medical Journal of Chinese People's Liberation Army(解放军医学杂志),2008,33(8):992-994.(in Chinese)
[2]LI Ping.miR-122 regulation in the role of liver disease research[J].Practical Hepatology,2010,13(5):397-399.
[3]FISH J E,SRIVASTAVA D.MicroRNAs:opening a new vein in angiogenesis research [J].Sci Signal,2009,2(52):1-3.
[4]FANG Guo-qiang,WU Bing-li.LI En-min,et al(方国强,吴炳礼,李恩民,等).mir-21 and tumor[J].Carcinogenesis,Teratogenesis & Mutagenesis(癌变.畸变.突变),2010,22(1):65-74.(in Chinese)
[5]GAO W,SHEN H,LIU LX,etal.MiR-21 overexpression in human primary squamous cell lung carcinoma is associated with poor patient prognosis[J].Cancer Res Clin Oncol,2011,137(4):557-566.
[6]ZHANG Y,ZHENG S J,DUAN Z P.microRNA-21's role in the liver[J].World J Gastroentero,2010,18(25):2621-2625.
[7]ZHI F,CHEN X,WANG S N,et al.The use of hsamiR-21,hsa-miR-181b and hsa-miR-106a as prognostic indicators of astrocytoma [J].Eur J Cancer,2010,(46):1640-1649.
[8]HARIHARAN M,SCARIA V,PILLAI B,et al.Targets for human encoded microRNAs in HIV genes[J].Biochem and Bioph Res Co,2005,337(4):1214-1218.
[9]ZHU Xiao-ming,WANG Xiao-hong,JIANG Feng,et al(朱晓明,王晓红,姜 峰,等).miR-152 regulate JEG-3 cells of HLA-G expression [J].Journal of General Medicine(中华全科医学),2011,9(2):171-172.(in Chinese)
[10]HUANG X,LE Q T,GIACCIA A J.MiR-210 micromanager of the hypoxia pathway[J].Trends Mol Med,2010,16(5):230-237.
[11]GARZON R,PICHIORRI F,PALUMBO T,et al.MicroRNA fingerprints during human Megakaryocytopoiesis[J].PNAS,2006,(103):5078-5083.
