兰坪低品位氧化锌矿NH3-(NH4)2SO4体系浸出
2011-08-04凌江华尹周澜胡慧萍李珊珊胡久刚陈启元
凌江华,尹周澜,胡慧萍,李珊珊,胡久刚,陈启元
(中南大学 化学化工学院,湖南 长沙,410083)
云南兰坪低品位氧化锌矿资源丰富,达700多万t。但该矿石氧化程度深,矿物组成复杂,多金属共生,钙镁含量高,褐铁矿化严重[1-2]。用传统酸法炼锌工艺难以经济利用矿石中的有价金属,而且除铁、除硅过程复杂[3-4],因此,开发新的工艺来处理这些难选低品位氧化锌矿势在必行。“氨浸—萃取—电积”工艺具有能耗低、除杂简单、污染少、适应性强等优点,在处理复杂低品位矿石时具有显著的技术优势和经济效益,已在铜、钴、镍等冶炼工业得到了广泛应用[5-7]。“氨浸—萃取—电积”工艺同样也适用于处理氧化锌矿,且活性基团为β-二酮的萃取剂适合于从氨溶液中萃取锌,国内外一些研究者采用β-二酮作为该工艺的萃取剂取得了较好的实验结果[8-12]。氨浸作为该工艺首道工序,其优劣直接决定了锌回收率、除杂过程难易程度以及萃取工序的顺利运行。目前国内外采用氨法浸出低品位氧化锌的报道相对较少,其浸出条件也比较苛刻。Moghaddam等[13]采用(NH4)2CO3浓度为2 mol/L,pH=11的NH3-(NH4)2CO3体系,考察了高硅氧化锌矿的浸出行为,锌的浸出率为 88.2%;王瑞祥等[14]采用总NH3浓度为7.5 mol/L,NH4+与NH3物质的量之比n(NH4+)/n(NH3)=2 (pH=9.3)的NH3-NH4Cl体系直接浸出低品位氧化锌矿,锌的浸出率为 88.9%;刘亚川等[15]研究了难选低品位氧化锌矿的NH3-NH4Cl体系浸出,在总氨浓度为9 mol/L,n(NH4+)/n(NH3)=1(pH=9.6)的条件下,锌的浸出率为87.51%。虽然他们获得了较高的锌浸出率,但浸出剂的总氨浓度(>3 mol/L)或 pH(>9.0)过高,锌主要以[Zn(NH3)4]2+配合离子的形式存在,而自由Zn2+的浓度很低,导致β-二酮萃取剂对锌的萃取率很低[10-12]。此外,当总氨浓度或pH过高时,氨挥发的损失量也大大增加,不利于工业应用。为此,本文作者采用NH3-(NH4)2SO4浸出体系,在较低pH和总氨浓度条件下浸出兰坪低品位氧化锌。通过考察pH、总氨浓度、温度、液固比等因素对兰坪低品位氧化锌矿浸出行为的影响,得出兰坪低品位氧化锌矿氨浸的一般规律,并以此为理论指导,在较低的 pH和总氨浓度条件下,采用二段逆流浸出工艺得到适合β-二酮萃取剂处理的料液。
1 实验
1.1 实验原料
实验所用原料为云南兰坪低品位氧化锌,矿样经过破碎、球磨得到不同粒径的矿样备用。矿样的主要化学组分及物相分析如表1和表2所示,XRD分析见图1。

表1 低品位氧化锌矿的化学成分(质量分数)Table 1 Chemical composition of low-grade zinc oxide ore%

表2 低品位氧化锌矿中锌的物相分析(质量分数)Table 2 Mineralogical composition of low-grade zinc oxide ore %

图1 低品位氧化锌矿的XRD图Fig.1 XRD pattern of low-grade zinc oxide ore
由表1可知:此矿样锌的品位很低且成分极为复杂,主要杂质有Fe,Pb,Si,Ca等。物相分析和XRD的结果表明原料所含锌矿物主要为氧化锌(包括碳酸锌,亚硫酸锌等)和硫化锌。
1.2 实验方法
按不同的pH和总氨浓度要求,用(NH4)2SO4(AR)和NH3(AR)配制浸出剂,恒温备用。每次实验时按照一定的液固比在250 mL三口瓶中加入250 mL浸出剂和相应质量的矿样,采用JJ-1精密增力搅拌器进行密闭搅拌浸出,由 DF-101S集热式恒温水浴槽控温。在规定的时间间隔内取样2 mL分析锌的含量。反应完成后,将浆料抽滤,滤液进行 pH测定及杂质离子含量的分析,滤渣烘干称质量。
1.3 分析方法
浸出剂中游离氨浓度采用酸碱滴定分析;浸出液中锌的浓度采用EDTA滴定法测定[16];铁和二氧化硅分别采用磺基水杨酸分光光度法[17]和硅钼蓝分光光度法[18]测定,其他含量较低的杂质元素如镉、铜、铅等采用原子吸收进行检测。
2 实验结果与讨论
2.1 浸出条件实验
实验研究了NH3-(NH4)2SO4氨性缓冲体系pH、温度、液固比、反应时间、矿物粒径等因素对兰坪低品位氧化锌矿中锌浸出率及铁、铅、铜、镉等杂质元素溶出行为的影响。
2.1.1 浸出时间对氧化锌矿浸出过程的影响
在温度 35 ℃,液固比 4,90%矿物粒径<0.075 mm,浸出剂总氨浓度3 mol/L,pH 9.60,搅拌速度300 r/min的条件下,考察浸出时间对锌浸出率的影响,实验结果如图2所示。从图2可以看出:低品位氧化锌矿中锌的浸出率随浸出时间的延长而不断增大,开始时增大的速率较快,5 min时浸出率达到了42.4%,超过60 min时锌的浸出率变化甚微,经过4 h反应锌的浸出率为 83.1%。由于适当的延长反应时间,有利于矿物中有价金属的回收,故以下浸出实验均选择浸出时间为4 h。

图2 不同浸出时间下低品位氧化锌矿的浸出率Fig.2 Zinc extraction of low-grade zinc oxide ore for different leaching time
2.1.2 浸出剂pH对氧化锌矿浸出过程的影响
在温度为 35 ℃,液固比为 4,90%矿物粒径<0.075 mm,浸出剂总氨浓度为3 mol/L,搅拌速度为300 r/min,浸出时间为4 h的反应条件下,考察浸出剂 pH对低品位氧化锌矿中锌的浸出率及主要杂质离子溶出行为的影响,结果分别见图3和表3。从浸出率-pH曲线可以看出:锌的浸出率随着pH的增大先升高,后略有降低,当n(NH3)/n(NH4+)=2(pH=10.03)时达到最大值。同时,浸出液 pH也随着不断升高。由于β-二酮萃取剂在被萃取水相pH>9.0时,对锌的萃取率很低[10-11],因此,综合考虑萃取工序处理料液pH要求和低品位氧化锌中锌回收率两大因素,以下实验选择浸出剂的pH=9.60(浸出液pH=9.13)。
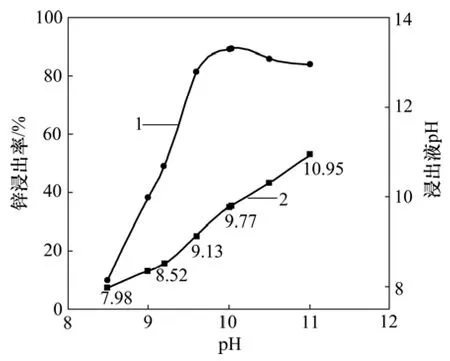
图3 不同浸出剂pH下低品位氧化锌矿的浸出率及浸出液pHFig.3 Zinc extraction of low-grade zinc oxide ore and pH of lixivium at different pH

表3 不同pH下浸出液中主要杂质离子的质量浓度Table 3 Mass concentration of main impurity ions at different pH mg/L
从表3可以看出:在NH3-(NH4)2SO4浸出溶液中,各种杂质离子的含量都很低,且随浸出剂pH的变化趋势基本一致。随着 pH的增大,浸出液中 Cd,Pb和Cu的含量都逐渐增大,这是由于它们都能与NH3反应形成稳定的配合离子;Si的含量先增大后减少,这可能与浸出过程中硅酸根离子发生团聚重新进入弃渣有关。
2.1.3 总氨浓度对氧化锌矿浸出过程的影响
在温度为35 ℃,浸出剂pH为9.60,液固比为4,90%矿物粒径<0.075 mm,搅拌速度300 r/min,反应时间为4 h的条件下,考察浸出剂总氨浓度对低品位氧化锌矿浸出过程的影响。实验结果如图4和表4所示。从图4可以看出:随着总氨浓度的升高,锌的浸出率显著提高,同时浸出液的 pH也不断增大。但当总氨浓度从3 mol/L增大到4 mol/L时,pH有一个显著升高的过程。当浸出剂总氨浓度为5 mol/L时,锌的浸出率达到91.04%,浸出液pH为9.35。表4表明:浸出液中Si,Cd,Pb和Cu等杂质的含量都随着总氨浓度的升高而增大。虽然提高浸出剂的总氨浓度有利于低品位氧化锌中锌的回收,但当浸出液的总氨浓度>3.0 mol/L时,β-二酮对锌的萃取率显著降低[12],因此,在实验中选择浸出剂的总氨浓度为3.0 mol/L。
2.1.4 液固比对氧化锌矿浸出过程的影响
在温度为35 ℃,浸出剂总氨浓度为3 mol/L,pH为9.60,90%矿物粒径<0.075 mm,搅拌速度为300 r/min,反应时间为4 h的浸出条件下,考察液固比对低品位氧化锌矿浸出过程的影响,实验结果见图5和表5。由图5可见:液固比对锌浸出率的影响十分显著,当液固比小于4时,随着液固比增大,锌的浸出率急剧升高;但当液固比超过4时,锌的浸出率变化速率迅速降低;当液固比从5增加到6时,锌的浸出率仅增大了1.8%。浸出液的pH随液固比的变化趋势与锌的浸出率变化趋势相似。这是由于当矿样中锌的总量相同时,液固比越大,反应过程中体相NH3的浓度降低越少,同时,体相锌氨配合离子的浓度也越低,这样更有利于未反应的氨和反应生成的锌氨配合离子通过扩散层,提高反应速率。同时,总氨量较大时,可提供更多与Zn2+配位的NH3,锌的浸出率也就越高,浸出液的pH降低也越少。分析表5中主要杂质离子的浓度随液固比的变化可知:Cd和Cu等离子的浓度有所降低,但其总量不断升高,这表明增大液固比同样有利于杂质离子的浸出。综合考虑液固比对锌的浸出率和浸出液pH的影响,选择液固比为4。

图5 不同液固比下低品位氧化锌矿的浸出率及浸出液pHFig.5 Zinc extraction of low-grade zinc oxide ore and pH of lixivium at different ratios of liquor to solid

表5 不同液固比下浸出液中主要杂质离子的质量浓度Table 5 Mass concentration of main impurity ions at different ratios of liquor to solid mg/L
2.1.5 矿物粒径对氧化锌矿浸出过程的影响
在温度为35 ℃,液固比为4,浸出剂总氨浓度为3 mol/L,pH为9.60,搅拌速度为300 r/min,反应时间为4 h的条件下,考察矿物粒度对氧化锌浸出过程的影响,实验结果如图6和表6所示。由图6可知:锌的浸出率和浸出速率随氧化锌矿粒度的减少而增大。这是由于当矿样的质量一定时,粒度越少,反应总表面积就越大,同时,矿石中暴露出的氧化锌等可浸出的成分也越多,因此,浸出率也就越高。另外,低品位氧化锌氨浸过程属于内扩散控制反应[19],矿物的粒径越小,越有利于氨及锌氨配离子在矿粒中扩散,其反应速率也就越快。虽然增大比表面积能够增大浸出率,但由于矿物粒径分布对锌的浸出率不是关键因素,而且矿物粒度较大时更有利于固液分离过程的进行,因此,在实验中选择90%矿物粒径<0.075 mm的氧化矿进行浸出。

图6 不同矿物粒径下低品位氧化锌矿的浸出率Fig.6 Zinc extraction of low-grade zinc oxide ore with different particle sizes
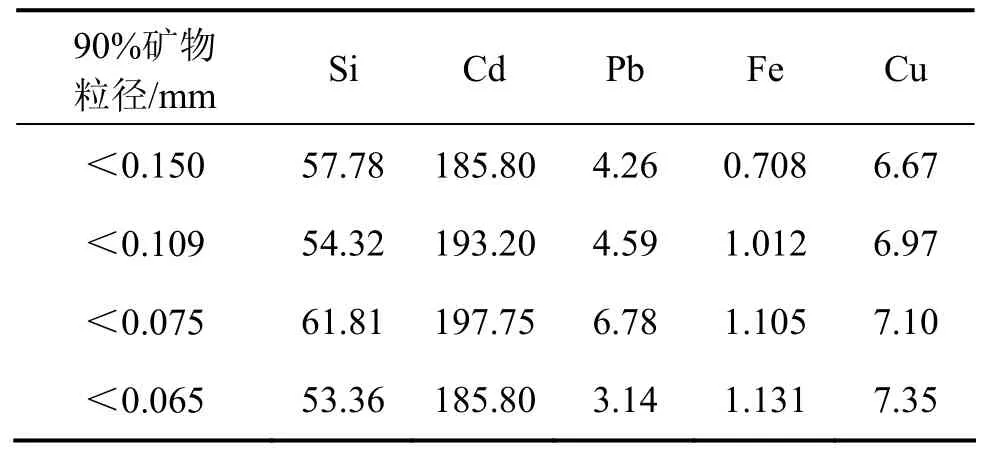
表6 不同矿物粒径下浸出液中主要杂质离子的质量浓度Table 6 Mass concentration of main impurity ions in lixivium of ore with different particle sizes mg/L
2.1.6 温度对氧化锌矿浸出过程的影响
在浸出剂总氨浓度为3 mol/L,pH为9.60,液固比为 4,90%矿物粒径<0.075 mm,搅拌速度为 300 r/min,反应时间为4 h的条件下,考察温度对锌矿浸出过程的影响。实验结果如图7和表7所示。由图7可见:虽然随着温度的升高,活化分子增多,分子扩散速度加快,更有利于锌的浸出,但随着时间的延长,浸出过程趋于平衡,温度对低品位氧化锌中锌和其他杂质元素浸出的影响逐渐变小;另外,当温度过高时,不仅需要消耗大量的能量,而且会加剧氨的挥发,不利于锌的浸出;同时,从总流程的角度来考虑,35~40 ℃的温度范围更有利于锌的电积[20]。因此,在实验中选择浸出温度为35 ℃。

图7 不同温度下低品位氧化锌矿的浸出率Fig.7 Zinc extraction of low-grade zinc oxide ore at different leaching temperatures

表7 不同温度下浸出液中主要杂质离子的质量浓度Table 7 Mass concentration of main impurity ions in lixivium of ore with different leaching temperatures mg/L
2.1.7 搅拌速度对氧化锌矿浸出过程的影响
在温度为35 ℃,浸出剂总氨浓度为3 mol/L,pH为9.60,90%矿物粒径<0.075 mm,液固比为4,反应时间为4 h的条件下,考察搅拌速度对锌浸出率和杂质元素溶出行为的影响,结果分别见图8和表8所示。由图8可见:随着搅拌速率的提高,锌的浸出率不断提高,但是,当搅拌速率超过300 r/min时,锌的浸出率变化不明显,主要杂质离子的溶出与锌的浸出规律相似。这是因为当搅拌速度较低时,外扩散对氧化锌矿的浸出速率影响较大,增大搅拌速度,可促进矿粒和溶液的充分接触,降低固体表面的扩散层厚度,从而提高反应速率。然而,当搅拌速度增大到一定程度后,外扩散对浸出速率的影响可忽略不计,继续加强搅拌对锌的浸出率影响不大。本实验确定最佳搅拌速度为300 r/min。

图8 不同搅拌速度下低品位氧化锌矿的浸出率Fig.8 Zinc extraction of low-grade zinc oxide ore at different stirring speeds

表8 不同搅拌速度下浸出液中主要杂质离子的质量浓度Table 8 Mass concentration of main impurity ions at different stirring speeds mg/L
2.2 二段逆流浸出
通过考察pH、总氨浓度、温度、液固比、时间等因素对兰坪低品位氧化锌矿浸出行为影响的单因素实验可以看出:对该矿进行一次氨性浸出难以达到90%以上的浸出率,而且当浸出剂pH或总氨浓度较高时,虽然浸出率有所上升,但浸出液的pH也会超过9.00,不利于萃取过程的进行;另外pH和总氨浓度过高时,氨的损失量也相对较大,不利于工业应用。为了达到提高氧化锌矿的浸出率和降低浸出液的 pH的目的,根据以上单因素实验结果,确定最佳的浸出条件:反应温度为35 ℃,浸出剂总氨浓度为3 mol/L,pH=9.60,90%矿物粒径<0.075 mm,液固比为 4,反应时间为4 h,搅拌速度为300 r/min,并在此条件下进行二段逆流浸出(其流程如图9所示),结果见表9。

图9 NH3-(NH4)2SO4体系(pH=9.60)二段逆流浸出流程图Fig.9 Flowchart of two-stage counter-current leaching in NH3-(NH4)2SO4 system (pH=9.60)

表9 NH3-(NH4)2SO4体系(pH=9.60)二段逆流浸出实验结果Table 9 Experimental results of two-stage counter-current leaching in NH3-(NH4)2SO4 system (pH=9.60)
从表9可以看出:在最佳浸出条件下,对兰坪低品位氧化锌矿进行二段逆流浸出,锌的浸出率>90%,浸出液的 pH<9.0。可见:采用二段逆流浸出可以很好地满足以β-二酮为萃取剂的“氨浸—萃取—电积”工艺的要求。
3 结论
(1) NH3-(NH4)2SO4浸出体系pH、总氨浓度、温度、液固比、反应时间、矿物粒径等因素对锌矿的浸出率有明显影响。其中pH、总氨浓度、液固比的影响相对较大,增大 pH、总氨浓度和液固比,均有利于锌的浸出。
(2) NH3-(NH4)2SO4浸出体系的pH、总氨浓度、温度、液固比等因素都会影响硅、铁、镉、铅、铜等杂质元素的溶出行为。但总的来说,NH3-(NH4)2SO4浸出液中杂质含量不高,大大减轻了除杂工序的负担。
(3) 兰坪低品位氧化锌矿进行一次氨性浸出难以达到90%以上的浸出率,而且当浸出剂pH或总氨浓度过高时,浸出液的pH会超过9.0,不利于后续步骤即萃取工序的进行。
(4) 在 NH3-(NH4)2SO4体系最佳浸出条件下对兰坪低品位氧化锌矿进行二段逆流浸出,锌的浸出率>90%,且浸出液的 pH<9.0,能很好地满足“氨浸—萃取—电积”工艺的要求。
[1] 陈世明, 瞿开流. 兰坪氧化锌矿石处理方法探讨[J]. 云南冶金, 1998, 27(5): 31-32.CHEN Shi-ming, QU Kai-liu. On the treatment of oxidized zinc ore in Lanping[J]. Yunnan Metallurgy, 1998, 27(5): 31-32.
[2] 朱云, 胡汉, 苏云生, 等. 难选氧化锌矿氨浸动力学[J]. 过程工程学报, 2002, 2(1): 81-85.ZHU Yun, HU Han, SU Yun-sheng, et al. Kinetics of leaching poorly-floated zinc-oxide-ore with ammonia[J]. The Chinese Journal of Process Engineering, 2002, 2(1): 81-85.
[3] 林祚彦, 华一新. 高硅氧化锌矿硫酸浸出的工艺及机理研究[J]. 有色金属: 冶炼部分, 2003(5): 9-12.LING Zuo-yan, HUA Yi-xin. Technology and mechanism study on leaching high silicon zinc oxide ore with sulfuric acid[J].Nonferrous Metals: Smelting, 2003(5): 9-12.
[4] 蓝卓越, 胡岳华, 黎维中. 低品位氧化锌矿硫酸浸出工艺研究[J]. 矿冶工程, 2002, 22(3): 63-65.LAN Zhuo-yue, HU Yue-hua, LI Wei-zhong. Sulfuric acid leaching of low-grade zinc oxide ore: A study[J]. Mining and Metallurgical Engineering, 2002, 22(3): 63-65.
[5] Parija C, Bhaskara Sarma P V R. Separation of nickel and copper from ammoniacal solutions through co-extraction and selective stripping using LIX84 as the extractant[J]. Hydrometallurgy,2000, 54(2/3): 195-204.
[6] Pandey B D, Kumar V. Extraction of copper and nickel from ammoniacal leach liquor of Indian ocean sea nodules[J].Hydrometallurgy, 1991, 26(1): 35-45.
[7] 刘大星, 赵炳智, 蒋开喜, 等. 汤丹高碱性脉石难选氧化铜矿的试验研究和工业实践[J]. 矿冶, 2003, 12(2): 49-62.LIU Da-xing, ZHAO Bing-zhi, JIANG Kai-xi, et al. Study on treatment of Tangdan refractory copper oxide ore with high content of alkali gangues[J]. Mining & Metallurgy, 2003, 12(2):49-62.
[8] Alguacil F J, Alonso M. The effect of ammonium sulphate and ammonia on the liquid-liquid extraction of zinc using LIX54[J].Hydrometallurgy, 1999, 53(2): 203-209.
[9] FU Weng, CHEN Qi-yuan, WU Qian, et al. Solvent extraction of zinc from ammoniacal/ammonium chloride solutions by a sterically hinderedβ-diketone and its mixture with tri-n-octylphosphine oxide[J]. Hydrometallurgy, 2010, 100(3/4):116-121.
[10] 王延忠, 朱云, 胡汉. 从氨浸出液中萃取锌的实验研究[J]. 有色金属, 2004, 56(1): 37-39.WAGN Yan-zhong, ZHU Yun, HU Han. Zinc extraction from ammonia leaching solutions with LIX54[J]. Nonferrous Metals,2004, 56(1): 37-39.
[11] 陈浩, 朱云, 胡汉. Zn-NH3-H2O体系中LIX54萃取锌[J]. 有色金属, 2003, 55(3): 50-51.CHEN Hao, ZHU Yun, HU Han. Zinc extraction with LIX54 in Zn-NH3-H2O system[J]. Nonferrous Metals, 2003, 55(3): 50-51.
[12] 陈启元, 胡慧萍, 付翁. 一种有效提高氨性溶液中锌萃取效果的方法: CN, 101560600A[P]. 2009-10-21.CHEN Qi-yuan, HU Hui-ping, FU Weng. Method for increasing extraction rate of zinc from ammoniacal solutions: CN,101560600A[P]. 2009-10-21.
[13] Moghaddam J, Sarraf-Mamoory R, Yamini Y, et al.Determination of the optimum conditions for the leaching of nonsulfide zinc ores (high-SiO2) in ammonium carbonate media[J].Ind Eng Chem Res, 2005, 44(24): 8952-8958.
[14] 王瑞祥, 唐漠堂, 刘维, 等. NH3-NH4Cl-H2O体系浸出低品位氧化锌矿制取电锌[J]. 过程工程学报, 2008, 8(1): 219-222.WANG Rui-xiang, TANG Mo-tang, LIU Wei, et al. Leaching of low grade zinc oxide ore in NH3-NH4Cl-H2O system for production of electrolytic zinc[J]. The Chinese Journal of Process Engineering, 2008, 8(1): 219-222.
[15] 刘亚川, 刘述平, 李博, 等. 低品位氧化锌矿的氨—铵盐浸出研究[J]. 矿产综合利用, 2008(2): 3-5.LIU Ya-chuan, LIU Shu-ping, LI Bo, et al. Research on ammonia-ammonium chloride leaching of a low-grade zinc oxide ore[J]. Multipurpose Utilization of Mineral Resource,2008(2): 3-5.
[16] GB/T 8151.1—2000, 锌精矿化学分析方法: 锌的测定[S].GB/T 8151.1—2000, Methods for chemical analysis of zinc concentrates: Determination of zinc content[S].
[17] SL 91.2—1994, 二氧化硅(可溶性)的测定(硅钼蓝分光光度法)[S].SL 91.2—1994, Determination of silica (dissolved) (Hetropoly blue method)[S].
[18] GB/T 12689.3—90, 锌及锌合金化学分析方法: 磺基水杨酸分光光度法测定铁量[S].GB/T 12689.3—90, Zinc and zinc alloys—Determination of ion content: Sultosalicylic acid spectorphotometric method[S].
[19] WANG Rui-xiang, TANG Mo-tang, YANG Sheng-hai, et al.Leaching kinetics of low grade zinc oxide ore in NH3-NH4Cl-H2O system[J]. Cent South Univ Technol, 2008,15(5): 679-683.
[20] 铅锌冶金学编委会. 铅锌冶金学[M]. 北京: 科学出版社,2003: 426.Editorial Staff of Metallurgy of Lead and Zinc. Metallurgy of lead and zinc[M]. Beijing: Science Press, 2003: 426.
