氯气氧化分解草酸钴沉淀母液中的草酸
2011-08-04田庆华易宇郭学益
田庆华 ,易宇,郭学益
(1. 中南大学 冶金科学与工程学院,湖南 长沙,410083;2. 中南大学 冶金工程博士后流动站,湖南 长沙,410083)
目前,国内外草酸钴的生产主要采用草酸铵沉钴法,即在氯化钴溶液体系中,加入沉淀剂草酸铵,生成草酸钴沉淀,经过滤干燥得到产品[1]。据统计,每生产1 t金属钴量的草酸钴约需3.5 t氨水,排出的母液中含有20~30 g/L的NH4+。母液中的氨氮质量浓度远远超出了国家污水综合排放标准(GB 8978—1996)中所规定的二级标准(氨氮排放质量浓度小于 25 mg/L)。目前,对母液的处理主要采取稀释排放方式,这样处理虽然可以使排放母液中氨氮浓度达到国家排放标准,但是氨氮的总量并没有减少,其危害并没有得到彻底根治。因此,为了避免加入氨水,田庆华[2]开发了一种新型的草酸钴制备方法——无氨草酸沉淀法,采用此法不仅可以制备得到物理性能良好的草酸钴,而且反应生成的大量盐酸可以返回浸出工序加以回收利用,同时还避免了向环境排放含氨氮的废水,大大降低了对环境的影响。但是为了促进钴的沉淀而在反应中加入了过量的草酸,导致母液中含有一定量的残留草酸。如果母液直接返回用于溶料,容易形成草酸盐沉淀,降低有价金属的浸出率。因此,在母液返回溶料前必须将其中残留的草酸去除。目前,处理含草酸溶液的方法包括臭氧氧化法[3-6]、草酸钙沉淀法[7]、铅盐置换法[8-9]、溶剂萃取法[10-13]等。如果采用钙盐或铅盐沉淀置换处理无氨草酸诱导沉钴母液中的草酸,必须在母液中加入过量的钙盐或者铅盐才能获得较为理想的处理效果,这将引入新的杂质离子。络合萃取法虽然可以将体系中的草酸、盐酸相互分离予以分别回收,但存在工艺复杂、流程长等不足。氧化法技术成熟,流程短,操作简单,存在的问题主要是由于氧化剂的选用可能带入新的杂质。考虑到本研究体系是氯化物体系,采用氯气作为氧化剂,不仅可以有效地氧化草酸,且整个过程不会带入新的杂质离子。
1 实验
1.1 实验装置及试剂
本实验用到的实验试剂主要包括草酸、次氯酸钙、盐酸、氯化钴、去离子水等。其中草酸、盐酸和氯化钴为分析纯,次氯酸钙为化学纯。实验装置如图1所示,左边是由分液漏斗、锥形瓶和调温电炉组成的氯气发生部分,右边是由电热恒温水浴锅、数显恒速搅拌机、温度计和三颈瓶组成的氧化部分,实验装置置于通风橱中。
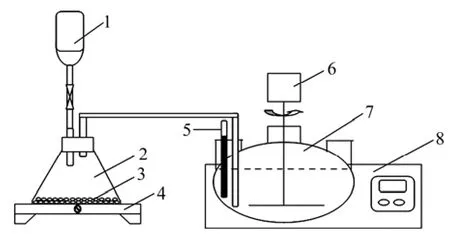
图1 实验装置图Fig.1 Experimental apparatus
1.2 氯气的制备
本实验采用次氯酸钙与盐酸反应制备氯气,并通过加热使反应进行得更彻底、更稳定。反应方程式如下:
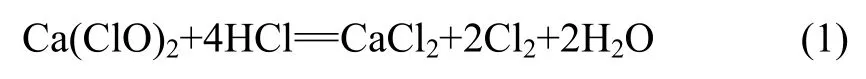
将一定量的次氯酸钙固体粉末放入图1所示锥形瓶中,再将一定量的6 mol/L盐酸(盐酸相对次氯酸钙过量)加入分液漏斗中。检查锥形瓶的气密性,旋开分液漏斗的旋塞,让分液漏斗中的盐酸匀速流入锥形瓶中。盐酸与次氯酸钙固体粉末接触反应后,即产生黄绿色的氯气,氯气气泡较为稳定、持续地从固体表面产生。当盐酸全部流入锥形瓶后,旋紧分液漏斗的旋塞。开启调温电炉,旋动功率调节旋钮至设定的功率加热,当锥形瓶上部由黄绿色变为白色即可认为反应终止。
1.3 实验方法
草酸具有很强的还原性,易被氧化剂氧化。草酸与氯气的反应方程式如下:
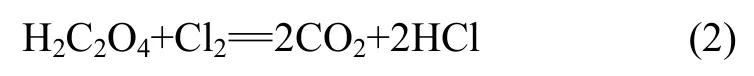
每次实验时取500 mL已知浓度草酸溶液,倒入三口烧瓶中,将三口烧瓶置于恒温水浴锅内,按照图1将各个仪器连接好。开启数显恒速搅拌器,旋转调速旋钮至实验设定的转速;按下恒温水浴锅的电源开关,将温度调至实验设定的温度;观察温度计,当三口烧瓶中溶液的温度达到设定温度后,启动氯气发生器。将制备的氯气通过导管通入溶液中进行反应。实验使用的草酸溶液的成分为:草酸 20 g/L,盐酸 1.0 mol/L,钴离子 1.0 g/L。草酸的浓度用硝酸铈铵滴定法测定。
2 结果及讨论
2.1 反应温度的影响
从理论上讲,反应温度直接影响反应的反应速度。一般来说,在低温时反应速度较慢,当温度升高时,分子的热运动速度加快,分子的碰撞概率增加,有利于反应过程的进行。实验探讨了在次氯酸钙150 g,6 mol/L盐酸550 mL以及搅拌速度为400 r/min和反应时间为2 h的条件下,反应温度分别为40,50,60,70和80 ℃时对草酸氧化率的影响,以确定合适的反应温度。实验结果如图2所示。
从图2可以看出:草酸的氧化率随着反应温度的升高而增大。草酸的氧化反应是吸热反应,因而随着反应温度的升高,反应平衡向正方向移动,草酸的氧化率增加。只是在反应温度超过50 ℃以后,草酸的氧化率随反应温度升高而增大的幅度有所降低。综合考虑以上因素,反应温度选择50 ℃比较合适。
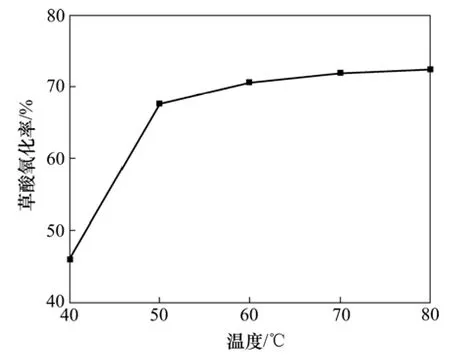
图2 反应温度对草酸氧化率的影响Fig.2 Effect of temperature on oxidation rate
2.2 反应时间的影响
实验探讨了在次氯酸钙150 g,6 mol/L盐酸550 mL以及搅拌速度为400 r/min和反应温度为50 ℃不变的条件下,反应时间分别为0.5,1.0,2.0,3.0,5.0和8.0 h时对草酸氧化率的影响,以确定合适的反应时间,实验结果如图3所示。
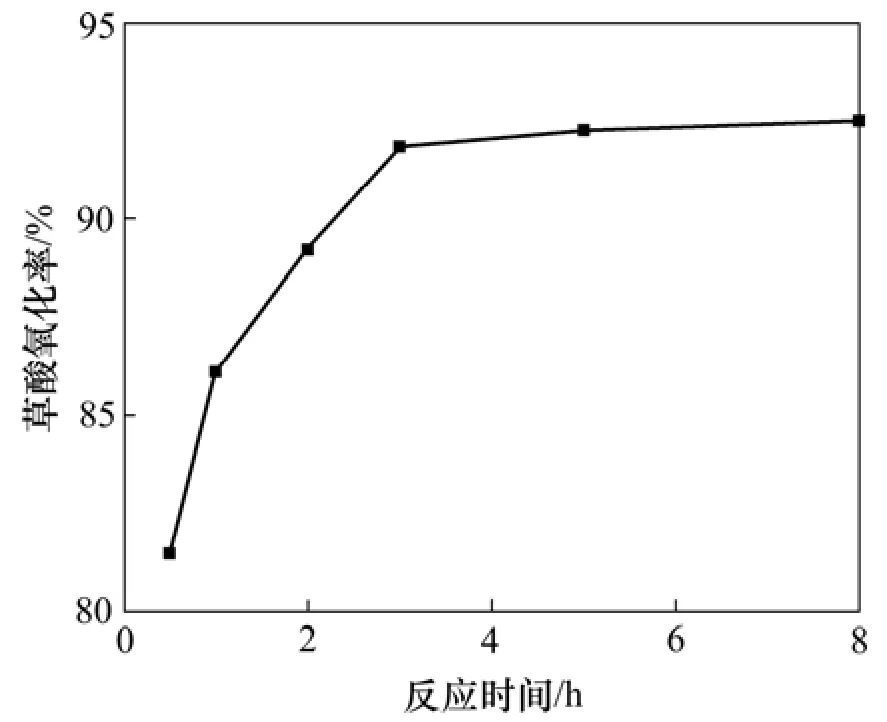
图3 反应时间对草酸氧化率的影响Fig.3 Effect of reaction time on oxidation rate
从图3可以看出:草酸的氧化率随着反应时间的增加而增大,当反应时间超过3 h以后,草酸氧化率增加的幅度越来越小。当氧化剂氯气的量一定时,反应时间越短,单位时间内通入溶液中的氯气量越多;反应时间越长,单位时间内通入溶液中的氯气量越少。氯气氧化草酸的反应为气液反应过程,若反应时间过短,则通入溶液中的氯气还未充分与草酸发生反应就逸出到体系外的空气中,氯气的实际利用率很低;随着反应时间延长,通入溶液中的氯气的实际利用率增加,使得草酸的氧化率增大。综合考虑以上因素,反应时间选择3 h比较合适。
2.3 氯气用量的影响
氧化剂氯气的用量对草酸氧化效果的影响较大。氯气的用量用制备氯气消耗的次氯酸钙固体粉末的质量来表征。实验探讨了在搅拌速度为400 r/min、反应温度为50 ℃和反应时间为3 h的条件下,制备氯气用次氯酸钙的量(6 mol/L盐酸的用量为次氯酸钙用量的5倍)分别为100,125,150,175和200 g时对溶液中的草酸的氧化率的影响,以确定合适的制备氯气的次氯酸钙的用量,实验结果如图4所示。
从图4可以看出:氯气的用量越大,草酸的氧化率越高;在次氯酸钙的量超过150 g之后,虽然草酸氧化率变化的总趋势是增加的,但是,其增加的递增幅度逐步减低;随着氯气用量的增加,单位时间溶液中溶解的氯气量也相应增加,从而增加了溶液中氯气的浓度,反应平衡向正方向移动,因此,草酸的氧化率增加。随着草酸氧化反应的进行,溶液中生成物(Cl-)浓度增加,阻碍了反应向右进行,在宏观的体现就是随着氯气量的增加,草酸的氧化率增加幅度降低。经综合考虑,制备氯气的次氯酸钙选择150 g比较合适,按理论反应折算成产生氯气量为149 g。
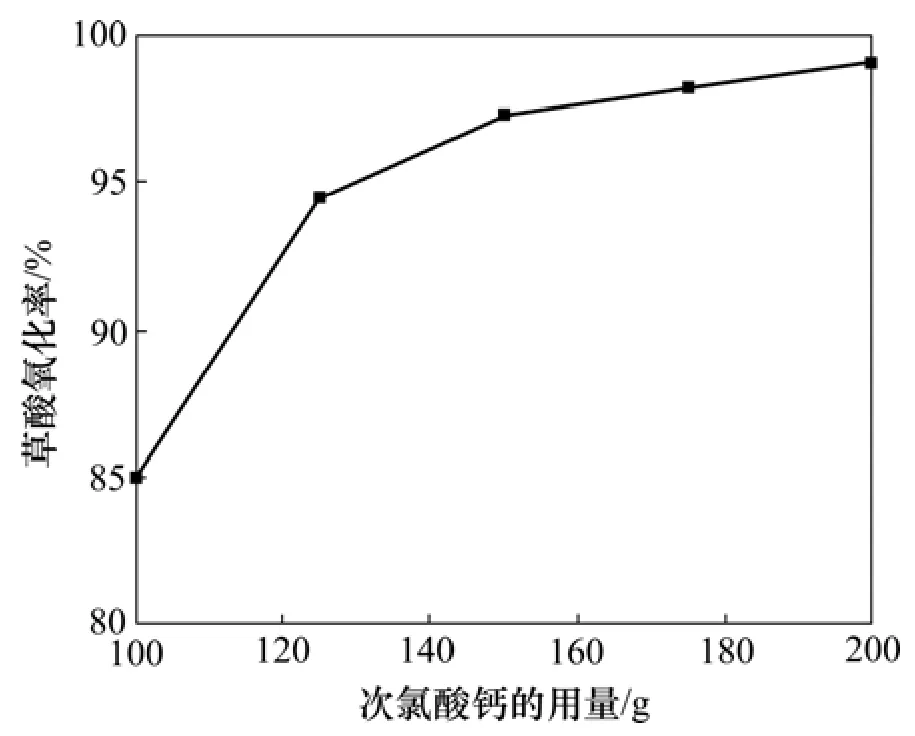
图4 次氯酸钙用量对草酸氧化率的影响Fig.4 Effect of Ca(ClO)2 mass on oxidation rate
2.4 搅拌速度的影响
搅拌可以为体系提供能量,强化传质,使反应物料充分混合,避免浓度梯度和温度梯度的产生,保证体系与环境的高度一致,有利于气体均匀分布于溶液中,提高气体通过气液膜扩散到溶液中的速度。实验探讨了在次氯酸钙150 g,6 mol/L盐酸550 mL以及反应时间为3 h和反应温度为50 ℃的条件下,搅拌速度分别为400,600,700,750和800 r/min时溶液中草酸的氧化率的影响,以确定合适的搅拌速度,实验结果如图5所示。
从图5可以看出:搅拌速度对草酸的氧化率影响比较大。当搅拌速度低于700 r/min时,草酸氧化率随着搅拌速度的增大而提高;而当搅拌速度大于 700 r/min时,草酸氧化率则随着搅拌速度的增大而降低。在气液反应体系中,反应过程一般包括以下步骤:气相中的溶质向气-液界面上扩散,它们在界面上的溶解,与液相中某组分发生反应等。氯气通入溶液后形成大量的气泡,通过搅拌的作用分散到整个溶液体系中,搅拌速度越大,搅拌的强度越大,气泡在溶液中的均分散效果越好,气泡与溶液的混合效果越理想。气泡穿过液体的运动速度主要取决于推动气泡上升的浮力与阻碍这种运动的黏滞力和形状阻力。当搅拌速度大于700 r/min后,这些力的作用就以浮力为主,导致气泡迅速穿过溶液逸出到体系外的趋势就越大,这样就导致了草酸的氧化率随着搅拌速度的增大先提高而后降低的现象。综合考虑以上因素,搅拌速度选择700 r/min比较合适。
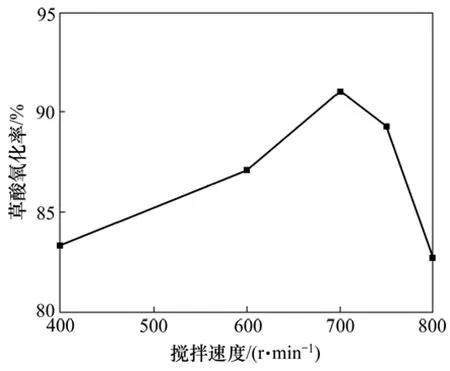
图5 搅拌速度对草酸氧化率的影响Fig.5 Effect of stirring speed on oxidation rate
2.5 钴离子质量浓度的影响
实验探讨了在溶液中草酸 20 g/L、盐酸 1.0 mol/L、次氯酸钙150 g、6 mol/L盐酸550 mL以及反应时间为 3 h、反应温度为 50 ℃和搅拌速度为 700 r/min的条件下,溶液中钴离子质量浓度分别为0,0.5,1.0,1.5和2.0 g/L时对母液中的草酸的氧化率的影响,实验结果如图6所示。
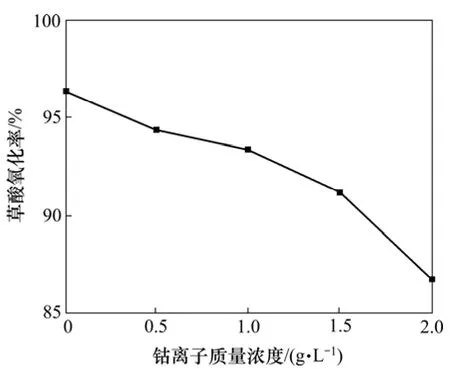
图6 钴离子质量浓度对草酸氧化率的影响Fig.6 Effect of Co2+ mass concentration on oxidation rate
从图6可以看出:母液中钴离子质量浓度对草酸氧化率的影响比较大,随着母液中钴离子质量浓度的增加,草酸的氧化率降低,且降低的幅度越来越大。钴离子的存在显著降低了氯气氧化降解母液中草酸的去除效果,且随着钴离子浓度的增加,氯气氧化降解母液中草酸的去除效果越来越差。在氯气氧化降解草酸的过程中,钴离子是一种抑制剂,降低了氯气氧化草酸的速率,使得草酸的分解很难彻底化。
2.6 优化条件实验研究
通过以上的系列实验研究,可得出氯气氧化分解无氨草酸沉钴母液中草酸的优化工艺条件如下:反应温度为50 ℃,反应时间3 h,搅拌速度为700 r/min,氯气用量为149 g。在此优化工艺条件下再进行综合实验,考查氯气对草酸的氧化效果。
实验用的母液的成分为:草酸 20 g/L,盐酸 1.0 mol/L,钴离子 1.0 g/L。处理后的母液中残余草酸的质量浓度为0.42 g/L,草酸的氧化率为97.9%。
3 结论
(1) 采用氯气作为氧化剂,可以有效地将草酸钴沉淀母液中的草酸氧化分解,草酸的氧化率为97.9%。
(2) 由于氯气氧化草酸为气液反应过程,草酸的氧化率随反应温度、氯气用量和反应时间的增加而升高;随着搅拌速度的升高,草酸的氧化率先增加后降低;随着母液中钴离子质量浓度的增加,草酸的氧化率降低。
(3) 经过氯气处理后的母液中残留草酸的质量浓度可降至0.42 g/L,母液可直接返回含钴物料的浸出,实现了废水的零排放及物料的闭路循环,达到了清洁生产的目的。
(4) 本研究采用的是实验室模拟实验,对于有稳定氯气产品来源的企业来说,将可直接采用氯气氧化草酸,实现企业内部的物料循环利用。
[1] 彭容秋. 镍冶金[M]. 长沙: 中南大学出版社, 2005: 194-196.PENG Rong-qiu. Metallurgy of nickel[M]. Changsha: Central South University Press, 2005: 194-196.
[2] 田庆华. 无氨草酸沉淀-热分解制备钴氧化物及其母液循环利用研究[D]. 长沙: 中南大学冶金科学与工程学院, 2009:57-75.TIAN Qing-hua. Study on preparation of cobalt oxide by precipitation-thermolysis process of oxalic acid without ammonia and recovery utilization of the mother liquor[D].Changsha: Central South University. School of Metallurgical Science & Engineering, 2009: 57-75.
[3] Bader H, Hoigne J. Determination of ozone in water by the indigo method[J]. Water Res, 1981, 15(4): 449-456.
[4] Andreozzi R, Isola A, CaPro V, et al. The use of manganese dioxide as a heterogeneous catalyst for oxalic acid ozonation in aqueous solution[J]. Applied Catalysis A: General, 1996, 138(1):75-81.
[5] 赵雷, 孙志忠, 马军. 蜂窝陶瓷催化臭氧化降解水中草酸的研究[J]. 环境科学, 2007, 28(11): 2533-2538.ZHAO Lei, SUN Zhi-zhong, MA Jun. Catalytic ozonation by ceramic honeycomb for the degradation of oxalic acid in aqueous solution[J]. Enviroment Science, 2007, 28(11):2533-2538.
[6] 竹湘锋, 徐新华, 王天聪. Fe(Ⅲ)/O3体系对草酸的催化氧化[J].浙江大学学报: 理学版, 2004, 31(3): 322-325.ZHU Xiang-feng, XU Xin-hua, WANG Tian-chong.Fe(Ⅲ)-catalyzed ozonization of oxalic acid[J]. Journal of Zhejiang University: Science Edition, 2004, 31(3): 322-325.
[7] 彭存尧, 李平安, 党捧仙. 从土霉素废母液中回收草酸[J]. 河南化工, 2001(5): 31-32.PENG Cun-yao, LI An-ping, DANG Peng-xian. Recovery of oxalic acid from waste mother liquor of terraycin[J]. Henan Chemical Industry, 2001(5): 31-32.
[8] 王树民, 杨更亮, 刘海燕. 硫酸铅法回收土霉素发酵废液中的草酸[J]. 河北大学学报: 自然科学版, 2003, 23(1): 45-47.WANG Shu-min, YANG Geng-liang, LIU Hai-yan. Reclaimation of oxalic acid in waste fluid from oxytertracycline factory using lead sulfate[J]. Journal of Hebei University: Science and Technology, 2003, 23(1): 45-47.
[9] 杨久义, 赵风青, 张士莹. 从制药厂废水中提取草酸的工艺研究[J]. 现代化工, 2000, 20(7): 40-42.YANG Jiu-yi, ZHAO Feng-qing, ZHANG Shi-ying. Technology of extracting oxalic acid from waste water in pharmaceutical plants[J]. Modern Chemical Industry, 2000, 20(7): 40-42.
[10] 田庆华, 李治海, 郭学益. P350选择萃取草酸钴沉淀母液中的草酸[J]. 中南大学学报: 自然科学版, 2009, 40(4): 884-890.TIAN Qing-hua, LI Zhi-hai, GUO Xue-yi. Selective extraction of oxalic acid from the cobalt mother-liquor with complexing agent P350[J]. Journal of Central South University: Science and Technology, 2009, 40(4): 884-890.
[11] 唐红萍, 杨明德, 何培炯. 季铵盐萃取草酸的机理[J]. 过程工程学报, 2002, 2(6): 506-511.TANG Hong-ping, YANG Ming-de, HE Pei-jiong. Mechanism of extraction of oxalic acid by quaternary ammonium salt[J]. The Chinese Journal of Process Engineering, 2002, 2(6): 506-511.
[12] Kirsch T, Maurer G. Distribution of oxalic acid between water and organic solutions of tri-n-octylamine[J]. Ind Eng Chem Res,1996, 35(5): 1722-1735.
[13] 曹雁青, 秦炜, 戴猷元. 三辛胺萃取草酸的第3相特性[J]. 化工学报, 2003, 54(5): 585-589.CAO Yan-qing, QIN Wei, DAI You-yuan. Third-phase behavior in extraction of oxalic acid with trioctylamine[J]. Journal of Chemical Industry and Engineering (China), 2003, 54(5):585-589.
