钝顶螺旋藻磁性生物吸附剂的制备及对铬(Ⅵ)的吸附性能
2011-08-04廖鹏飞张武昌穆巍巍吕欢欢黄玉琴夏金兰葛刚
廖鹏飞 ,张武昌,穆巍巍,吕欢欢,黄玉琴,夏金兰,葛刚
(1. 南昌大学 食品科学与技术国家重点实验室,江西 南昌,330047;2. 南昌大学 生命科学与食品工程学院,江西 南昌,330031;
3. 中南大学 资源加工与生物工程学院,湖南 长沙,410083)
随着现代工业的迅猛发展,大量的含重金属离子废水排入环境,严重威胁人类的生态环境和生存质量。其中Cr(Ⅵ)的污染比较突出,与 Cr(Ⅲ)相比具有较高的毒性,并且进入水体后可随水体迁移,再加上生物富集效应,可以通过食物链进入人体直接危机到人类的健康,因此,对Cr(Ⅵ)废水的处理研究具有很重要的意义。生物吸附法是利用廉价的活的或死的生物体来处理重金属废水的一种绿色处理方法,与其他传统的物理、化学方法相比,不仅具有原料来源广泛、价格低廉、可降解、无二次污染、易推广等优点,还能通过选择性的生物吸附或生物浓缩而更有效地从大量废水中选择性地去除微量金属离子而受到广泛的关注[1],因此,近年来,藻类[2-4]、真菌[5-8]等微生物吸附剂或甲壳质[9]、麦秆[10]等其他生物质吸附剂处理重金属离子废水的研究明显增多,特别是对藻类在重金属离子吸附的应用研究更多。蓝藻是资源丰富的原核生物,与其他真核藻类相比具有明显不同的结构特点。蓝藻的生理、生化特性决定了其对重金属有良好的吸附性能[11]。蓝藻类对许多重金属离子具有较强的富集能力,在多数情况下,80%~90%的重金属离子被吸附到藻细胞表面[4],Chernikoval等[12]的研究结果表明:钝顶螺旋藻(Spirulina platensis)对 Mn2+具有很强的吸附能力;Savvaidis[13]利用钝顶螺旋藻从硫脲溶液中回收金,而且无论是活菌还是死菌菌体都对Cu2+,Cd2+和Cr(Ⅲ)等重金属离子都具有很强的吸附能力[14-15]。近年来,由超细磁性颗粒和提供活性基团的生物材料包埋结合起来,构建成的具有特殊吸附性能的微粒子也被用于含重金属离子的废水处理研究。由于这些磁性微粒子能在外加磁场下定向移动,快速实现固液分离和回收、便于实现重金属离子吸附后自动化连续操作等独特的优点,该种磁选分离可能是净化重金属废水最有应用前景的技术之一。Wu等[16]制备介孔的硅烷化磁性纳米颗粒用于重金属离子的吸附和回收,Chang等[17-18]利用碳二亚胺使壳聚糖通过化学键结合在 Fe3O4磁性纳米粒子表面,制备出单分散性的羧甲基壳聚糖-Fe3O4磁性纳米粒子用于 Cu(Ⅱ)和 Co(Ⅱ)的吸附。然而,有关固定化制备磁性的钝顶螺旋藻吸附剂用于重金属离子吸附的研究鲜有报道。本文作者采用海藻酸钙包埋钝顶螺旋藻和 Fe3O4磁性纳米粒子制备磁性钝顶螺旋藻生物吸附剂并用于 Cr(Ⅵ)的吸附,研究不同pH、温度、吸附动力学等对Cr(Ⅵ)的吸附性能,为处理含 Cr(Ⅵ)废水处理提供思路和理论指导。
1 材料及方法
1.1 钝顶螺旋藻(Spirulina platensis)培养与收获
钝顶螺旋藻由南昌大学植物研究室提供。培养时采用Zarrouk培养基,在光照培养箱中以温度为(30±1)℃,pH 为 8.5~10.5,光照强度为 72 μmol/(m2·s),光照明暗比为12 h:12 h的条件下培养。
将对数生长期的钝顶螺旋藻用绢布过滤,用去离子水洗涤3次,刮下细胞,冷冻干燥后备用。
1.2 钝顶螺旋藻磁性生物吸附剂的制备
1.2.1 四氧化三铁纳米磁性粒子的制备[19]
称取 2.78 g FeSO4·7H2O,4.73 g FeCl3·6H2O(Fe3+与 Fe2+的摩尔比为 1.75:1)和 1 g SDS(十二烷基硫酸钠),并将它们溶于水中定容至100 mL。溶液转移至烧杯中并水浴加热,剧烈搅拌。当温度升高至63 ℃时,缓慢滴加30 mL质量分数为25%的氨水。在反应过程中,溶液pH维持在10左右,沉淀物在80 ℃下加热熟化30 min,用去离子水洗涤数次,干燥备用。所得的四氧化三铁磁性纳米粒子经Zeta电位和粒度分析仪(Zeta Plus, BIC, 美国)测定平均粒度为12 nm。
1.2.2 固定化
将 0.5 g冷冻干燥的钝顶螺旋藻细胞和制得的0.1 g四氧化三铁纳米粒子加入到50 mL 3%的海藻酸钠溶液中,充分搅拌,再用蠕动泵和孔径为2 mm的毛细管将混合液滴加到0.5 mol/L的CaCl2溶液中形成包埋物,静置过夜,过滤,用去离子水多次冲洗,冷冻干燥得到最终产物,即得到固定化的钝顶螺旋藻磁性生物吸附剂,该吸附剂为球形、黑色,粒径范围为0.8~1.3 mm,如图1所示。钝顶螺旋藻磁性生物吸附剂在外加磁场下具有很强的磁响应性。
1.3 钝顶螺旋藻磁性吸附剂对Cr(Ⅵ)吸附实验
1.3.1 pH对Cr(Ⅵ)生物吸附的影响
取30 mL 10 mg/L Cr(Ⅵ)离子溶液,置于100 mL三角瓶中,通过精密酸度计(PHS-25,雷磁)用 0.1 mol/L 的盐酸和氢氧化钠调节所需pH,然后分别加入固定化钝顶螺旋藻磁性吸附剂0.2 g,在40 ℃的恒温摇床上恒温振荡(170 r/min)吸附4 h后,磁性分离出磁性吸附剂,移取一定上清液,用二苯碳酰二肼分光光度法测定反应前、后金属离子的浓度[20]。
1.3.2 温度对Cr(Ⅵ)生物吸附的影响
取10 mg/L Cr(Ⅵ)离子溶液30 mL,置于100 mL的三角瓶中,分别加入固定化钝顶螺旋藻磁性吸附剂0.2 g。调节溶液pH=1.8,在10~50 ℃ 范围内某一个温度下,恒温摇床振荡吸附4 h,测定反应前、后金属离子的浓度。
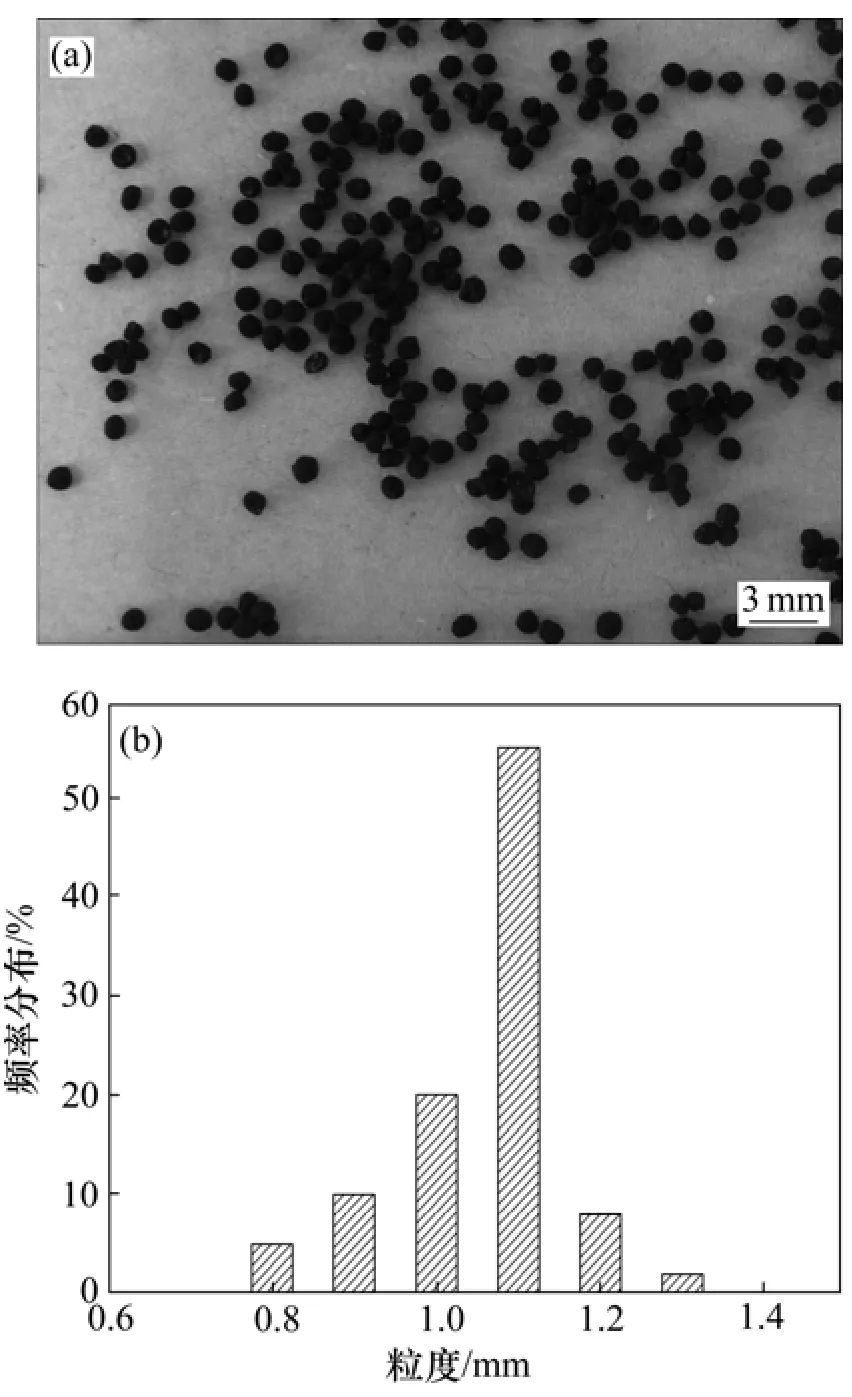
图1 钝顶螺旋藻磁性生物吸附剂的形貌和粒度分布Fig.1 Picture and size distribution of dried magnetic biosorbents of Spirulina platensis
1.3.3 吸附时间对Cr(Ⅵ)生物吸附的影响
初始Cr(Ⅵ)质量浓度为10 mg/L,加入钝顶螺旋藻磁性生物吸附剂0.2 g,调pH为1.7,在40 ℃恒温摇床振荡吸附不同的时间,在反应体系中定时取样,测定反应前、后金属离子的浓度。
1.3.4 Cr( Ⅵ) 等温吸附线的测定
取质量浓度分别为 10,30,50,100,200,300和400 mg/ L的Cr(Ⅵ)离子溶液30 mL置于100 mL的三角瓶中,并分别加入0.2 g钝顶螺旋藻磁性生物附剂,调节溶液pH=1.8,在40 ℃的恒温摇床振荡吸附,吸附时间为4 h,测定反应前、后金属离子的浓度。
1.3.5 对 Cr(Ⅵ)的吸附容量和吸附效率(即去除率)的计算
其吸附容量按照下式进行计算[21]:

吸附效率为:
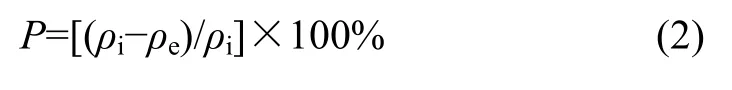
其中:q为吸附容量(每克吸附剂吸附重金属离子的质量,mg/g);P为去除率(%);ρi为重金属离子初始质量浓度(mg/L);ρe为重金属离子平衡质量浓度(mg/L);V为溶液体积(mL);m为生物吸附剂质量(g)。
2 结果与讨论
2.1 pH的影响
吸附液 pH直接影响到重金属离子的化学性质及与生物吸附剂表面功能基团的活性,所以 pH是生物吸附的一个重要影响因素。研究表明:只有在适宜的pH范围内,吸附才是行之有效的。
图2所示为pH对Cr(Ⅵ)在2种不同吸附剂上生物吸附量的影响。由图 2可见:磁性生物吸附剂对Cr(Ⅵ)的吸附量q在pH<4时开始增加,pH<3时明显增加,pH>4时,吸附量很低且基本保持不变。出现这种情况的原因可能是 Cr(Ⅵ)在水溶液中主要以[Cr2O7]2-和[HCrO4]-等铬酸根的形式存在,同时由氨基酸、糖的离解规律可知:当溶液pH<4时,蛋白质侧链羧酸根和可能的糖链末端羧酸根等与质子结合,随着pH的进一步降低,如pH<1.5,大部分蛋白质末端羧酸根也开始与质子结合[21],这种结合使得细胞表面正电性不断增加,从而促使对带负电的 Cr(Ⅵ)吸附不断增加;当溶液pH为4~9时,蛋白质链上的碱性氨基侧链和末端氨基均基本保持着质子化状态,对带负电的Cr(Ⅵ)仍然能产生局部静电吸附,但吸附能力差且吸附容量基本保持不变。而对于海藻酸钙来说,在实验的整个 pH范围内,其吸附容量远远低于钝顶螺旋藻磁性生物吸附剂,且其吸附容量随 pH的变化不大,这说明磁性生物吸附剂的吸附能力主要是来源于微藻本身,而不是海藻酸钙。

图2 pH对Cr(Ⅵ)在2种不同吸附剂上生物吸附量的影响Fig.2 Effect of pH on biosorption of Cr(Ⅵ) on two different adsorbents
根据实验结果,钝顶螺旋藻磁性生物吸附剂对Cr(Ⅵ)的吸附最佳pH为1.5左右。
2.2 温度的影响
由于温度影响溶液中金属离子的稳定性、金属-细菌之间络合的稳定性以及对细胞壁结构、对细胞壁上化学物质的电离等的影响,从而称为吸附过程中重要控制因素之一。
图3所示为温度对Cr(Ⅵ)在2种不同吸附剂上生物吸附的影响。由图3可以看出:钝顶螺旋藻磁性生物吸附剂对Cr(Ⅵ)的吸附容量随温度升高而升高,在20~40 ℃时吸附容量升高得最快,40~50 ℃时吸附容量缓慢上升。而海藻酸钙对Cr(Ⅵ)的吸附容量随温度的变化很小。可能原因是:提高温度可以增强钝顶螺旋藻磁性生物吸附剂表面活性,改变活性基团的解离状态及加速溶液中粒子运动。所以,选择40 ℃为吸附最佳温度。这与 Bustard等[22]研究温度对Kluyveromyces marxianus吸附铀的影响及李志勇等[15]研究钝顶螺旋藻生物富集Cr(Ⅲ)影响因子时得出的结果类似。
2.3 吸附动力学

图3 温度对Cr(Ⅵ)在2种不同吸附剂上生物吸附量的影响Fig.3 Effect of temperature on biosorption of Cr(Ⅵ) on two different adsorbents
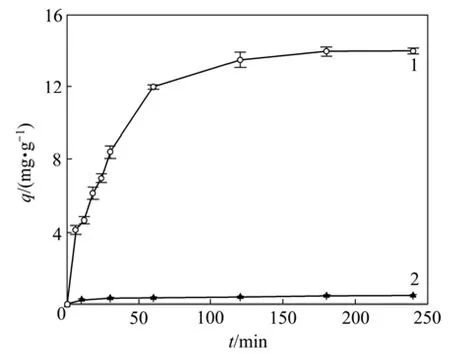
图4 吸附时间对Cr(Ⅵ)在2种不同吸附剂上生物吸附量的影响Fig.4 Effect of time on biosorption of Cr(Ⅵ) on two different adsorbents
图4所示为吸附时间对Cr(Ⅵ)在2种不同吸附剂上生物吸附量的影响。由图4可见:钝顶螺旋藻磁性生物吸附剂对Cr(Ⅵ)的吸附可分为2个阶段:第1个是快速阶段(0~60 min);第2个是缓慢阶段;最后趋于平衡。当初始Cr(Ⅵ)质量浓度为10 mg/L,6 min时钝顶螺旋藻磁性生物吸附剂的吸附量达到了饱和吸附量的29.6%,60 min达到85.8%,60 min后缓慢地增长,到达120 min时吸附接近平衡吸附容量达到饱和吸附量的 96.5%。而海藻酸钙对 Cr(Ⅵ)的吸附容量很小,随时间增加的变化不大。产生上述现象的原因可能是:首先钝顶螺旋藻磁性生物吸附剂对Cr(Ⅵ)的吸附发生在细胞表面上,此时细胞表面的可结合位点很多且溶液中Cr(Ⅵ)的溶度较大,吸附呈现出快速吸附阶段;随后细胞表面被Cr(Ⅵ)覆盖,表面的吸附位点急剧减少,吸附转移到细胞内部,进行细胞内的吸收和转化。导致吸附过程的速度缓慢,120 min以后钝顶螺旋藻吸附Cr(Ⅵ)接近饱和状态,吸附趋向平衡。
假定钝顶螺旋藻磁性生物吸附剂吸附 Cr(Ⅵ)的数据(6~60 min)可用一级反应动力学方程拟合,一级反应动力学方程为:
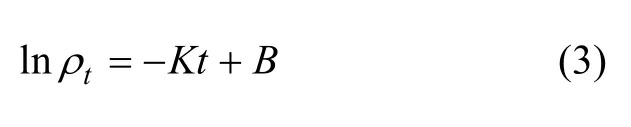
式中:tρ为吸附过程中t时刻溶液中重金属离子的剩余质量浓度(mg/L);K为反应速率常数(min-1);t为接触反应时间(min)。
将实验数据按式(3)处理后,在6~60 min内Cr(Ⅵ)的t-lntρ关系如图5所示。从图5可以看出:在6~60 min内磁性生物吸附剂对Cr(Ⅵ)的吸附数据拟合出来的函数关系中线性相关系数R2=0.985 4,所以,可以认为该吸附过程的反应速率常数为0.028 9,具有一级反应动力学特征即在该阶段反应速率和离子浓度成正比。

图5 钝顶螺旋藻磁性生物吸附剂吸附Cr(Ⅵ)反应的一级动力学(6~60 min)Fig.5 The first order kinetics of adsorption of Cr(Ⅵ) on magnetic biosorbents of Spirulina platensis for 6-60 min
2.4 Cr(Ⅵ)初始质量浓度的影响

图6 Cr(Ⅵ)初始质量浓度对生物吸附剂吸附量q和去除率的影响Fig.6 Effect of initial concentration of Cr(Ⅵ) on biosorption and removal rate on magnetic biosorbents of Spirulina platensis
图 6所示为 Cr(Ⅵ)初始质量浓度对吸附的影响。试验过程及结果表明:随着Cr(Ⅵ)质量浓度的增加,吸附量随之增加,但是去除率逐渐下降,磁性生物吸附剂的去除率由 10 mg/L时的 81.0%降至400 mg/L时的27.1%。这是因为Cr(Ⅵ)初始质量浓度越低,Cr(Ⅵ)就越容易结合吸附剂上的活性点而去除率越大,但随着Cr(Ⅵ)初始质量浓度的增大,单位质量的吸附剂周围所包含的Cr(Ⅵ)也越多,吸附变得困难而使去除率降低。就本实验而言,当Cr(Ⅵ)初始质量浓度为10 mg/L 时,磁性生物吸附剂具有良好的吸附效果,Cr(Ⅵ)去除率为81.0%。
重金属Cr(Ⅵ)的生物吸附过程的模型可以用一些生物等温吸附经验公式来定量描述。其中,Langmuir和Freundlich方程是被广泛应用于水和废水处理过程中进行数据分析的等温吸附模型。
Langmuir(L)型吸附模式是常用的描述吸附体系中金属离子吸附与溶液中金属离子平衡浓度之间关系的平衡式。它是以下列假定为基础的:吸附是在吸附剂活性中心上进行,这些活性中心具有均匀的能量;且相隔较远,因此,吸附物分子之间无相互作用力;每个活性中心只能吸附1个分子,即形成单分子吸附层。存在以下的平衡:

式中:M为重金属离子;L为吸附剂活性中心。平衡方程式(4)的过程可以表述为:
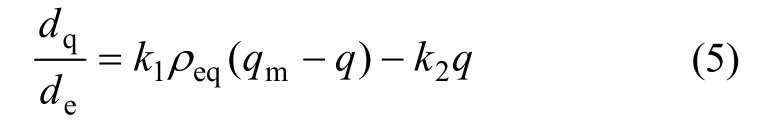
由方程式(5)得:

由方程式(6)得:

式中:q为吸附容量(mg/g);qm为最大吸附量(每克生物质吸附金属最大质量,mg/g);ρeq为重金属离子平衡质量浓度(mg/L);k1和k2分别为正、逆反应的速率;kd=k2/k1,是与吸附性能有关的常数[23]。
但是,被吸附的分子之间还可能发生协同作用:一个被吸附到表面的分子可能会对那些吸附到临近吸附位点的分子造成影响,从而背离了理想吸附方程。Freundlich(F)型吸附等温式就是基于吸附质在多相表面上的吸附建立的经验吸附平衡模式。方程表述为:

式中:KF和n都是F型方程的吸附常数;KF是与吸附容量有关,而n与吸附强度有关。
其对数形式为:

将实验数据用 Langmuir 和 Freundlich等温线方程进行拟合,结果见表1和图7。可见:钝顶螺旋藻磁性生物吸附剂对 Cr(Ⅵ)的吸附行为符合 Langmuir与 Freundlich 等温吸附特征。但更适合用 Freundlich等温吸附模型描述。

表1 Cr(Ⅵ)吸附的Langmuir与Freundlich等温吸附方程模拟特征值Table 1 Parameters of Cr(Ⅵ) biosorption by Langmuir and Freundlich models
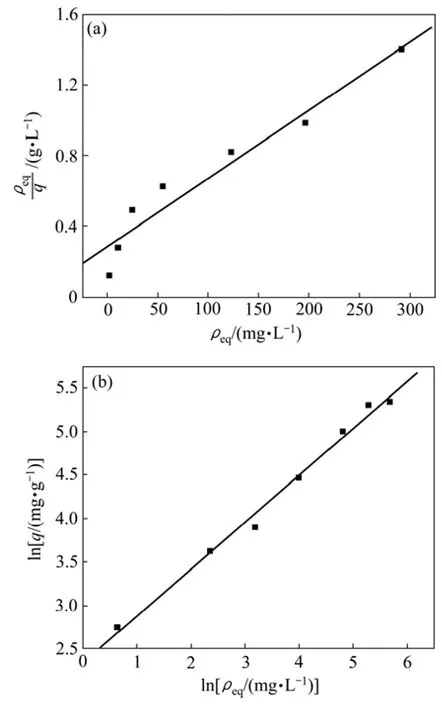
图7 Cr(Ⅵ)的Langmuir和Freundlich等温吸附模型模拟Fig.7 Modeling of Cr(Ⅵ) biosorption isotherm by Langmuir model and Freundlich model
3 结论
(1) 钝顶螺旋藻磁性生物吸附剂对 Cr(Ⅵ)的吸附在pH为1.5左右,温度为40 ℃,Cr(Ⅵ)的初始质量浓度为10 mg/L,吸附时间为2 h时吸附效果最佳。
(2) 钝顶螺旋藻磁性生物吸附剂对 Cr(Ⅵ)吸附过程可以分为 2个阶段:首先是快速吸附阶段(0~60 min),其中6~60 min吸附过程具有一级反应动力学特征,快速吸附阶段之后,进入缓慢吸附阶段,吸附2 h后达到平衡。
(3) 钝顶螺旋藻磁性生物吸附剂对 Cr(Ⅵ)的吸附过程均可以用Langmuir和Freundlich等温吸附模型进行描述,但更符合Freundlich等温模型的吸附特征随着Cr(Ⅵ)浓度的增加,吸附容量也随之增加,吸附率则逐渐下降。
(4) 钝顶螺旋藻磁性生物吸附剂对重金属离子具有强吸附能力且能在加有外界磁场下定向分离,简化固液分离过程,为工业上高效、快速及自动化净化重金属污水提供了理论依据。
[1] Chojnacka K, Chojnacki A, Gorecka H. Trace element removal bySpirulina sp.from copper smelter and refinery effluents[J].Hydrometallurgy, 2004, 73(1/2): 147-153.
[2] Vijayaraghavan K, Jegan J, Palanivelu K, et al. Biosorption of copper, cobalt and nickel by marine green algaUlva reticulatain a packed column[J]. Chemosphere, 2005, 60(3): 419-426.
[3] Vijayaraghavan K, Padmesh T V, Palanivelu K, et al.Biosorption of nickel (Ⅱ) ions ontoSargassum wightii:Application of two-parameter and three-parameter isotherm models[J]. Journal of Hazardous Materials, 2006, 133(1/2/3):304-308.
[4] Carmona M E R, da Silva M A P, Leite S G F. Biosorption of chromium using factorial experimental design[J]. Process Biochemistry, 2005, 40(2): 779-788.
[5] Tunali S, Akar T, Ozcan A S, et al. Equilibrium and kinetics of biosorption of lead (Ⅱ) from aqueous solutions byCephalosporium aphidicola[J]. Separation and Purification Technology, 2006, 47(3): 105-112.
[6] Göksungur Y, Üren S, Güvenç U. Biosorption of cadmium and lead ions by ethanol treated waste baker’s yeast biomass[J].Bioresource Technology, 2005, 96(1): 103-109.
[7] WANG Jian-long, MAO Ze-yu, ZHAO Xuan. Response ofSaccharomyces cerevisiaeto chromium stress[J]. ProcessBiochemistry, 2004, 39(10): 1231-1235.
[8] Ksheminska H, Fedorovych D, Babyak L, et al. Chromium (Ⅲ)and (Ⅵ) tolerance and bioaccumulation in yeast: A survey of cellular chromium content in selected strains of representative genera[J]. Process Biochemistry, 2005, 40(5): 1565-1572.
[9] Sag Y, Aktay Y. Application of equilibrium and mass transfer models to dynamic removal of Cr(Ⅵ) ions by chitin in packed column reactor[J]. Process Biochemistry, 2001, 36(12):1187-1197.
[10] LI Chun, CHEN Hong-zhang, LI Zuo-hu. Adsorptive removal of Cr(Ⅵ) by Fe-modified steam exploded wheat straw[J]. Process Biochemistry, 2004, 39(5): 541-545.
[11] 陈思嘉, 郑文杰, 杨芳. 蓝藻对重金属的生物吸附研究进展[J]. 海洋环境科学, 2006, 25(4): 103-106.CHEN Si-jia, ZHENG Wen-jie, YANG Fang. Study advances on heavy metals bio-absorbed by cyanobacteria[J]. Marine Environmental Science, 2006, 25(4): 103-106.
[12] Chernikoval A A, Tsoglin L N, Markelova A G, et al. Capacity ofSpirulina platensisto accumulate manganese and its distribution in cell[J]. Russian Journal of Plant Physiology, 2006,53(6): 800-806.
[13] Savvaidis I. Recovery of gold from thiourea solutions using microorganisms[J]. Biometals, 1998, 11(2): 145-151.
[14] 陈必链, 吴松刚. 钝顶螺旋藻对7种重金属的富集作用[J]. 福建师范大学: 自然科学版, 1999, 15(1): 81-85.CHEN Bi-lian, WU Song-gang. Accumulation of 7 heavy metals inSpirulina platensis[J]. Fujian Teachers University: Natural Science, 1999, 15(1): 81-85.
[15] 李志勇, 李元广, 郭祀远, 等. 钝顶螺旋藻生物富集 Cr(Ⅲ)影响因素的研究[J]. 生物工程学报, 2000, 16(1): 109-112.LI Zhi-yong, LI Yuan-guang, GUO Si-yuan, et al. Study of the factors of Cr(Ⅲ) bioaccumulation onSpirulina platensis[J].Chinese Journal of Biotechnology, 2000, 16(1): 109-112.
[16] WU Ping-gui, XU Zheng-he. Silanation of nanostructured mesoporous magnetic particles for heavy metal recovery[J].Industrial & Engineering Chemistry Research, 2005, 44(4):816-824.
[17] CHANG Yang-chuang, CHEN Dong-huang. Preparation and adsorption properties of monodisperse chitosan-bound Fe3O4magnetic nanoparticles for removal of Cu(Ⅱ) ions[J]. Journal of Colloid and Interface Science, 2005, 283(2): 446-451.
[18] CHANG Yang-chuang, CHANG Song-wen, CHEN Dong-huang.Magnetic chitosan nanoparticles studies on chitosan binding and adsorption of Co(Ⅱ) ions[J]. Reactive & Functional Polymers,2006, 66(3): 335-341.
[19] Liao M H, Chen D H. Immobilization of yeast alcohol dehydrogenase on magnetic nanoparticles for improving its stability[J]. Biotechnology Letters, 2001, 23(20): 1723-1727.
[20] 谢华林, 杨华林. 二苯碳酰二肼分光光度法测水中 Cr(Ⅵ)[J].常德师范学院学报: 自然科学版, 2001, 13(2): 65-66.XIE Hua-lin, YANG Hua-lin. Study on applying dipheny-lcarbonydrazide into detecting Cr6+in water[J]. Journal of Changde Teachers University: Natural Science, 2001, 13(2):65-66.
[21] SHEN Li, XIA Jin-lan, HE Huan, et al. Comparative study on biosorption of Pb(Ⅱ) and Cr(Ⅵ) bySynechococcussp[J]. Trans Nonferrous Met Soc China, 2008, 18(6): 1336-1342.
[22] Bustard M, Donnellan N, Rollan A, et al. Studies on the biosorption of uranium by a thermotolerant, ethanol-producing strain ofKluyveromyces marxianus[J]. Bioprocess Engineering,1997, 17(1): 45-50.
[23] Trivedi B D, Patel K C. Biosorption of hexavalent chromium from aqueous solution by a tropical basidiomycete BDT-14(DSM 15396)[J]. World Journal of Microbiology Biotechnology,2007, 23(5): 683-689.
