超声引导下肝肿块穿刺活检对临床的价值
2011-08-04张晖季正标闻捷先黄备建丁红王文平
张晖 季正标 闻捷先 黄备建 丁红 王文平
随着影像技术的不断发展, 临床对肝肿块的检出率及良恶性肿瘤的判断能力不断提高, 但仍有部分病例需要通过肝肿块穿刺活检才能明确肿块性质。为此, 本文对中山医院超声科在2006年1月—2011年1月间对170例诊断不明的肝肿块穿刺活检病例的结果总结如下。
1 资料和方法
1.1 病例资料
共170例诊断不明的肝肿块患者中, 本院住院病人87例, 门诊病人83例。其中肝内实质性占位病灶164例,囊实性占位6例。男性115例, 女性55例, 年龄18~80岁, 平均(55.5±13.0)岁。全部患者术前凝血酶原时间测定正常或纠正至正常。所有患者均行血清甲胎蛋白( alpha-fetoprotein, AFP)、癌胚抗原(carcinoma embryonic antigen, CEA)等测定。实验室检查结果与影像学检查或临床资料不符者考虑穿刺活检。
1.2 仪器和方法
1.2.1 仪器和参数
采用Madison Accuvix-V10、SA-6000和PHILIPS HD3超声诊断仪, 探头为常规腹部超声探头,频率2.5~5.0 MHz。选用BARD活检枪及18G活检针。
1.2.2 方法
灰阶超声扫查整个肝脏, 发现病灶后测量大小, 观察肿块的形态及内部回声,彩超检查观察肿块内血管分布及走行。选择穿刺病灶后存盘, 确定进针点后标记。局部皮肤消毒、铺巾, 用消毒塑料袋包住探头后再次确定进针点与方向, 1%利多卡因局麻后在超声实时引导下进针, 针尖到达预定的病灶部位时, 推进针芯,触发板机后迅速退针, 观察针槽内组织的颜色、质地和长度, 置于消毒滤纸片上, 放入10%福尔马林溶液固定后送病理科。如认为取材不满意, 可改变进针方向或深度重复进行, 但一般不超过3次。少部分标本坏死易碎者另涂片3张送细胞室。穿刺后门诊病人留院观察1 h, 住院病人回病房监护。
穿刺病理结果与手术后病理诊断或肝动脉造影、CT、MRI、PET-CT及AFP等临床其他资料综合对照分析统计。无手术结果的良性病变随访半年以上, 无随访结果者的“炎症性病变淋巴组织增生”、“少量异型细胞”与“肝细胞变性”等诊断作可疑诊断或不能帮助诊断, 最后临床诊断为恶性肿瘤而穿刺病理未发现肿瘤组织或细胞者为假阴性。
2 结 果
接受超声引导下肝脏占位病灶穿刺活检的患者170例, 平均每个病灶进针1.81次。其中获确切良恶性病理诊断者占91.2%(155/170); 可疑诊断或不能帮助诊断者占7.06%(12/170); 假阴性3例, 占1.76%;无假阳性。在病理诊断明确的155例中, 恶性肿瘤124例, 其中原发性肝肿瘤62例, 包括肝细胞肝癌26例、胆管细胞癌19例、肝上皮样血管内皮瘤7例、淋巴瘤4例、神经内分泌癌3例、恶性纤维组织细胞瘤、平滑肌肉瘤、间质瘤各1例; 肝转移性肿瘤55例, 其中包括:神经内分泌癌转移、间质瘤转移、平滑肌肉瘤转移及转移性小细胞癌共19例, 其他由肺、胃肠道、胰腺、乳腺、胆囊、食道、卵巢、子宫、肾等全身各部位恶性肿瘤的转移性肿瘤36例; 另有7例提示恶性肿瘤未能分型。良性病变31例, 其中包括肝脓肿及炎症10例, 肝结核、炎性假瘤、局灶性结节增生、血管瘤、增生结节、肉芽肿、寄生虫、血吸虫、淀粉样变及脂肪变性共21例。有1例穿刺后数小时发现血压下降, 出血休克,经抢救手术后并发DIC, 抢救无效死亡, 严重并发症发生率0.59%(1/170), 无感染或其他器官损伤、种植等并发症发生。
3 讨 论
尽管现代影像技术日益提高, 能显示肝内0.5 cm左右的占位病灶[1], 结合声像图特征及临床资料能对大部分占位病灶作出定性诊断, 但超声引导下穿刺活检术仍是诊断性质不明肝肿块的首选方法之一。尤其在下述情况下, 超声引导下穿刺活检是取得病理诊断的最佳方法: ⑴在肝硬化基础上出现结节, 尤其表现为低回声且AFP不高时, 需行原发性肝癌与其他继发性肝癌、良性病变的鉴别: 本组原发性肝细胞肝癌(hepatocellular carcinoma, HCC)26例中, 穿刺前误诊5例, 其中1例结肠淋巴瘤手术后4个月发现肝内病灶(图1), 超声、CT及MRI均误诊为淋巴瘤转移; 另1例胰腺癌伴肝内病灶, PET-CT即考虑胰腺癌肝转移; 还有3例, 分别误诊为胆管细胞癌(cholangiocellular carcinoma, CCC)、良性病变及炎症性病变。⑵当肝内发现占位病灶考虑为转移灶, 但原发灶定位不明确或有原发癌肿, 但肝内病灶不能确定是否转移: 本组肝转移性肿瘤55例中, 17例分别明确了转移性肿瘤的病理诊断从而使临床确定诊断, 部分找到原发肿瘤; 另外38例则佐证了肝内病灶与原发肿瘤属同一来源; 另5例术前有乳腺癌等手术史,考虑转移, 穿刺结果病理证实为原发性肝肿瘤(包括HCC、CCC、平滑肌肉瘤等), 为进一步治疗提供了依据。⑶CCC的表现不典型, 不易与肝脓肿等炎症性病变鉴别[2]: 本组19例CCC中, 其中4例6例次分别由超声、CT及MRI考虑炎症性病变或脓肿, 而在31例良性病变中的3例曾考虑CCC可能大。⑷部分少见类型肝肿瘤的鉴别: 如肝上皮样血管内皮瘤7例中, 仅2例被超声及MRI诊断, 其余分别被超声、CT、MRI及PET-CT误诊为转移性肿瘤。⑸部分肝脓肿患者临床表现不典型, 加上早期抗生素的不正规使用, 使得声像图表现不典型(图2), 难以与CCC、HCC坏死液化等鉴别; 少数肝结核、寄生虫性肉芽肿及局灶性结节增生等良性病变与肝恶性肿瘤的鉴别: 本组中1例肝右前叶病灶与胆囊分界不清, 疑胆囊癌肝浸润, 穿刺为凝固性坏死,考虑炎症, 2月后病灶明显缩小; 另1例肝多发低回声病灶, 考虑转移性MT, 穿刺为炎症, 1月后病灶明显缩小与减少。超声引导下穿刺活检对明确病理诊断及病人预后, 指导临床治疗的作用与其他影像技术相比有其独特的优点。
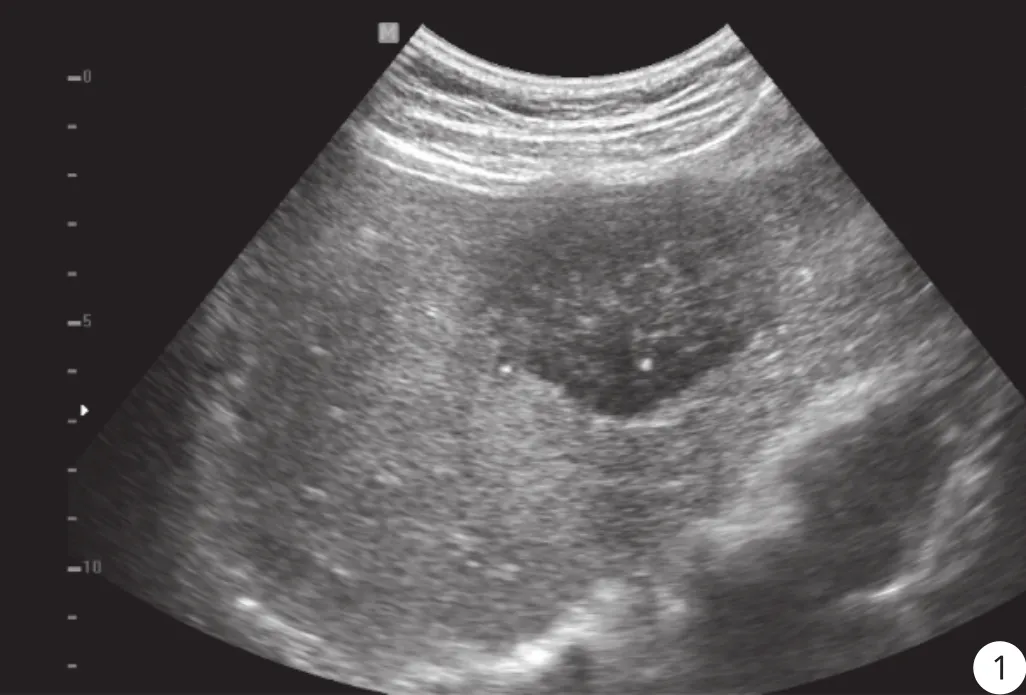
图1 结肠淋巴瘤术后肝转移声像图 男, 57岁, 结肠淋巴瘤手术后4月, 肝左叶见69 mm×42 mm低回声占位, 考虑淋巴瘤转移, 穿刺及手术后病理均为HHCCCC
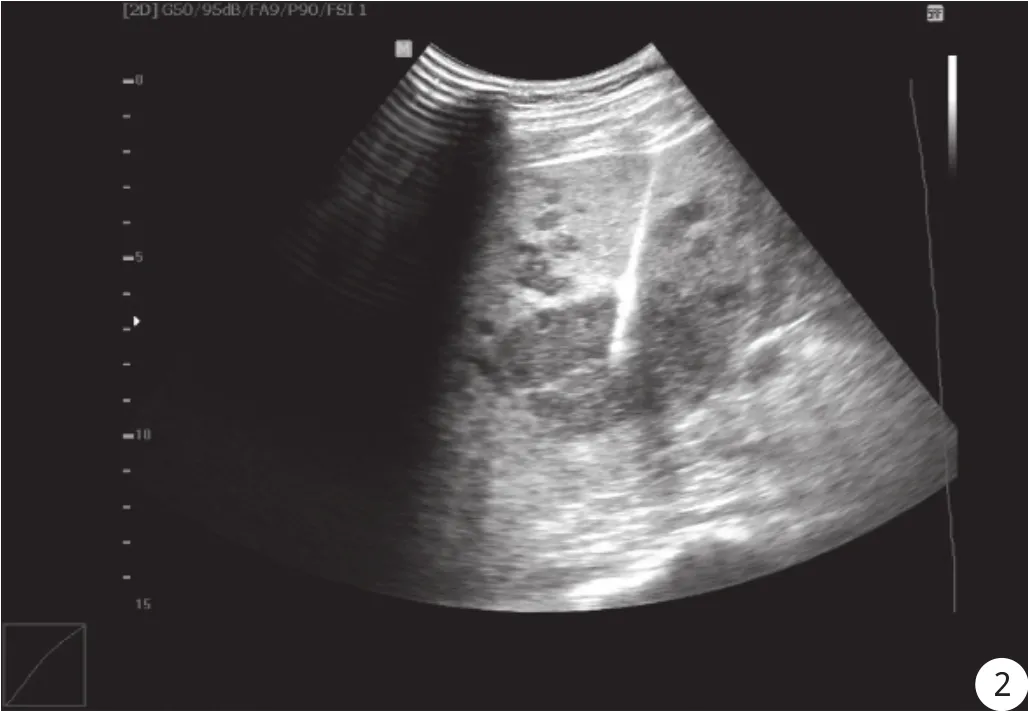
图2 临床表现不典型肝脓肿患者声像图表现 男, 44岁, 发热半月, 超声发现肝多发低回声占位, 大者45 mm×35 mm, 未见明显彩色血流, 考虑CCC, 穿刺后病理: 炎症性病变, 脓肿形成。2月后超声示病灶消失, 行PET-CT检查: 发现肝内未见异常糖代谢区。
但与大体标本相比, 穿刺标本取材有限, 有时不能满足分型诊断, 尤其当肿瘤坏死明显时, 本组7例恶性肿瘤不能明确分型诊断, 其中3例为门诊病人未行酶标检查, 不能分型, 仅提示淋巴瘤可能或上皮样恶性肿瘤; 2例提示恶性肿瘤, 坏死明显, 不能分型, 其中1例手术后病理仍为上皮性恶性肿瘤伴坏死, 转移性不能除外; 另2例因标本坏死明显, 同时涂片诊断均见恶性肿瘤细胞, 其中1例手术后病理为肝母细胞瘤出血坏死。在12例可疑诊断或不能帮助诊断者中, 1例超声、MRI及PET-CT均考虑MT, 但穿刺病理为肉芽肿性病变, 倾向结核, 临床查结核菌素试验阳性, 考虑结核肿瘤同时存在; 另有2例即使手术也未能确定诊断: 1例18岁男性,肝右叶巨大囊实性占位, 超声造影考虑肿瘤伴血肿, 穿刺病理诊断:高分化肝癌, 不排除腺瘤, 而手术后病理为: 腺瘤伴增生或高分化腺癌; 另1例不能确定诊断者术前发现甲状腺实质占位, 肝多发占位, 超声造影考虑甲状腺MT, 肝转移性MT, 然肝占位穿刺病理为散在炎症细胞, 甲状腺穿刺病理未见肿瘤证据, 因临床高度怀疑甲状腺MT, 手术切除病变甲状腺, 无奈, 病理诊断仅提示细胞丰富, 考虑不典型腺瘤, 仍不能帮助诊断。在3例假阴性中, 1例为介入治疗后的病人; 1例为左内叶2.0 cm病灶, 病灶较难显示, 可能患者屏气困难所致取材失败; 还有1例CCC可能因病灶模糊不易显示以致未能穿到肿瘤组织。
要明确病理诊断及类型, 作为有创(微创)检查,超声引导下肝肿块穿刺活检术应该是安全的。穿刺所造成的严重并发症主要指死亡、需要输血或需外科手术治疗的出血、邻近器官的损伤、血气胸、腹膜炎、严重感染、麻醉药物过敏等[3]。文献报道严重并发症的发生率1%左右[4-5], 与穿刺有关的死亡率0.48%, 本组发生率0.59%, 与文献报道相似。据文献[3,6]报道及术者的经验, 其主要并发症出血的发生率与穿刺针的规格无明显关系, 可能与操作者的操作熟练程度及病人的基础状况有关。本组发生的出血患者病理诊断为非霍杰金淋巴瘤NKT细胞型, 该病高度恶性, 极易并发DIC, 其出血可能与其严重的基础疾病有关[5]。但需总结的教训是: 尽管笔者当初对该患者穿刺有顾虑, 但仍在临床要求下按照常规顺利进行了穿刺。回顾该病例,如果能够及时发现出血, 预后可能有一定改观。当然,对于这类病例是否作为穿刺禁忌尚值得探讨: 一方面,临床因无病理诊断陷入诊断治疗困境; 另一方面, 患者因穿刺须面临巨大的出血风险。笔者的看法是: 术前充分向患者介绍穿刺的必要性及巨大的出血风险, 由患者自主选择是否穿刺; 术中操作仔细熟练, 尽量减少进针次数; 术后严密观察手术区及生命体征, 尤其对伴有肝肿大、怀疑淋巴瘤或病灶内血供丰富者; 以便及时发现异常迹象, 及时处理, 这是避免严重并发症改善预后的关键。
综上所述, 超声引导下穿刺活检对肝肿块的病理诊断准确率高, 创伤性小, 费用低廉, 操作方便, 是获得病理诊断的首选方法。但需掌握适应症, 对有出血风险者术后严密监护, 尽量避免严重并发症的发生。
[1] 王文平, 李超伦, 丁红, 等. 转移性肝癌的实时超声造影诊断[J]. 中华超声影像学杂志, 2008, 17(2):127-129.
[2] 张晖, 毛枫, 丁红,等. 肝内胆管细胞癌的超声诊断 [J]. 中国临床医学, 2007, 14(6): 871-873.
[3] Rossi P, Sileri P, Gentileschi P, et al. Percutaneous liver biopsy using an Ultrasound-guided subcostal route [J]. Dig Dis Sci,2001, 46(1):128-132.
[4] Tenberge J, Hoffman B J, Hawes R H, et al. EUS-guided fine needle aspiration of the liver: indication, yield, and safety based on an international survey of 167 cases [J]. Gastrointestendosc, 2002, 55(7): 859-862.
[5] Birgit T, Isabelle L, Franz L, et al. Bleeding complications after percutaneous liver biopsy-an analysis of risk factors [J].Digestion, 2003,67(3):138-145.
[6] 董宝玮, 梁萍, 于晓玲, 等. 超声引导粗针与细针穿刺活检比较 [J]. 中华超声影像学杂志, 2000, 9(2):71-73.
