IGF-1诱导神经干细胞向少突胶质细胞分化的机制
2011-08-02张殿君付长峰张利恒吉林大学第一医院吉林长春3002
张殿君 谭 岩 付长峰 张利恒 (吉林大学第一医院,吉林 长春 3002)
少突胶质细胞是中枢神经系统的髓鞘形成细胞,与多发性硬化、脑白质发育不良及脑脊髓损伤等中枢神经系统疾病关系密切。但体外诱导神经干细胞(NSCs)分化研究表明,NSCs虽然具有多分化潜能,但在自然分化状态下分化为星形胶质细胞的潜能最大,少突胶质细胞所占比例最少〔1〕。因此,如能使用一定方法使NSCs定向分化为少突胶质细胞,可为中枢神经的损伤修复提供更多的种子细胞。研究发现胰岛素样生长因子-1(IGF-1)对于神经细胞正常生长、发育的调节具有重要作用,可促进神经细胞的突触形成、树突快速生长及髓鞘生成;可以影响不同类型神经细胞及相关细胞的生存能力,提高神经细胞的分化和发育;可以促进少突胶质细胞以及髓鞘的生长,并能促进肿瘤坏死因子-α(TNF-α)脱髓鞘后的髓鞘再生〔2~5〕。因此,本研究拟探讨IGF-1诱导脊髓源性NSCs向少突胶质细胞方向分化的机制,为探索治疗脊髓损伤的新方法奠定基础。
1 材料与方法
1.1 材料 DMEM/F12(1∶1)培养基,B27添加剂,胎牛血清,购自Gibco公司;脂质体2000、抗磷酸化细胞外信号调节激酶(ERK)1/2抗体,购自Invitrogen公司;RT-PCR试剂盒,购自TAKARA公司;ERK特异性抑制剂PD98059,购自Promega公司;新生24 h内的Wistar大鼠(SPF级),由吉林大学动物室提供;重组载体pcDNA3.1-GFP-IGF由本实验室自行构建并保存。
1.2 方法
1.2.1 NSCs的分离 新生Wistar大鼠断颈处死后,无菌条件下取出脊柱,机械法分离细胞,用神经细胞培养液〔DMEM/F12为基础培养基,B27添加剂终浓度为1%,碱性成纤维细胞生长因子(bFGF)和重组人表皮生长因子(EGF)终浓度均为20 ng/ml〕调节细胞终浓度为2×105,接种到10 cm平皿,37℃、5%CO2培养箱中增殖培养。
1.2.2 转染IGF-1基因脊髓源性NSCs的建立 传代培养细胞接种于6孔培养板中,贴壁细胞达60% ~70%时,常规脂质体法转染重组质粒pcDNA3.1-GFP-IGF-1。转染后48 h,将细胞消化传代至10 cm平皿中,用含G418(600 μg/ml)的DF完全培养基进行筛选,含300 μg/ml G418的完全培养基维持培养。
1.2.3 IGF-1对NSCs ERK1/2蛋白磷酸化的影响 在荧光显微镜下观察转染后细胞绿色荧光蛋白(GFP)表达,以细胞开始表达时间点为0 h,按照0 h、0.5 h、1 h、2 h、4 h 时间点提取细胞蛋白质。Western印迹检测磷酸化ERK1/2蛋白表达,具体步骤如下:各时间点提取蛋白进行十二烷基硫酸钠-聚丙烯凝胶电泳(SDS-PAGE)并转印到聚偏氟乙烯(PVDF)膜上,依次加入抗磷酸化ERK1/2抗体和辣根过氧化物酶(HRP)标记的二抗,最后以二氨基联苯胺(DAB)显色。
1.2.4 ERK1/2特异性抑制剂PD98059对ERK1/2磷酸化的影响 将终浓度为0、5、10、20、40 μmol/L 的 ERK1/2 特异性抑制剂PD98059分别加入培养板中,与细胞共培养2 h,提取细胞蛋白质,利用Western印迹法检测ERK磷酸化的改变。方法同1.2.3。
1.2.5 IGF-1对转录因子c-fos、c-jun和c-myc表达的影响 以细胞开始表达IGF-1 时间点为0 h,按照0 h、0.5 h、1 h、2 h 时间点提取细胞RNA,并利用RT-PCR检测转录因子c-fos、c-jun和c-myc的表达。
1.2.6 ERK1/2特异性抑制剂 PD98059对转录因子c-fos、c-jun表达的影响 当细胞开始表达IGF-1时,向培养液中加入20 μmol/L 的 PD98059,共培养 1 h,提取细胞 RNA,利用 RTPCR检测转录因子c-fos、c-jun的表达。
2 结果
2.1 IGF-1对处于分化状态的NSCs ERK1/2磷酸化的影响 将IGF-1开始表达后的分化 NSCs,应用 Western印迹检测ERK1/2蛋白的磷酸化情况。随着时间的增加,NSCs中磷酸化的ERK1/2表达逐渐增高,2 h的时候增加最多,随后表达下降。见图1。
2.2 ERK1/2特异性抑制剂PD98059对ERK1/2磷酸化的影响 将终浓度为 0、5、10、20、40 μmol/L 的 ERK1/2 特异性抑制剂PD98059分别加入培养板中和细胞共培养2 h,提取细胞蛋白质,利用Western印迹检测ERK磷酸化的改变。PD98059抑制ERK磷酸化的程度随着浓度的增加而增加,但浓度增加到20 μmol/L之后,再增加浓度抑制作用也不再增强。见图2。

图1 不同时间段IGF-1对ERK磷酸化的影响

图2 ERK1/2特异性抑制剂PD98059对ERK1/2磷酸化的影响
2.3 RT-PCR检测转录因子c-fos、c-jun和c-myc的表达 应用RT-PCR检测IGF-1开始表达后0 h、0.5 h、1 h和2 h时即早转录因子c-fos、c-jun和c-myc基因在NSCs中的表达,结果表明c-fos、c-jun mRNA表达水平在0.5 h和1 h时开始明显增加,而c-myc mRNA水平在各时间点无明显差别。见图3。
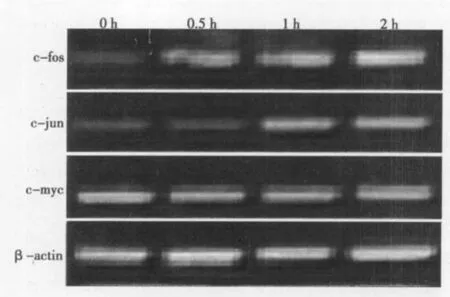
图3 IGF-1对NSCs的即早基因c-fos、c-jun、c-myc转录的影响

图4 ERK1/2特异性抑制剂PD98059对IGF-1诱导即早基因c-fos、c-jun转录的影响
2.4 ERK1/2特异性抑制剂PD98059对转录因子c-fos、c-jun表达的影响 应用RT-PCR检测IGF-1开始表达后,ERK1/2特异性抑制剂PD98059对转录因子c-fos、c-jun表达的影响。结果表明ERK1/2抑制剂PD98059可显著抑制IGF-1诱导的c-fos和c-jun mRNA表达。见图4。
3 讨论
近年的研究表明,少突胶质细胞是中枢神经系统的髓鞘形成细胞。髓鞘使神经元的轴突产生电绝缘,有利于神经元之间电信号的传导,少突胶质细胞和髓鞘的损伤必然导致中枢神经系统相应疾病,而少突胶质细胞移植到髓鞘缺陷或损伤的动物体内可形成新的髓鞘并促进轴突再生。因此,少突胶质细胞移植有望用来治疗脊髓损伤导致的脱髓鞘等中枢神经系统疾病。在前期实验研究中,已经证实了转染了IGF-1的NSCs可以分化成少突胶质细胞。由于ERK在细胞增殖、分化和存活中起重要调节作用〔6,7〕,本研究在诱导NSCs向少突胶质细胞分化的基础上,探讨了MEK、ERK及下游转录因子c-fos和c-jun等在IGF-1诱导NSCs向少突胶质细胞分化中的作用。
本实验应用Western印迹检测了IGF-1开始表达后的分化NSCs中ERK1/2蛋白磷酸化情况。结果可见,随着时间的增加,NSCs中磷酸化的ERK1/2表达逐渐增高;而ERK1/2特异性抑制剂PD98059可显著抑制ERK的磷酸化程度,表明在IGF-1表达开始后,影响生长、分化、增殖的信号与ERK信号传导通路有关联,NSCs向少突胶质细胞分化的过程需要ERK1/2信号途径的活化。
应用RT-PCR检测IGF-1开始表达后,ERK1/2特异性抑制剂PD98059对转录因子 c-fos、c-jun表达的影响。结果表明ERK1/2抑制剂 PD98059可显著抑制 IGF-1诱导的c-fos和c-jun mRNA表达。这些结果和前面ERK磷酸化的结果相结合,可以得出以下推论,NSCs转染IGF-1并开始表达IGF-1之后,IGF-1启动了ERK信号途径,随后将信号传递给即早基因c-fos、c-jun,然后 c-fos、c-jun 开始表达,最终导致了 NSCs分化为少突胶质细胞。
1 MacDonald SC,Simcoff R,Jordan LM,et al.A population of oligodendrocytes derived from multipotent neural precursor cells expresses a cholinergic phenotype in culture and responds to ciliary neurotrophic factor〔J〕.J Neurosci Res,2002;68(3):255-64.
2 Schechter R,Abboud M.Neuronal synthesized insulin roles on neural differentiation within fetal rat neuron cell cultures〔J〕.Brain Res Dev Brain Res,2001;127(1):41-9.
3 Arsenijevic Y,Weiss S.Insulin-like growth factor-1 is a differentiation factor for postmitotic CNS stem cell-derived neuronal precursors:distinct actions from those of brainderived neurotrophic factor〔J〕.J Neurosci,1998;18(6):2118-28.
4 Hsieh J,Aimone JB,Kaspar BK,et al.IGF-1 instructs multipotent adult neural progenitor cells to become oligodendrocytes〔J〕.J Cell Biol,2004;164:111-22.
5 Frederick TJ,Wood TL.IGF-1 and FGF-2 coordinately enhance cyclin D1 and cyclin E-cdk2 association and activity to promote G1 progression in oligodendrocyte progenitor cells〔J〕.Mol Cell Neurosci,2004;25(3):480-92.
6 Pan MR,Chang HC,Hung WC.Non-steriodal anti-inflammatory drugs suppress the ERK signaling pathway via block of Ras/c-Raf interaction and activation of MAP kinase phosphatases〔J〕.Cell Signal,2008;20(6):1134-41.
7 Korotayev K,Chausesepied M,Ginsber D.ERK activation is regulated by E2F1 and is essential for E2F1-induced S phase entry〔J〕.Cell Signal,2008;20(6):1221-6.
