苯磺酸氨氯地平抑制损伤诱导的血管新生内膜形成
2011-08-02苗穗兵付建然温进坤
刘 莎 韩 梅 郑 斌 苗穗兵 付建然 尉 坤 张 静 温进坤
(河北医科大学生物化学与分子生物学研究室 神经与血管生物学教育部重点实验室,河北 石家庄 050017)
经皮腔内冠状动脉血管成形术(PTCA)是临床治疗冠状动脉疾病的重要手段,但术后再狭窄的高发生率严重影响其远期疗效〔1〕。血管平滑肌细胞(VSMC)增殖并向内膜下迁移是血管再狭窄的主要病理基础。苯磺酸氨氯地平(AM)是具有高度血管选择性的钙离子拮抗剂,是临床治疗高血压的一线药物。研究表明,AM除具有良好的降压作用外,还具有许多L-型钙通道阻滞剂作用以外的生物学活性〔2〕。阿托伐他汀(AT)是临床上常用的降脂药,AT除具有强效降脂作用外,还具有不依赖于降脂的多效性作用。越来越多的证据显示,AM与AT联合用药可保护血管内皮。虽然联合应用AM及AT对于血管的协同保护效应已被逐步认可,但二者单独及联合用药是否影响球囊损伤诱导的血管新生内膜形成尚无定论。本研究从整体、细胞和分子水平上探讨AM、AT单独及联合用药对大鼠颈总动脉球囊损伤诱导的血管新生内膜形成的影响及作用机制。
1 材料与方法
1.1 材料 SD大鼠由河北省实验动物中心提供;抗体购自Santa Cruz公司;DMEM培养基及胎牛血清购自Gibco公司;主要实验仪器购自Leica公司及Pharmacia公司;AM(商品名:络活喜,批号95805043)及阿托伐他汀(商品名:立普妥,批号95837009)购自美国辉瑞公司;球囊导管本室自制。
1.2 方法
1.2.1 球囊损伤动物模型的复制及分组 实验动物用25%乌拉坦(3 ml/kg)腹腔注射麻醉,常规消毒,沿颈部正中线切开皮肤及皮下组织,于气管左侧分离肌肉层、颈总动脉、颈外动脉及颈内动脉。从颈外动脉远心端结扎,近心端备线,于近心端结扎颈内动脉。将颈总动脉近心端用血管夹关闭血流,于颈外动脉远心端扎线部位的内侧剪一楔形切口,球囊导管自切口处向近心端插入,打开血管夹,导管穿过颈总动脉至主动脉分支处。注入约20 μl生理盐水充盈球囊,然后将球囊拖回到切口处,其间以导丝为轴线旋转球囊。如此反复3次,退出球囊,关闭切口,恢复血流。
体重250~300 g的雄性SD大鼠随机分为5组,分别为假手术组(Sham,n=6)、损伤组(Injured,n=6)、AT 组(AT,n=6)、AM组(AM,n=6)、以及AT与AM联合用药组(AT+AM,n=6)。Sham组及Injured组:每日给予同治疗组等体积的蒸馏水灌胃。AT组:AT研碎,蒸馏水溶解后,10 mg·kg-1·d-1灌胃。AM 组:AM 研碎,蒸馏水溶解后,10 mg·kg-1·d-1灌胃。AT+AM 组:AM 及 AT 研碎溶解,各 10 mg·kg-1·d-1灌胃。用药组大鼠于术前1 d至术后14 d进行灌药,实验期间给予普通饲料饮食,自由进食进水,每日测量大鼠体重,并随时观察大鼠日常饮食、精神状态等一般情况。于术后14 d从股动脉放血处死动物,迅速分离左侧颈总动脉标本用于下述实验。
1.2.2 形态学分析 取左侧颈总动脉血管0.5 cm置于冷PBS中洗净残留血液,放入10%中性甲醛中固定至少24 h,乙醇梯度脱水,石蜡垂直定向包埋,4 μm厚度连续切片,HE染色后,镜下观察、照相,进行图像学分析并计算内膜/中膜(intima/media,I/M)厚度比。
1.2.3 免疫组织化学染色分析 标本经10%中性甲醛固定,常规梯度乙醇脱水,石蜡垂直定向包埋,4 μm厚度连续切片。免疫组织化学染色采用SP三步法,即:石蜡切片脱蜡至水,微波抗原修复,3%H2O2去离子水室温孵育10 min,PBS冲洗,山羊血清封闭液室温孵育15 min,倾去血清,滴加适当比例稀释的一抗,包括:兔抗PCNA多克隆抗体(1∶100)、兔抗KLF5多克隆抗体(1∶50)、兔抗 MMP-9多克隆抗体(1∶100),4 ℃过夜,PBS冲洗,生物素化二抗工作液,室温孵育15 min,PBS冲洗,滴加辣根酶标记链霉卵白素工作液,室温孵育15 min,PBS冲洗,滴加DAB试剂显色,显微镜下控制显色时间,自来水冲洗终止反应,苏木精复染,常规脱水、透明、封片。阴性对照用PBS替代一抗,其余步骤同上。显微镜下随机选取3个视野,计数PCNA、KLF5、MMP-9的阳性细胞数。实验结果判定:以细胞中出现棕褐色浓染颗粒作为判定阳性细胞的标准。
1.2.4 细胞培养与实验分组 选取80~100 g雄性SD大鼠,取胸腹主动脉,用贴块法分离、培养VSMC〔3〕。细胞在含10%FBS的低糖DMEM中培养,0.25%胰蛋白酶消化传代,取3~6代细胞进行实验。待细胞生长至80% ~90%融合,分别加入AM至终浓度5、10 ng/ml,继续孵育24 h,收集细胞及培养基用于下述实验。以含10%FBS低糖DMEM培养细胞为对照。
1.2.5 细胞总蛋白提取与Western印迹分析 收集各组细胞,冰浴裂解细胞,4℃ 8 000 r/min离心10 min,收集上清,即为细胞蛋白提取液,用改良Lowry法测定各组蛋白浓度后,-20℃储存备用。取等量各组蛋白提取液,与5×SDS上样缓冲液混合均匀,100℃沸水浴加热5 min使蛋白变性。自然冷却后,用微量加样器上样于凝胶加样孔内。SDS-聚丙烯酰胺凝胶电泳(90 V稳压电泳约30 min),待溴酚蓝进入分离胶后,换用120 V稳压电泳,至溴酚蓝前缘移动到凝胶底部,停止电泳。SDSPAGE完毕后,半干式电转膜(恒压20 V)。转膜完毕后将PVDF膜,置于含5%脱脂奶粉的TTBS封闭液中,37℃封闭2 h。一抗结合:将封闭后的PVDF膜置入TTBS适当稀释的一抗溶液中,4℃缓慢摇动过夜。二抗结合:将PVDF膜置入适量以TTBS 1∶104稀释的辣根过氧化物酶标记的二抗溶液中,室温反应2 h。洗膜后,用化学发光试剂盒检测PVDF膜上抗原抗体结合区带。信号强度用凝胶成像数码分析软件进行相对定量分析,密度扫描灰度值用IOD表示。
1.2.6 细胞计数分析 利用常规细胞计数方法进行分析〔4〕,细胞分组及处理条件同上。
1.2.7 伤口愈合实验 将VSMC接种于玻片上,细胞生长至完全融合后,取出玻片,进行划痕。PBS洗净被刮下的细胞后,将玻片置于含AM梯度浓度(5,10 ng/ml)的培养液中,继续孵育24 h后取出,固定后进行结晶紫染色,倒置显微镜下照相。任意取3个视野,计数迁移细胞数,以此表示细胞的迁移活性。1.2.8 明胶酶图分析 取各组VSMC的培养液与上样缓冲液混匀,上样于凝胶加样孔内。4℃条件下恒压(120 V)电泳2~2.5 h,至溴酚蓝前沿移动至凝胶底部约1 cm处时,停止电泳。凝胶经2.5%Triton X-100漂洗以去除凝胶中的SDS,使明胶酶复性;弃去漂洗液,加入反应缓冲液37℃ 温育9 h,使明胶酶充分水解凝胶中的明胶。弃去反应缓冲液,加入考马斯亮蓝染色液染色2~4 h;弃去染色液,加入脱色液脱色2~4 h,至蓝色背景下白色条带清晰为止。
1.3 统计学处理 上述实验均重复3次,取其均值,各组数据以±s表示。所有实验数据均采用SPSS13.0统计软件进行处理,均数比较采用t检验,多样本均数两两比较采用单因素方差分析。
2 结果
2.1 AM和AT抑制球囊损伤诱导的血管新生内膜形成 术后14 d,取大鼠左侧颈总动脉制备组织切片,经HE染色后,光镜下观察可见,Sham组颈总动脉壁各层结构完整,内膜光滑仅见单层内皮细胞,中膜VSMC排列整齐呈梭形,I/M厚度比值为0.17±0.10(图1)。Injured组血管中膜内VSMC排列紊乱,内膜呈弥散性增厚,管腔缩小,I/M厚度比值显著增大(3.40±0.17),与Sham组相比具有显著性差异(P<0.01)。AM组、AT+AM组的I/M厚度比值分别为1.86±0.26和0.58±0.23,与Injured组相比具有显著性差异(P<0.01),联合用药组的抑制效果更显著(P<0.01),而AT组的内膜增生程度与Injured组相比无明显差异,其I/M厚度比值为(3.16±0.22)。
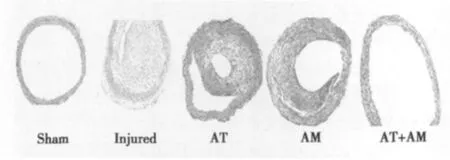
图1 各组I/M形态学观察(HE,×100)
2.2 AM和AT抑制球囊损伤诱导的PCNA、KLF5和MMP-9的表达 免疫组化结果显示,正常血管壁中偶见PCNA阳性细胞,Injured组PCNA阳性细胞数及单细胞染色强度较Sham组均显著增高,且主要分布在新生内膜层。与Injured组相比,AM组和AT+AM组中PCNA阳性细胞数分别减少了59.1%及73.4%(图2),具有显著性差异(P<0.01),且联合用药组的抑制效果大于AM单独用药组(P<0.01)。AM和AT对血管壁中KLF5及MMP-9表达的影响与PCNA相似,与Injured组相比,AM组和AT+AM组中,KLF5阳性的细胞数分别减少了57.9%及74.2%(图 2),MMP-9阳性细胞数分别减少了39.4% 和81.8%(图2)。提示,AM单独及与AT联合用药抑制球囊损伤诱导的血管新生内膜形成与抑制增殖相关蛋白PCNA、KLF5和迁移相关蛋白MMP-9表达有关。

图2 各组 PCNA、KLF-5、MMP-9表达
2.3 AM抑制体外培养的VSMC增殖活性 细胞计数结果显示,AM(5,10 ng/ml)处理VSMC 24 h后,血清诱导的细胞增殖活性降低,与对照组(0 ng/ml)相比,细胞数分别减少了30.8%及45.8%,具有显著性差异(P<0.05),且其增殖抑制作用具有浓度依赖关系。Western印迹结果显示,与对照组(0 ng/ml)相比,AM处理的VSMC中,PCNA水平分别降低了11.1%及28.3%,KLF5水平分别减少了16.3%及28.3%,c-Jun水平分别减少了22.5%及32.8%(图3)。AM对增殖相关蛋白表达的抑制效应具有浓度依赖性,与细胞计数结果一致。

图3 各组PCNA、KLF-5、c-Jun的水平
2.4 AM抑制体外培养的VSMC迁移活性 见图5。伤口愈合实验结果显示,不同浓度AM(5,10 ng/ml)处理VSMC 24 h后,血清诱导的VSMC迁移活性较对照组(0 ng/ml)分别降低了28.8% 和69.8%(图4),具有显著性差异(P<0.05)。明胶酶图分析结果显示,AM可浓度依赖性的降低MMP-2及MMP-9的胶原酶活性。AM对MMP活性的影响与细胞迁移活性变化相一致。

图4 AM抑制VSMC的迁移活性
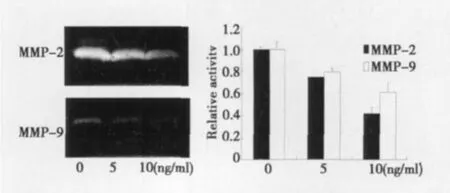
图5 AM对MMP活性的影响
3 讨论
PTCA是目前临床治疗冠状动脉疾病的重要手段,流行病学调查发现,PTCA术后3~6个月内,原扩张部位的再狭窄率高达32% ~57%,严重限制了其远期临床疗效〔1〕。PTCA术后再狭窄的发生大致分为3个主要阶段:①血管内皮损伤后VSMC发生表型转换,由收缩型转变为合成型,获得增殖能力,合成并分泌大量细胞外基质;②中膜VSMC大量增殖并向内膜下迁移;③损伤部位增殖的VSMC和沉积的细胞外基质共同形成血管新生内膜,并向管腔突起,最终导致管腔狭窄〔5〕。
AM是目前循证证据最多、应用最广的降压药之一,AM除具有良好的降压作用外,还具有许多L-型钙通道阻滞以外的血管生物学活性〔2〕,如促进 NO 生成、改善内皮功能〔6〕、抗动脉粥样硬化〔7〕等。AT除具有强效降脂作用外,还具有不依赖于降脂的多效性作用,如诱导人和大鼠血管平滑肌细胞凋亡〔8〕及保护血管内皮〔9〕等。越来越多的证据显示,AM及AT对血管具有协同保护作用。本实验以SD大鼠为研究对象,通过大鼠颈动脉球囊剥脱模型,观察到二者具有协同抑制球囊损伤诱导的血管新生内膜形成的作用。
为探讨AM及AT抑制球囊损伤诱导的血管新生内膜形成的分子机制,本实验进一步检测了增殖相关蛋白PCNA、KLF5及迁移相关蛋白MMP-9的表达变化。PCNA在DNA复制及核苷酸切除修复过程中发挥重要作用,其表达水平与细胞增殖活性密切相关,PCNA表达水平的高低可作为评价细胞增殖状态的可靠指标〔10〕。KLF5是KLF家族中的一个成员,是一个重要的生长促进基因和分化抑制基因〔11〕,且在血管损伤后的重构过程中发挥关键作用。基质金属蛋白酶(MMPs)是体内较为重要的一类蛋白水解酶,在基质重构及VSMC迁移过程中发挥重要作用〔12〕。免疫组织化学染色结果显示,AM单独及与AT联合用药均使PCNA、KLF5及MMP-9阳性细胞数量明显减少。提示,二者抑制球囊损伤诱导的血管新生内膜形成与抑制VSMC增殖及迁移活性有关。
为进一步探讨AM抑制新生内膜形成的机制,笔者又在细胞及分子水平进行了研究。细胞计数结果显示,AM浓度依赖性抑制血清诱导的VSMC增殖活性;Western印迹结果发现,AM处理的VSMC中,增殖相关蛋白PCNA、KLF5及c-Jun表达水平浓度依赖性降低。提示AM具有抑制细胞增殖的作用,与免疫组织化学染色结果相一致。伤口愈合实验发现,AM以浓度依赖方式抑制VSMC迁移活性;同时,明胶酶图分析显示,同样条件处理的VSMC,其MMP-2及MMP-9的活性降低,作用具有浓度依赖性。由此可推断,AM抑制VSMC的增殖、迁移活性可能是其抑制球囊损伤诱导的血管新生内膜形成的机制。
1 Bennett MR,Schwartz SM.Antisense therapy for angioplasty restenosis:Some critical considerations〔J〕.Circulation,1995;92(7):1981-93.
2 Zanchetti A,Bond MG,Hennig M,et al.Calcium antagonist lacidipine slows down progression of asymptomatic carotid atherosclerosis:principal results of the European Lacidipine Study on Atherosclerosis(ELSA),a randomized,double-blind,long-term trial〔J〕.Circulation,2002;106(19):2422-7.
3 Ramos K,Cox LR.Primary cultures of rat aortic endothelial and smooth muscle cells:Ⅰ.An in vitro model to study xenobiotic-induced vascular cytotoxicity〔J〕.In Vitro Cell Dev Biol,1987;23(4):288-96.
4 Bishop BD,Hla T,Warner TD.Intimal smooth muscle cells as a target for peroxisome proliferator-activated receptor-gamma ligand therapy〔J〕.Circ Res,2002;91(3):210-7.
5 杨淑丽,韩 梅,温进坤.骨桥蛋白与心血管疾病〔J〕.中国动脉硬化杂志,2000;8(4):371-3.
6 Batova S,de Wever J,Godfraind T,et al.The calcium channel blocker amlodipine promotes the unclamping of eNOS from caveolin in endothelial cells〔J〕.Cardiovasc Res,2006;71(3):478-85.
7 胡大一.氨氯地平降血压抗冠状动脉粥样硬化的新证据〔J〕.高血压杂志,2005;13(5):259-61.
8 Guijarro C,Blanco-Colio LM,Massy ZA,et al.Lipophilic statins induce apopotosis of human vascular smooth muscle cells〔J〕.Kidney Int Suppl,1999;7:S88-91.
9 崔 燕,邱 丽,谢春毅,等.阿托伐他汀对球囊损伤后大鼠的血管保护作用〔J〕.中国临床医学,2006;13(2):170-2.
10 Pasquale M,Gianluca G,Paola DM,et al.Neutralization of interleukin-18 inhibits neointimal formation in a rat model of vascular injury〔J〕.Circulation,2006;114(5):430-7.
11 Haldar SM,Ibrahim OA,Jain MK.Krüppel-like factors(KLFs)in muscle biology〔J〕.Mol Cell Cardiol,2007;43(1):1-10.
12 Lehoux S,Lemarie CA,Esposito B,et al.Pressure-induced matrix metalloproteinase-9 contributes to early hypertensive remodeling〔J〕.Circulation,2004;109(8):1041-7.
