激光多普勒血流仪动态观察镁对脑缺血再灌注损伤保护作用
2011-08-02吉训明NINGMingming王晓英
刘 宇,孟 然,,△,吉训明,NING Ming-ming,王晓英
(1北京大学第九临床医学院,首都医科大学附属北京世纪坛医院神经内科,北京 100038;2首都医科大学附属宣武医院脑血管病研究所,神经变性疾病教育部重点实验室,北京100053;3Department of Neurology,Massachusetts General Hospital,Harvard Medical School,Boston,Massachusetts 02114,USA)
研究表明多种神经保护措施可在一定程度上阻断或弱化急性缺血性脑卒中缺血瀑布的不同环节,抑制钙超载,减少神经细胞凋亡,逆转半暗带,提高神经元对缺血的耐受力,为溶栓治疗争得时间,并最终减少梗死体积[1,2]。镁离子是钙离子的天然拮抗剂,能够阻断由钙超载引起的细胞损伤途径,从而保护细胞线粒体的结构和功能、降低血脑屏障通透性、减轻脑水肿、缩小梗死体积[1,2]。病理学研究显示硫酸镁能缩小脑梗死体积,是一种有效的神经保护剂[3,4],但其机制仍不完全清楚。本研究应用激光多普勒血流仪(laser Doppler flowmetry,LDF)对局灶性大脑中动脉阻塞的急性脑梗死大鼠模型(middle cerebral artery occlusion,MCAO)不同时点给予硫酸镁处理后,缺血/再灌注损伤过程中的脑血流变化特点进行实时动态监测与分析,旨在观察缺血早期给予硫酸镁对血管神经单元的保护作用及再灌注后对血管功能的影响,进一步探讨其可能的脑保护机制。
材料和方法
1 材料
1.1 药品与试剂 四氮唑红(TTC,伊瑞德生物技术公司)、10%水合氯醛(首都医科大学宣武医院)、硫酸镁注射液(杭州民生药业集团有限公司)。
1.2 主要仪器与设备 激光多普勒血流监测仪(PERIMED,PF5001型)、手术显微镜(Carl Zeiss)、线栓(北京沙东技术有限公司,型号2838-A)、电凝刀(Devel Acc 100)。
1.3 动物 SPF级Sprague Dawley(SD)雄性大鼠,体重280-300 g,由维通利华实验动物有限公司提供,动物许可证:SCXK(京)2006-0009。
2 方法
2.1 动物分组 将24只大鼠随机分为对照组和硫酸镁处理组,再根据给药时不同将硫酸镁处理组分为插栓后20 min给药组,30 min给药组,40 min给药组,给予25%MgSO4以160 mg/kg剂量腹腔注射;对照组在相同时间点给予等体积生理盐水腹腔注射。每组6只大鼠,如有意外死亡的情况发生,随机选取大鼠将每组补足6只。对照组和硫酸镁处理各组大鼠均经历2 h缺血随后24 h再灌注。
2.2 MCAO模型制作 大鼠称重后,用10%水合氯醛350 mg/kg,腹腔注射麻醉。参照改良 Longa法[5]制作 MCAO模型。颈部备皮,正中剪皮开口,钝性分离腺体和筋膜,术中小心分离右侧颈总动脉 (common carotid artery,CCA),颈外动脉(external carotid artery,ECA),电凝ECA上的2个小分支,将ECA近头端结扎并剪断,近心端紧贴分叉处穿线打松结,于CCA和颈内动脉(internal carotid artery,ICA)上各置一动脉夹,然后用显微剪在ECA游离端剪一小口,将线栓由此插入动脉,去除ICA上的动脉夹,将线栓慢慢插入ICA,当线栓进入距ICA和ECA分叉处约18-19 mm有阻挡感时停止插栓,将松结结扎,去除CCA上的动脉夹,缝合皮肤。缺血2 h,拔除栓子,再灌注24 h。
2.3 脑血流监测 大鼠俯卧,头部备皮,矢状位剪开额顶部皮肤2 cm,暴露皮下筋膜,用浸满双氧水的棉签摩擦暴露的筋膜,直至暴露出颅骨前囟及右侧半颅骨,应用立体定位仪以前囟为起点向右5 mm,向后3 mm,在该处用牙科钻打孔,至穿透颅骨但未打破硬脑膜为宜[6]。将激光多普勒血流监测仪探头固定于孔上,开始记录右侧大脑中动脉供血区域血流变化值,当所示数值平稳,开始制作MCAO模型。动物入组标准为血流量下降至基线值的30%左右。
2.4 药物干预 实验组:MgSO4组于插栓缺血后20 min、30 min、40 min,分别给予25%MgSO4注射液160 mg/kg腹腔注射。对照组:每只大鼠在相应时点(每个时点包括2只大鼠)给予等体积生理盐水腹腔注射。
2.5 神经功能缺损评价 于缺血2 h再灌注24 h后进行,参照Belayev等[7-10]12分评分法。(1)提尾悬空试验:无明显神经功能缺失为0分,梗死对侧肢体屈曲为1分,梗死对侧肢体外展为2分。(2)肢体放置试验:ⓐ视觉试验(前方):实验者将动物握于手中,使其前爪悬空,自桌面斜上方向桌面缓慢靠近,此时桌子位于大鼠前方,正常大鼠反应为前肢即刻抓向桌面,损伤大鼠则表现为肢体反应延迟。正常为0分;反应延迟但不超过2 s为1分;反应延迟且超过2 s为2分。ⓑ视觉试验(侧方),此时桌子位于动物侧方,其余实验方法及评分标准同前。ⓒ触觉试验(前方),将动物双眼遮住,并使其前爪悬空,此时大鼠应该既看不见,也不能用胡须触及桌面,用其前爪背侧轻触桌面,刺激深度仅达到皮肤和毛发。动物反应及评分同视觉实验。ⓓ触觉试验(侧方)评分同前。ⓔ本体觉试验,按压动物前爪,刺激深达肌肉及关节,评分同前。
2.6 脑梗死体积测量[11]大鼠MCAO缺血2 h再灌注24 h后断头取脑(每组2只),将鼠脑放在连续模具内进行冠状等距切片,片厚约2 mm,共切6片,用2,3,5-氯化三苯基氯化四唑(2,3,5-triphenyl-2H-tetrazolium chloride,TTC)染色,摄片。使用Image-Pro Plus Analysis Software计算机图像分析系统计算脑梗死体积。梗死体积百分率=(正常侧大脑半球体积-梗塞侧非梗塞区脑组织体积)/正常侧大脑半球体积×100%。
3 统计学处理
采用SPSS 13.0统计软件,计量资料用均数±标准差()表示,t检验,组间比较采用方差分析和 LSD-t检验。
结 果
1 脑血流变化
如图1A所示:对照组脑血流于再灌注开始即刻恢复至基线水平,整个再灌注阶段血流不稳,呈现与心脏射血相应的搏动状态。而图1B-D显示,硫酸镁组的脑血流在再灌注开始时也立即出现,但是在再灌注全程中,脑血流呈现缓慢恢复趋势,最终接近基线水平。如图1E、F分别显示了40 min给硫酸镁治疗组和对照组的全程脑血流变化情况。表1、图1E、F显示了缺血40 min硫酸镁组处理组和对照组在缺血/再灌注全程的局部脑血流动态变化,各时点的比较均有明显差异。
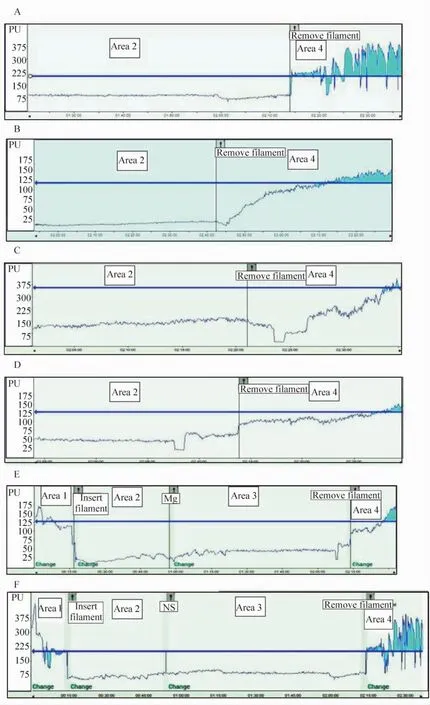
Figure1.Fluctuation of cerebral blood flow(CBF)in MCAO model.A:control;B:MgSO4treatment after 20 min ischemia;C:Mg-SO4treatment after 30 min ischemia;D:MgSO4treatment after 40 min ischemia;E:the whole ischemia/reperfusion process in MCAO model treated with MgSO4;F:the whole ischemia/reperfusion process in MCAO model without MgSO4treatment.Horizontal axis:time(minute);vertical axis:the relative value of CBF(PU);blue line:baseline;area 1:baseline CBF;area 2:CBF after filament inserted;area 3:CBF after MgSO4(Mg)or normal saline(NS)injection;area 4:restore CBF after filament removed.图1 大脑中动脉阻塞缺血模型缺血2 h再灌注24 h的脑血流变化
表1 硫酸镁处理组和对照组在不同时点平均脑血流量的动态变化Table1.Fluctuation of average local cerebral blood flow in MgSO4treatment group and control()
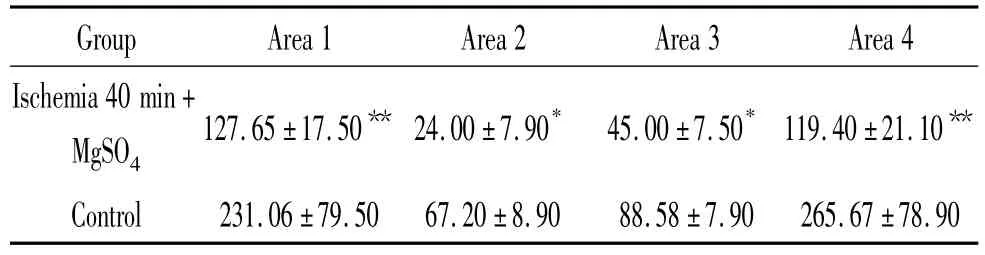
表1 硫酸镁处理组和对照组在不同时点平均脑血流量的动态变化Table1.Fluctuation of average local cerebral blood flow in MgSO4treatment group and control()
*P <0.05,**P <0.01 vs control group.
Group Area 1 Area 2 Area 3 Area 4 Ischemia 40 min+MgSO4 127.65±17.50** 24.00±7.90* 45.00±7.50* 119.40±21.10**265.67±78.90 Control 231.06±79.50 67.20±8.90 88.58±7.90
2 脑梗死体积及脑神经功能评分
硫酸镁干预的3组的梗死体积(26.5%、36.5%和24.5%)明显小于对照组的梗死体积(54%)。硫酸镁组的神经功能缺损评分(5.670±1.003,8.670±1.211,7.170±1.472)明显低于对照组(11.170±0.983)(P<0.01),硫酸镁组与对照组比较差异显著,见图2、表2。
表2 缺血2 h后再灌注24 h大鼠脑梗死平均体积及神经功能缺损评分Table2.The average volume of cerebral infarction and the scores of neurological impairment after 2 h ischemia followed with 24 h of continuous reperfusion(.n=6)

表2 缺血2 h后再灌注24 h大鼠脑梗死平均体积及神经功能缺损评分Table2.The average volume of cerebral infarction and the scores of neurological impairment after 2 h ischemia followed with 24 h of continuous reperfusion(.n=6)
*P <0.05,**P <0.01 vs control group.
Group Infarction volume(%)Nervous score Ischemia 20 min+MgSO4 26.5 ±1.3** 5.670 ±1.003**Ischemia 30 min+MgSO4 36.5 ±1.3** 8.670 ±1.211*Ischemia 40 min+MgSO4 24.5 ±2.1** 7.170 ±1.472**Control 54.0 ±7.3**11.170±0.983
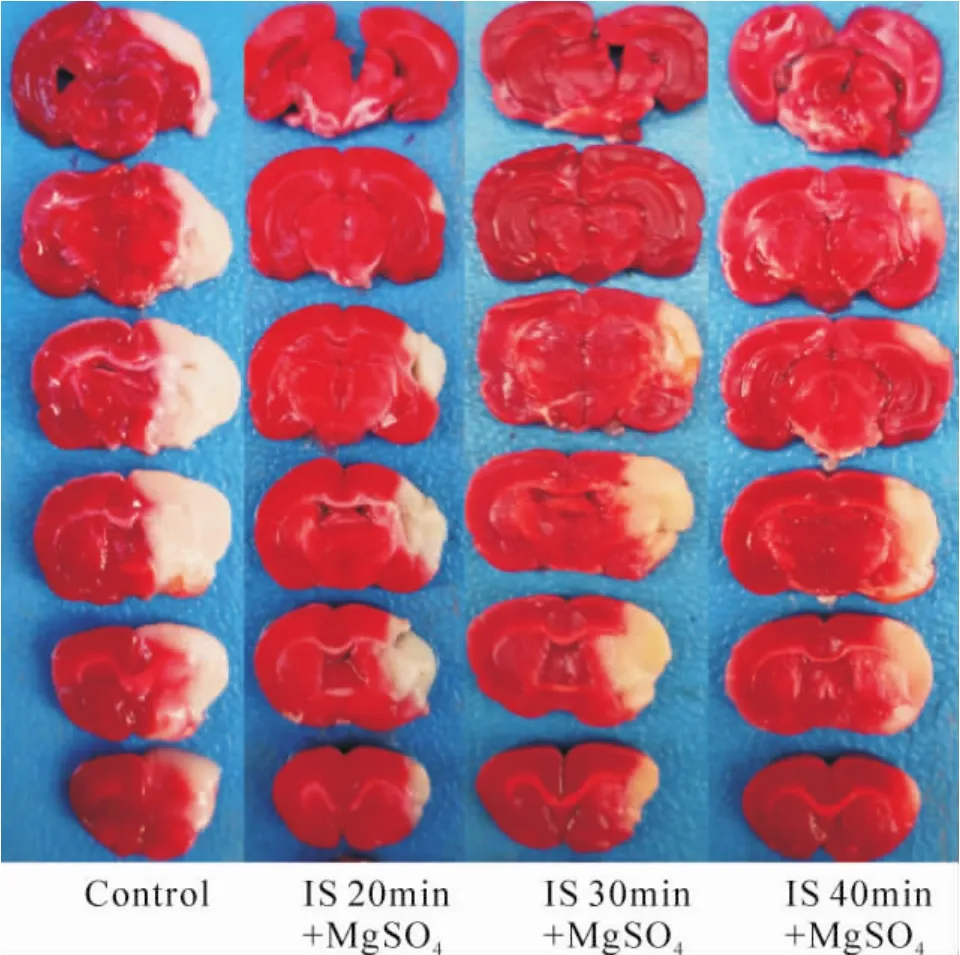
Figure2.Brain slices with TTC staining.IS:ischemia.图2 TTC染色脑片
讨 论
自我保护机制是脑血管区别于其他器官血管的特征之一。当动脉血压(arterial blood pressure,ABP)和脑灌注压(cerebral perfusion pressure,CPP)在一定范围内波动时,脑血管能够自动调节,使脑血流量(cerebral blood flow,CBF)在一定范围内保持相对稳定,这是脑血管的自动调节功能(cerebrolvascular autoregulation,CVA)[12-21]。长时间的缺血可以损害脑血管的自动调节功能,导致灌注恢复时发生脑水肿甚至脑出血等“灌注压突破”现象。在急性缺血性卒中时CVA是否健全关系到能否维持脑血流量的稳定并保护脑组织,减轻再灌注损伤,因此对其进行评价非常必要。激光多普勒脑血流仪是一种连续、实时、微创和敏感的微循环血流监测技术,它不仅适用于皮肤微循环的血流监测和神经外科手术中局部脑血流量(regional cerebral blood flow,rCBF)的监测,近年来它更是应用于需要测定rCBF的基础实验研究中[6]。本研究用LDF监测动物模型的局部脑血流变化。
本研究使用的激光多普勒测速法,能反映微血管内血流的速度,由于微血管的管径是不稳定的,所以当PU值降低时可能反映两种情况,一是脑血管发生痉挛(血管管径减小),二是测量点血流量减少(脑组织灌注降低)。在本实验中发现,硫酸镁对缺血2 h后予以再灌注的大鼠,具有明显脑血管自动调节功能的保护作用,减轻了拔栓模拟的缺血后血管再通导致的过度灌注损伤,最终有效减少了脑梗死体积,从而起到了脑保护作用。如图1 A所示,我们截取了MCAO模型血流监测期拔栓前1 h及拔栓后20 min的图片,MCAO大鼠在未给镁保护的对照组,梗塞2 h后拔除栓子重建血流时,脑血流量即刻恢复至基线水平,再灌注5 min后,血流速度变化表现为明显的与心脏射血节奏一致的大幅度波动,血管自动调节功能丧失,这种不稳定灌注状态导致因过度灌注继发的脑水肿,梗死面积扩大,甚至致死性的脑出血。因此再灌注期脑血管自动调节功能的维持至关重要。如图1 B所示,截取了MCAO模型血流监测期拔栓前20 min及拔栓后15 min的图片。给予硫酸镁保护的大鼠,当拔除栓子,即刻血流并没有恢复至基线血流,而是较拔栓前血流升高了1倍,是基线血流的70%左右,并且稳定维持这种灌注状态约10 min之后血流开始逐渐升高,经历了5 min左右逐渐恢复至基线水平,且灌注状态稳定,没有明显波动,这说明此时脑血管的自动调节功能功能尚存。
以上的研究仍有不足之处,我们设置了3个给药时点,希望观察到什么时间之内给药是有效的,但依据脑血流图结果显示,3个时点均有相似的血管保护功能,可以解释为我们设置的时点过于紧凑,没能很好的鉴别药物干预失效的时间阈值。但不同给药时点脑梗死体积有差异,尚无法解释,未来需要进一步明确硫酸镁对于脑血管自动调节功能保护作用的机制,以及在什么时间段内给予硫酸镁治疗能获得最大的收益。
[1]del Zoppo GJ.Stroke and neurovascular protection[J].N Engl J Med,2006,354(3):553-555.
[2]陈 萍,陈立云,王拥军.缺血性卒中的神经血管单元保护研究进展[J].中国卒中杂志,2007,2(12):1003-1007.
[3]Altura BM,Altura BT.Association of alcohol in brain injury,headaches,and stroke with brain-tissue and serum levels of ionized magnesium:a review of recent findings and mechanisms of action [J].Alcohol,1999,19(2):119-130.
[4]Muir KW.Therapeutic potential of magnesium in the treatment of acute stroke[J].J Stroke Cerebrovasc Dis,2000,9(6):257-267.
[5]Zea Longa EZ,Weinstein PR,Carison S,et al.Reversible middle cerebral artery occlusion without cranieetomy in rats[J].Stroke,1989,20(1):84-91.
[6]Schmid-Elsaesser R,Zausinger S,Hungerhuber E,et al.A critical reevaluation of the intraluminal thread model of focal cerebral ischemia:evidence of inadvertent premature reperfusion and subarachnoid hemorrhage in rats by laser-Doppler flowmetry [J].Stroke,1998,29(10):2162-2170.
[7]朱榆红,吉训明,李春艳,等.缺血后适应对大鼠脑缺血/再灌注损伤的影响[J].中国病理生理杂志,2008,24(11):2151-2155.
[8]Belayev L,Ofelia FA,Raul B,et al.Middle cerebral artery occlusion in the rat by intraluminal suture:neurological and pathological evaluation of an improved model[J].Stroke,1996,27(9):1616-1623.
[9]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination [J].Stroke,1986,17(3):472-476.
[10]De Ryck M,Van Reempts J,Borgers M,et al.Photochemical stroke model:flunarizine prevents sensorimotor deficits after neocortical infarcts in rats[J].Stroke,1989,20(10):1383-1390.
[11]Lin TN,He YY,Wu G.Effect of brain edema on infarct volume in a focal cerebral isehemia model in rats[J].Stroke,1993,24(1):117-121.
[12]Zonta M,Angulo MC,Gobbo S,et al.Neuron-toastrocyte signaling is central to the dynamic control of brain microcirculation [J].Nat Neurosci,2003,6(5):43-50.
[13]Zwagerman N,Sprague S,Davis MD,et al.Pre-ischemic exercise preserves cerebral blood flow during reperfusion in stroke[J].Neurol Res,2010,32(5):523-529.
[14]Zweifel C,Czosnyka M,Lavinio A,et al.A comparison study of cerebral autoregulation assessed with transcranial Doppler and cortical laser Doppler flowmetry [J].Neurol Res,2010,32(4):425-428.
[15]Livnat A,Barbiro-Michaely E,Mayevsky A.Mitochondrial function and cerebral blood flow variable responses to middle cerebral artery occlusion [J].J Neurosci Methods,2010,188(1):76-82.
[16]Hoyte LC,Papadakis M,Barber PA,et al.Improved regional cerebral blood flow is important for the protection seen in a mouse model of late phase ischemic preconditioning[J].Brain Res,2006,1121(1):231-237.
[17]Harada H,Wang Y,Mishima Y,et al.A novel method of detecting rCBF with laser-Doppler flowmetry without cranial window through the skull for a MCAO rat model[J].Brain Res Protocols,2005,14(3):165-170.
[18]Schöller K,Zausinger S,Baethmann A,et al.Neuroprotection in ischemic stroke-combination drug therapy and mild hypothermia in a rat model of permanent focal cerebral ischemia[J].Brain Res,2004,1023(2):272-278.
[19]Kim T,Masamoto K,Fukuda M,et al.Frequency-dependent neural activity,CBF,and BOLD fMRI to somatosensory stimuli in isoflurane-anesthetized rats[J].NeuroImage,2010,52(1):224-233.
[20]刘 宇,孟 然,闫 峰,等.激光多普勒血流仪评价活体大鼠大脑中动脉栓塞模型成功的可行性分析[J].中国病理生理杂志,2011,27(3):620-624.
[21]刘 宇,孟 然.离子通道与脑缺血-再灌注损伤关系的研究进展[J].中国脑血管病杂志,2009,6(10):553-557.
