慢性乙肝患者外周血CD4 + CD25 + FOXP3 +Tregs 及HBV 抗原特异性CTLs 的检测和分析*
2011-12-23王湘郴罗国辉吴正林
庄 鹏, 王湘郴, 罗国辉, 何 英, 吴正林
(深圳市第四人民医院感染科,广东 深圳518033)
CD4+CD25+FOXP3+是调节性T 细胞(regulatory T cells,Tregs)公认的鉴别标记,Treg 可通过与T细胞的相互作用发挥免疫调节机制[1]。HBV 感染后机体不充分的特异性细胞毒性T 淋巴细胞(cytotoxic T-lymphocytes,CTLs)应答不仅不能清除病毒,反而可通过介导非特异性T 细胞应答导致肝脏损伤[2]。为进一步探讨Treg 在乙型肝炎发病中的作用,本研究采用“一步法”流式检测Treg 细胞技术对慢性乙型肝炎(chronic hepatitis B,CHB)患者外周血中CD4+CD25+FOXP3+Treg 细胞的频率特点进行了观察,同时使用酶联免疫斑点方法对CHB 患者HBV 抗原特异性CTLs 的表达进行了检测,现报道如下。
材 料 和 方 法
1 资料
1.1 研究对象 选择28 例在我院感染科门诊就诊的HBeAg 阳性且未应用过核苷类似物治疗的CHB患者,诊断符合《慢性乙型肝炎防治指南》标准。其中男性17 例,女性11 例。年龄16 - 58 岁,平均(35.56 ±14.78)岁。另选取健康对照组15 例,其中男性10 例,女性5 例,年龄18 -65 岁,平均(37.52 ±14.25)岁,均无肝炎病史,肝炎病原学血清标志物检测均阴性,肝功能均正常。
1.2 入选标准 观察组筛选前HBsAg 阳性至少6个月,筛选时血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)水平升高(≥2 -10 倍正常上限,upper limits of normal,ULN);定量测定血清HBV DNA 水平≥108copies/L。所有病例均排除合并肿瘤、自身免疫性疾病、酒精性肝病、药物性肝炎、遗传性肝病及丙型肝炎病毒(hepatits C virus,HCV)、丁型肝炎病毒(hepatits D virus,HDV)、人免疫缺陷病毒(human immunodeficiency virus,HIV)混合感染等,也未经任何抗病毒或免疫调节药物治疗。
1.3 主要试剂和仪器 One Step Staining Human Treg FlowTMKit (FOXP3 Alexa Fluor® 488/CD25 PE/CD4 PerCP,Biolegend);HBV ELISPOT Kit、EZ - Sep人淋巴细胞分离管、Lympho - SpotTM无血清培养基(达科为公司);Cell Staining Buffer (FBS,Biolegend);HBV DNA 试剂盒(深圳匹基生物工程有限公司),流式细胞仪(BD)。
2 方法
2.1 外周血单个核细胞的分离采集与计数 取5 mL新鲜外周血(肝素抗凝)加入分离管,放入离心机。25 ℃、800 ×g 离心10 min。用吸管将含外周血单个核细胞液体层转移到无菌15 mL 尖底离心管,加入10 mL Lympho - SpotTM无血清培养基,25 ℃、250 × g 离心10 min。弃上液,将细胞沉淀重悬于1 mL Lympho -SpotTM无血清培养液,计数。根据计数结果用Lympho-SpotTM无血清培养液调节细胞浓度为2.5 ×109/L。
2.2 “一步法”流式检测调节性T 细胞 准备破膜剂及缓冲液。在每管中加入100 μL 准备好的细胞悬液(约106细胞),每管加入1 mL 1 × BioLegend's FOXP3 Fix/Perm 液,漩涡混匀后室温孵育20 min。离心后弃去上清。加入2 mL cell staining buffer,250×g 离心5 min 后弃去上清。用1 mL FOXP3 Perm buffer(1 ×)洗涤细胞1 次。用1 mL FOXP3 Perm buffer(1 ×)重悬细胞,室温孵育15 min,离心后弃去上清,加入20 μL 抗体cocktail,对照管加入20 μL 同型对照cocktail;轻轻漩涡重悬细胞。室温避光孵育30 min。用staining buffer 洗涤细胞2 次,最后用0.5 mL staining buffer 重悬上机检测。
2.3 酶联免疫斑点法检测乙肝病毒特异性T 淋巴细胞 按试剂盒操作说明,实验孔4 孔,每孔加入200 μL Lympho-SpotTM无血清培养基,室温静置5 -10 min,倾倒。每孔加入细胞100 μL,阴性对照孔加入10 μL Lympho-SpotTM无血清培养基,阳性对照孔加入10 μL PHA。HBV 抗原刺激孔每孔加入10 μL HBV 特异性抗原,37 ℃、5%CO2培养箱培养16 -20 h。洗板,每孔加入100 μL 稀释好的生物素标记的抗体,37 ℃、孵育1 h。洗板后每孔加入100 μL 的显色液,室温避光静置25 min。待斑点生长到适合的大小之后,终止显色过程,ELISPOT 板斑点计数,并记录斑点的各种参数,做统计分析。
2.4 其它观察指标 实时荧光PCR 方法扩增CHB患者HBV DNA,同时检测HBV 血清学指标以及ALT,HBV DNA 检测下限为≤5 ×105copies/L。
3 统计学处理
临床数据采用SPSS 11.5 统计学软件进行分析处理,计量资料采用t 检验,计数资料采用χ2检验,相关分析采用Pearson 相关检验。
结 果
1 CHB 患者和健康对照者临床指标及CD4+CD25+FOXP3+ Treg 细胞的表达水平检测
与健康对照组相比,CHB 患者外周血中CD4+CD25+FOXP3+Treg 表达明显增加,差异显著(P <0.05),见表1。流式细胞仪检测情况见图1A、B。
表1 CHB 患者和健康对照者临床指标和CD4 + CD25 +FOXP3 +Treg 细胞的表达检测Table 1. The detection of clinical index and CD4 + CD25 +FOXP3 +Tregs in two groups(±s)
* P <0.05 vs control group.
Group n HBV DNA 106copies/L ALT(U/L)CD4 +CD25 +FOXP3 +Tregs(%.97 Health control 15 0 22.7± 8.5 1.95±0.68 CHB patient 28 6.892±0.974 195.8±84.6 3.14±0*)
2 CHB 患者外周血中CD4+CD25+FOXP3+Treg细胞的表达水平与病毒载量的相关性分析
相关分析发现CHB 患者外周血中Treg 频率与血清HBV DNA 取对数后呈正相关(r = 0.831,P <0.01),见图3A。而与ALT 水平无明显相关性(P >0.05)。
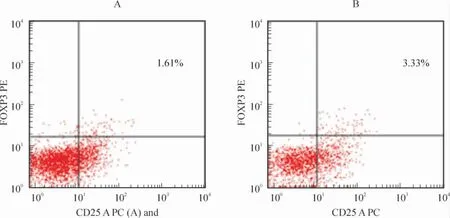
Figure 1. Treg frequencies in one health control (A)and one CHB patient(B).图1 健康对照A 和CHB 患者组外周血中Treg 频率示例
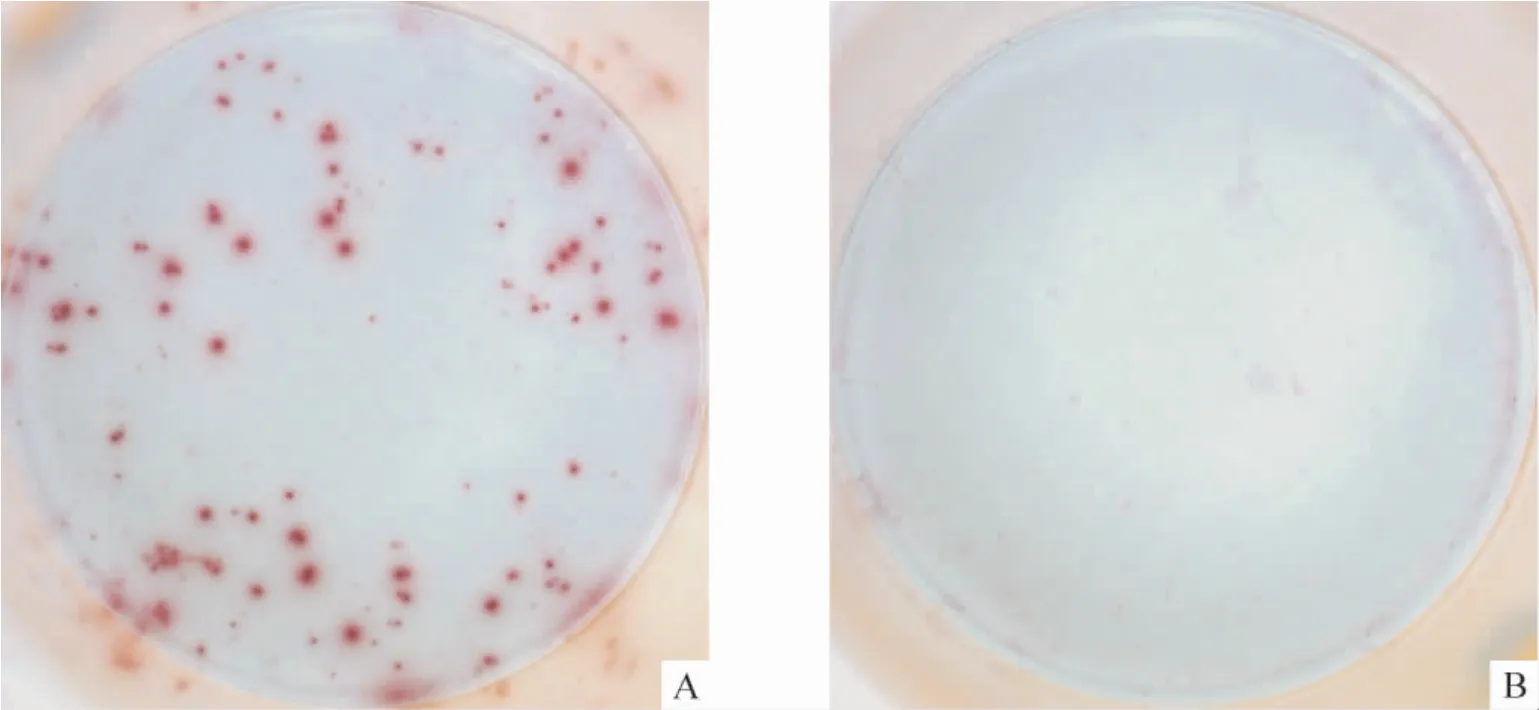
Figure 2. The results of ELISPOT assay for CTL counting in one CHB patient(A)and one healthy control(B).图2 CHB 患者和健康对照CTL 斑点计数检测孔示例
3 HBV 特异的细胞毒性T 淋巴细胞斑点计数观察及与Treg 频率的相关性分析
通过对斑点进行计数,健康对照组检测呈阴性,CHB 组CTL 斑点数目为阳性(19.28 ±3.85),见图2A、B;CTL 数目与Treg 频率的相关性分析,显示两者呈负相关(r= -0.540,P <0.01),见图3B。
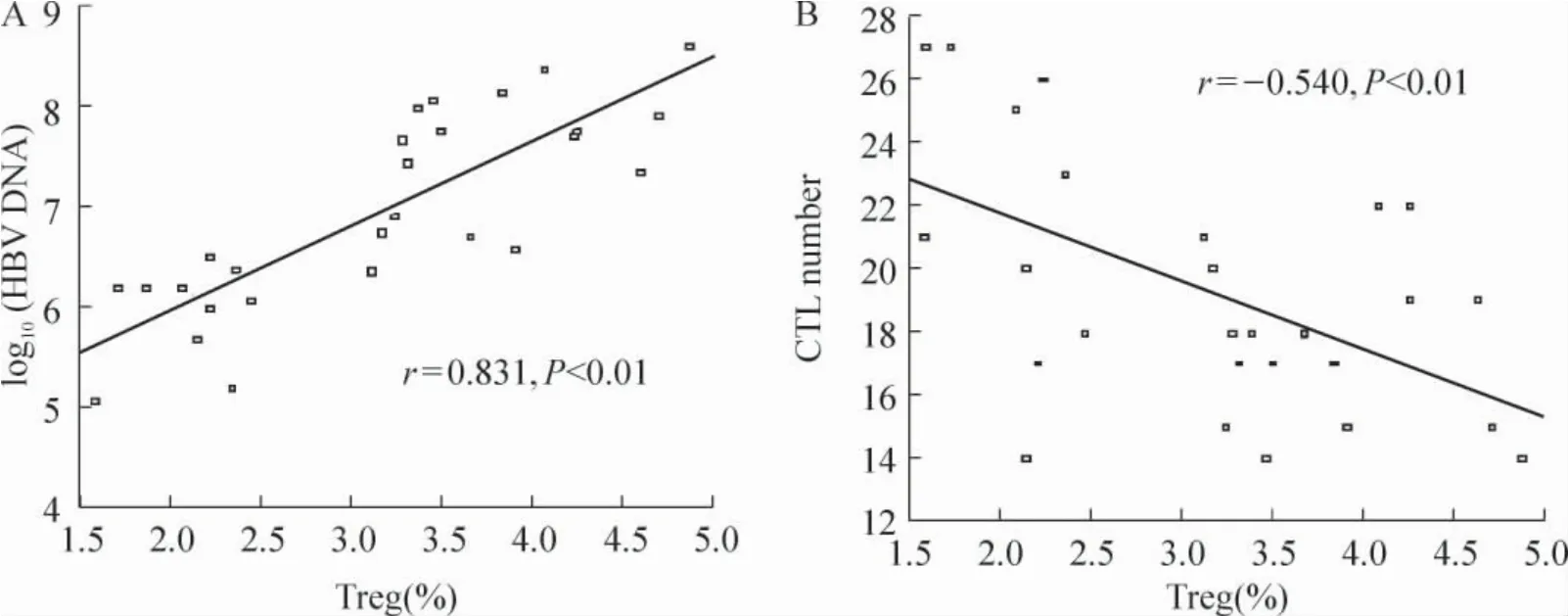
Figure 3. Correlation analysis between Treg frequency and HBV DNA levels in CHB patients(A)and between Treg frequency and HBV-specific CTL number in CHB patients(B).图3 CHB 患者外周血中Treg 频率与血清HBV DNA 对数值、Treg 频率与HBV 特异的CTL 数目的相关性分析
讨 论
在HBV 感染的免疫调节中,Treg 可通过与T 细胞的相互作用发挥免疫调节机制,可使HBV 和机体的效应细胞之间维持一种稳态,在防止过强的免疫损伤和清除病原体之间取得平衡[3,4]。但是当前对于Treg 细胞表达及在慢性HBV 感染患者免疫发病机制中的作用尚存争议[4,5]。因此,检测CHB 患者外周血中Treg 的频率和特异性CTL 表达对于阐明乙型肝炎慢性化的机制和探讨有效的免疫治疗策略均有重要的临床意义。
FOXP3 作为一种特殊的转录因子特异性地高表达在Tregs 上,在一定程度上可反映Treg 的水平和功能活性,可作为证实Treg 的金标准[4]。本研究通过“一步法”同时进行细胞表面、胞内FOXP3 标记,可有效简化实验步骤,节约操作时间,有利于减少检测结果的不稳定性。本研究发现外周血CD4+CD25+Treg 细胞在慢性乙型肝炎感染者中明显增高,与HBV DNA 载量呈正相关,与多数文献报道相一致[6-8],说明慢性HBV 感染者体内的Treg 频率增高可能是导致机体清除HBV 能力下降的重要原因,提示机体可能通过Treg 的免疫抑制效应促进了病毒的复制,导致免疫耐受发生,促进了疾病的慢性化。
由于CHB 患者外周血中特异性CTL 水平极低,传统的免疫学方法难以准确计数,本研究采用乙肝病毒特异性T 淋巴细胞酶联免疫斑点诊断试剂盒检测人外周血样本中HBV 抗原特异的T 淋巴细胞在HBV 特异性抗原刺激后IFN-γ 分泌情况,从而对可分泌乙肝特异性IFN -γ 的活化CTL 进行了精确定量。我们观察到Treg 数量与HBV 特异性CTL 表达呈负相关,推测相对较低的Treg 数量有利于HBV 特异性CTL 的细胞。免疫反应发挥清除病毒的作用,提示Treg 可能通过下调HBV 特异性CTL 的免疫学效应而造成病毒不能被清除,进而造成乙肝病毒在患者体内慢性持续存在,这可能也是造成机体对乙肝病毒免疫耐受主要因素之一。
本研究证实了Treg 细胞与HBV 特异性CTL 的表达呈负相关,提示监测外周血Treg 细胞比例有望成为评价患者体内细胞免疫状态的有效指标,从而为探讨通过控制Treg 的免疫调节效应作为治疗的新策略提供了新思路,但对于Treg 细胞在HBV 感染免疫耐受状态中的具体作用和调节机制仍需深入研究。
[1] TrehanPati N,Geffers R,Sukriti,et al. Gene expression signatures of peripheral CD4+T cells clearly discriminate between patients with acute and chronic hepatitis B infection[J]. Hepatology,2009,49(3):781 -790.
[2] 高月求,孙学华,章晓鹰,等.乙肝病毒蛋白对慢性乙型肝炎患者PBMCs 功能的影响[J]. 中国病理生理杂志,2007,23(6):1161 -1163.
[3] 陈莉娟,周 浩,朱剑文,等,Foxp3 转染小鼠CD4+CD25-T 细胞抑制NK 细胞活性[J]. 中国病理生理杂志,2009,25(6):1151 -1155.
[4] 张 蓓,付晓岚,王靖雪,等.慢性乙型肝炎患者外周血中CD4+CD25+调节性T 细胞的变化和意义[J].免疫学杂志,2007,23(3):327 -330.
[5] 徐慧宁,姜艳芳,李婉玉,等.慢性乙型肝炎患者外周血CD4+CD25+调节性T 细胞的表达水平及临床意义[J].吉林大学学报(医学版),2008,34(2):285 -287.
[6] 张恒辉,郭 芳,费 然,等. CD4+CD25+调节性T 细胞在慢性乙型肝炎患者免疫发病机制中的作用[J].世界华人消化杂志,2007,15(20):2225 -2230.
[7] 周立平,陈 昕,巴 静,等.HBV 感染后外周血CD4+CD25+Foxp3+调节性T 细胞与疾病进展的相关性[J].世界华人消化杂志,2007,15(21):2366 -2369.
[8] Fu JL,Xu DP,Zhao P,et al. The characterization of regulatory T cells in peripheral blood of HBV -infected patients[J]. Zhonghua Yi Xue Za Zhi,2006,86(22):1522-1525.
