1,25-二羟维生素D3抑制被动致敏人气道平滑肌细胞的增殖
2011-12-23宋颖芳赖国祥戚好文吴昌归
宋颖芳, 赖国祥△, 戚好文, 吴昌归
(1 南京军区福州总医院呼吸与危重症医学科,福建 福州350025;2 第四军医大学西京医院呼吸内科,陕西 西安710032)
气道重塑是哮喘慢性化及严重化的基础。在涉及气道重塑的众多细胞中,气道平滑肌细胞(airway smooth muscle cells,ASMCs)发挥着关键性作用。甾体激素1,25-二羟维生素D3[1,25-dihydroxyvitamin D3,1,25-(OH)2D3]是维生素D(vitamin D)的活性代谢产物,它不仅在骨骼代谢及免疫系统中发挥着重要作用,而且对细胞增殖、分化及凋亡等过程也具重要的调节作用[1]。先前研究发现1,25-(OH)2D3对多种正常细胞或癌细胞的增殖存在负性调节作用[2]。但迄今为止,国内外尚无关于1,25-(OH)2D3对被动致敏的人气道平滑肌细胞(human airway smooth muscle cells,HASMCs)调节作用的相关研究报道。本研究观察1,25-(OH)2D3对被动致敏的HASMCs 增殖的影响,探讨其在气道重塑中的作用。
材 料 和 方 法
1 材料
HASMCs 购自Sciencell。MTT 和胰蛋白酶购自Sigma。DMEM 培养基购于Gibco。胎牛血清购于杭州四季青生物公司。羊抗人增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)mAb 和SABC 试剂盒购于武汉博士德生物工程公司。
2 HASMCs 的培养
HASMCs 置于含10%胎牛血清的高糖DMEM 液,于37℃、5%CO2孵箱内静置培养。
3 细胞分组
所有的实验均需要对细胞进行同步化处理:待传代细胞贴壁后,弃上清液,随后将细胞随机分成3 组:对照组、哮喘组及1,25-(OH)2D3组。对照血清及哮喘血清参照文献予以制备[3]。用无血清的DMEM 液同步化对照组及哮喘组的细胞,而1,25-(OH)2D3组予以含1,25-(OH)2D3的无血清DMEM 液进行细胞同步化,同步化48 h 后,对照组加入含10%对照血清的DMEM 液,而哮喘组与1,25-(OH)2D3组均加入含10%哮喘血清的DMEM 液。
4 MTT 法检测HASMCs 的增殖活性
4.1 确定1,25-(OH)2D3的最佳作用浓度 取对数生长期HASMCs 以6 ×103cells/well 接种于96 孔培养板内,依上述方法分组,1,25-(OH)2D3组分4 个亚组:分别加入10-7、10-8、10-9、10-10mol/L 1,25-(OH)2D3,孵箱内分别培养48 h 后向每孔加入MTT 液20 μL,继续孵箱内培养4 h 后,弃上清液,加入二甲基亚砜150 μL 振荡10 min 后,选择492 nm 波长用酶联免疫检测仪测定各孔吸光度值(A492nm值),据此确定1,25-(OH)2D3最佳作用浓度。
4.2 绘制HASMCs 的细胞生长曲线 确定10-7mol/L 作为1,25-二羟维生素D3最佳浓度,调节细胞接种密度为8 ×103cells/well,实验步骤基本同上,分别于血清刺激后12 h、24 h、36 h、48 h、60 h 及72 h 各取一块培养板,检测A492nm值,绘制细胞的生长曲线。
5 流式细胞术检测HASMCs 的细胞周期
取对数生长期HASMCs 接种于75 mL 培养瓶内,依上述方法进行分组,1,25-(OH)2D3组加入10-7mol/L 1,25-(OH)2D3,孵箱内分别培养48 h 后快速胰酶消化收获各组细胞,1 000 r/min 离心5 min,冰PBS 洗涤2 次,75%冰乙醇固定并4 ℃静置过夜,而后按常规方法碘化吡啶染色,室温放置30 min,用流式细胞仪检测细胞周期,计算细胞增殖指数(proliferative index,PI),PI =(S +G2/M)/(G0/G1+S +G2/M)×100%。
6 PCNA 免疫细胞化学染色
取对数生长期HASMCs 接种于内置盖玻片的24 孔培养板,依上述方法进行分组,1,25-(OH)2D3组加入10-7mol/L 1,25-(OH)2D3,孵箱内分别培养48 h 后取出细胞爬片,PBS洗2 次,4%多聚甲醛固定,常规免疫细胞化学SABC 法染色,以羊抗人PCNA 抗体作为I 抗(1∶100 稀释),用PBS 代替特异性I 抗进行阴性对照。最后DAB 显色,封片后镜下观察。显微镜下随机选择5 个高倍视野,每个视野计数100 个细胞,计算PCNA 阳性率(阳性细胞核数/总细胞核数)。
7 统计学处理
结 果
1 MTT 法检测1,25-(OH)2D3 对被动致敏HASMCs 增殖活力的影响
10-10mol/L 1,25-(OH)2D3组与哮喘组A492nm值无明显差异(P >0.05);而其它浓度的1,25-(OH)2D3组A492nm值均较哮喘组明显下降,且各浓度组间差异显著,其中10-7mol/L 1,25-(OH)2D3组抑制作用最为明显。故选取10-7mol/L 1,25-(OH)2D3为最佳浓度用于后续的实验研究,见图1。
10-7mol/L 1,25-(OH)2D3对被动致敏HASMCs 增殖的抑制作用表现为时间依赖性,见图2。
2 1,25-(OH)2D3 对被动致敏HASMCs 细胞周期的影响
1,25-(OH)2D3显著降低哮喘血清刺激后HASMCs 的PI,即明显增加哮喘血清刺激的G0/G1期细胞比例,而相应地减少了S 及G2/M 期细胞比例,即阻止细胞由G0/G1期向S 期的转化,见表1。
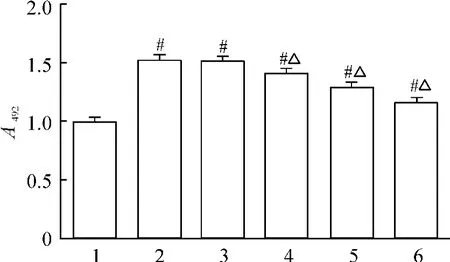
Figure 1. Inhibitory effect of 1,25-(OH)2D3 on the proliferation of passively-sensitized HASMCs. 1:control group;2:asthma group;3:10 -10 mol/L 1,25-(OH)2D3 group;4:10 -9 mol/L 1,25-(OH)2D3 group;5:10 -8 mol/L 1,25-(OH)2D3 group;6:10 -7 mol/L 1,25-(OH)2D3 group. ±s.n=8. #P <0.05 vs control group;△P <0.05 vs asthma group.图1 1,25-(OH)2D3 对被动致敏HASMCs 增殖的抑制作用
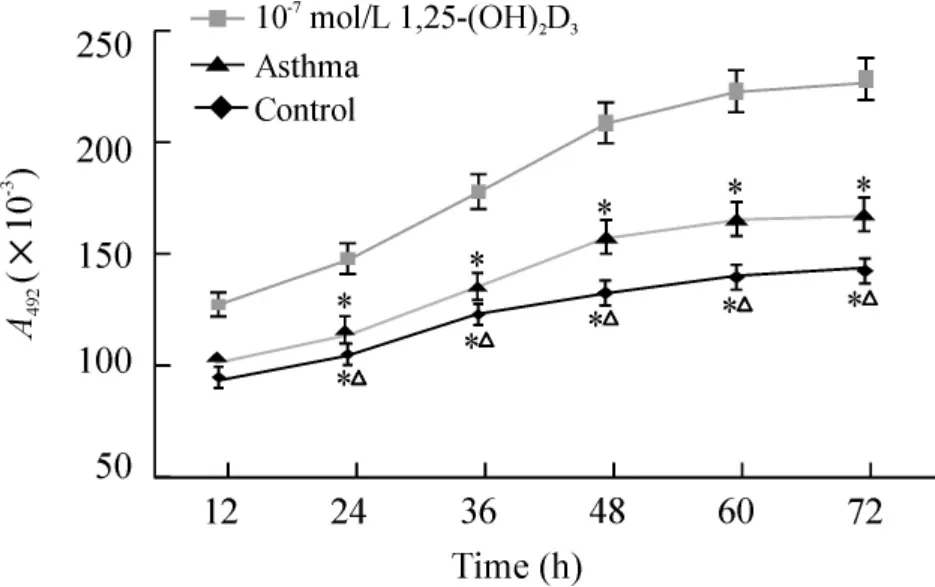
Figure 2. Growth curve of HASMCs treated with 1,25-(OH)2D3 at the concentration of 10 -7 mol/L. ±s.n=8. * P <0. 05 vs control group;△P <0. 05 vs asthma group.图2 10 -7 mol/L 1,25-(OH)2D3 作用下的细胞生长曲线
表1 1,25-(OH)2D3 对被动致敏HASMCs 细胞周期的影响Table 1. Effect of 1,25-(OH)2D3 on cell cycle of passivelysensitized HASMCs(%. ±s.n=3)

表1 1,25-(OH)2D3 对被动致敏HASMCs 细胞周期的影响Table 1. Effect of 1,25-(OH)2D3 on cell cycle of passivelysensitized HASMCs(%. ±s.n=3)
* P <0.05 vs control group;△P <0.05 vs asthma group.
Group G0/G1 S G2/M PI Control 73.87±0.80 16.47±0.69 9.67±0.73 26.13±0.87 Asthma 63.33±0.68* 20.27±1.32* 16.40±1.52* 36.93±0.94*1,25-(OH)2D3 69.30±0.62*△14.83±0.67*△15.87±1.29*△ 30.75±1.62*△
3 PCNA 免疫细胞化学染色
HASMCs 经哮喘血清刺激48 h 后,细胞核着色呈褐色,PCNA 阳性 率 为(65. 74 ± 2. 59)%。10-7mol/L 1,25-(OH)2D3预处理HASMCs 后,细胞核着色呈棕褐色,PCNA阳性率为(54.57 ±1.72)%。而对照组细胞着色呈浅褐色,PCNA 表达率仅为(50.07 ±1.37)%,见图3。
讨 论
随着哮喘的慢性化及严重化,它表现出了固定性气道阻塞及激素抵抗等新特征。气道重塑是所有这些新特征的结构基础,其特征性病理学改变是气道平滑肌层的增厚。ASMCs 是平滑肌层主要组成部分,作为气道重塑的关键性参与细胞及效应细胞,它在气道重建中发挥着重要的作用,研发抑制气道平滑肌细胞增殖的药物已成为防治哮喘相关性气道重塑的热点之一。
抑制多种类型细胞的增殖,诱导细胞的凋亡和分化是除免疫调节作用外1,25-(OH)2D3的另一重要的骨外作用。既往研究已从体内水平证实1,25-(OH)2D3对ASMCs 的抗增殖作用[4],但体内环境下的ASMCs 是一个三维的特殊细胞群体,具有独特的微环境,在细胞-细胞、细胞-微环境之间存在着广泛的联系。因此体内实验所发现的1,25-(OH)2D3对ASMCs 的抗增殖作用是其直接的抑制作用还是其通过细胞之间的相互作用和信号传递而发挥的间接抑制作用,尚不明确。

Figure 3. Immunocytochemical staining for PCNA in HASMCs of each group (DAB staining,×100).图3 HASMCs 的PCNA 免疫细胞化学染色
实验首先采用MTT 法检测在10-10-10-7mol/L 浓度范围内1,25-(OH)2D3对被动致敏HASMCs 增殖活力的影响。10-10mol/L 接近1,25-(OH)2D3在体内的生理浓度[5],从10-9mol/L 的浓度开始,1,25-(OH)2D3对HASMCs 增殖有明显的抑制作用,且这种作用表现为浓度依赖性,当浓度达到10-7mol/L 时,1,25-(OH)2D3抗细胞增殖作用最强并呈现时间依赖性。10-6mol/L 是目前推荐的1,25-(OH)2D3发挥有效治疗效应的血浆浓度(即药理浓度)[6],但这种治疗剂量的应用易诱发机体的高钙血症,因此一定程度上1,25-(OH)2D3被严格限制了其在临床上的应用。另有研究还发现10-6mol/L 1,25-(OH)2D3对SMCs 的调节作用仅稍强于10-7mol/L 1,25-(OH)2D3[7]。鉴于此考虑,本实验并未选用10-6mol/L 这一浓度。从实验结果可以看出10-7mol/L 1,25-(OH)2D3已能显著抑制被动致敏HASMCs 的增殖及分泌功能,它为临床运用低剂量1,25-(OH)2D3的可行性提供了初步的理论支持。
PCNA 又称周期蛋白,是DNA 聚合酶δ 及细胞复制DNA的必须成分,其表达与细胞增殖活性有关,已成为评价细胞增殖状态的一项客观指标[8]。本实验结果发现1,25-(OH)2D3组HASMCs 的PCNA 阳性率明显低于哮喘组,间接证实1,25-(OH)2D3的干预能显著抑制被动致敏HASMCs的细胞增殖,此结果与上述的MTT 法观察结果相一致。
细胞周期是细胞增殖信号转导的最终共同通路,进入细胞周期和细胞周期的推进是哮喘ASMCs 增殖的关键事件。现有资料表明1,25-(OH)2D3具有特异性细胞周期抑制作用,能特异性阻断癌细胞由G1期向S 期的转化[9,10]。本研究结果发现1,25-(OH)2D3对HASMCs 的细胞周期也具有同样的特异性抑制作用,它能阻滞细胞周期从G1期进入S 期,引起G0/G1期细胞堆积,造成处于增殖状态的S 期及G2/M期细胞数目下降,进而抑制被动致敏HASMCs 的细胞增殖。
1,25-(OH)2D3主要通过与其受体VDR 的结合发挥生物学效应。新近研究证实VDR 基因是哮喘的新易感基因,提示1,25-(OH)2D3可通过与VDR 的配体-受体效应参与对哮喘的调节作用[11]。大量的流行病学、临床学及免疫学资料已证实1,25-(OH)2D3在哮喘的免疫应答及慢性气道炎症方面均发挥着复杂的调控作用[12-14],本研究采用被动致敏技术,发现1,25-(OH)2D3对哮喘状态下HASMCs 增殖的负性调节作用,间接证实了其对哮喘气道重塑的抑制作用。新近临床研究发现机体的维生素D 水平与肺功能呈正相关[15],本研究结果亦从细胞及分子水平为其提供了一个可能的合理性解释,展示了1,25-(OH)2D3潜在的改善肺功能及气道重塑的能力。
[1] Bikle D.Nonclassic actions of vitamin D[J]. J Clin Endocrinol Metab,2009,94(1):26-34.
[2] 刘海玲,张新昌,李贤慧.1,25-二羟维生素D3的免疫抑制及抗肿瘤作用[J]. 武警医学院学报,2009,18(11):72-74.
[3] Xu SY,Xu YJ,Zhang ZX,et al.Contribution of protein kinase C to passively sensitized human airway smooth muscle cells proliferation[J]. Chin Med J (Engl),2004,117(1):30-36.
[4] 宋颖芳,柏长青,戚好文,等.1,25-二羟维生素D3对哮喘小鼠气道重塑及基质金属蛋白酶-9 表达的影响[J].细胞与分子免疫学杂志,2008,24(5):527-531.
[5] Sadeghi K,Wessner B,Laggner U,et al. Vitamin D3down-regulates monocyte TLR expression and triggers hyporesponsiveness to pathogen-associated molecular patterns[J]. Eur J Immunol,2006,36(2):361-370.
[6] Riachy R,Vandewalle B,Kerr Conte J,et al.1,25-dihydroxyvitamin D3protects RINm5F and human islet cells against cytokine-induced apoptosis:implication of the antiapoptotic protein A20[J]. Endocrinology,2002,143(12):4809-4819.
[7] Wu-Wong JR,Nakane M,Ma J.Effects of vitamin D analogs on the expression of plasminogen activator inhibitor-1 in human vascular cells[J]. Thromb Res,2006,118(6):709-714.
[8] 陈福春,潘 琦,张玉霞,等.CD147 和PCNA 蛋白在人肺癌组织中的表达意义[J].中国病理生理杂志,2010,26(7):1450-1452.
[9] Verlinden L,Eelen G,Beullens I,et al.Characterization of the condensin component Cnap1 and protein kinase Melk as novel E2F target genes down-regulated by 1,25-dihydroxyvitamin D3[J]. J Biol Chem,2005,280 (45):37319-37330.
[10] Zinser GM,McEleney K,Welsh J. Characterization of mammary tumor cell lines from wild type and vitamin D3receptor knockout mice[J]. Mol Cell Endocrinol,2003,200(1-2):67-80.
[11] Sutherland ER,Goleva E,Jackson LP,et al. Vitamin D levels,lung function,and steroid response in adult asthma[J]. Am J Respir Crit Care Med,2010,181(7):699-704.
[12] Hansdottir S,Monick MM,Hinde SL,et al. Respiratory epithelial cells convert inactive vitamin D to its active form:potential effects on host defense[J]. J Immunol,2008,181(10):7090-7099.
[13] Gorman S,Judge MA,Burchell JT,et al. 1,25-dihydroxyvitamin D3 enhances the ability of transferred CD4+CD25+cells to modulate T helper type 2-driven asthmatic responses[J].Immunology,2010 ,130(2):181-192.
[14] Searing DA,Zhang Y,Murphy JR,et al. Decreased serum vitamin D levels in children with asthma are associated with increased corticosteroid use[J]. J Allergy Clin Immunol,2010 ,125(5):995-1000.
[15] Black PN,Scragg R. Relationship between serum 25-hydroxyvitamin and pulmonary function in the third national health and nutrition examination survey[J]. Chest,2005,128(6):3792-3798.
