单纯三维适形放射治疗原发性肝癌长期疗效的观察
2011-08-01朱小东梁世雄黄启芳
梁 霞 朱小东 李 龄 陈 龙 梁世雄 黄启芳
原发性肝癌(primary liver cancer,PLC)的理想治疗方法是根治性切除肿瘤,但临床上约有80%的患者因各种原因不宜或不能手术。随着三维适形放疗技术(three-dimensional conformal radiation,3DCRT)的发展,3DCRT在PLC治疗中的地位日益提高,目前已成为PLC外照射的主流技术。自1999年4月至2007年7月,我院用单纯3DCRT治疗153例不能手术的PLC,现将疗效总结如下。
1 资料与方法
1.1 一般资料
自1999年4月至2007年7月我院用单纯3DCRT治疗153例不能手术的PLC,其中男性136例,女性17例,中位年龄49岁(27~77岁)。其中,12例有病理证实,其余为临床诊断PLC。临床诊断均按我国“新编常见恶性肿瘤诊治规范”中PLC诊断标准为依据。按2003年PLC的AJCC分期标准,本组中Ⅱ期12例,ⅢA期131例,ⅢB期4例,ⅢC期6例。
1.2 治疗方法
全部患者行3DCRT放疗,均应用Philips直线加速器8MV-X射线或Elekata直线加速器6MV-X射线,三维治疗计划系统包括上海拓能(Topslane)公司的三维治疗计划系统(Anti-Tumor Radiation Treatment Planning,ARTP),瑞典Elekata公司的三维治疗计划系统(predise plan),大恒公司的三维治疗计划系统。治疗时采用真空体模固定患者体位,训练患者平静呼吸,并使用膈肌控制器增加腹压限制呼吸,减少肝脏运动,进行CT增强扫描定位。扫描层距5~10mm,范围自膈顶上3~5cm至右肾下极。靶体积的定义:放疗计划CT上可见的肿瘤为大体肿瘤体积(GTV),勾画GTV前应该参考诊断CT或B超等检查结果,由放射诊断科医生和放射肿瘤科医生共同勾画出可见肿瘤体积(GTV),计划靶体积(PTV)为GTV向外扩0~2.0cm。由于治疗目的多为姑息性,对于肿瘤直径<5cm,为GTV外扩1.0~2.0cm;肿瘤直径5~10cm,为GTV外扩0.5~1.5cm;肿瘤直径 >10cm,为 GTV外扩0.1~0.5cm作为安全边界以减少正常肝脏受照射的体积。感兴趣危及器官(organs at risk,OARs)包括正常肝组织、十二指肠、胰腺、肾脏、胃和脊髓等,OARs不超过其耐受剂量,通过剂量体积直方图进行评估并优化放疗方案。分割剂量 2~8Gy(中位4.6Gy),照射次数为6~30次(中位11次),每周3~5次,肿瘤剂量33.6~70Gy(中位52Gy),总疗程2~7周(中位4周),按照LQ模式中生物效应剂量计算公式 BED=nd×[1+d/(α/β)]计算 BED(n为照射次数,d为每次分割剂量,α/β值为组织参数),取α/β值为 14Gy[1],约相当于常规放疗剂量 43.7~88Gy(平均为71.3Gy)。选择1~3个等中心点,5~8个非共面照射野,使90%的等剂量曲线覆盖90%以上的PTV剂量体积,通过体积剂量直方图进行评估并检查治疗方案。治疗过程中每周监测血常规、肝肾功能、AFP,同时予保肝及对症支持治疗,治疗后行腹部B超、CT、AFP、血常规和肝肾功能等检查。
1.3 疗效评估及毒副反应观察
所有患者治疗结束后定期行腹部超声、CT、血常规、肝肾功能和血清AFP检查。按世界卫生组织(WHO)肿瘤疗效报告标准评定疗效。自治疗之日起随访生存期。
1.4 随访
本组末次随访时间为2011年5月,全组随访期2~107个月(中位31.4个月),失访12例,失访率7.8%。
1.5 统计学处理
采用SPSS 16.0统计软件包对数据进行处理和分析。生存分析用Kaplan-Meier法。P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效
放疗结束后4个月行腹部CT和B超检查进行评价,完全缓解(CR)17例(11.1%),部分缓解(PR)40例(26.1%),稳定(NC)55例(35.9%),进展(PD)41例(26.8%),有效率(CR+PR)37.2%。
2.2 生存率
全组末次随访时间为2011年5月,随访期2~107个月(中位31.4个月)。失访 12例,失访率7.8%。中位生存时间16.07个月,1、3、5年生存率分别为38.0%、25.0%、20.0%。其中生存5年以上的患者中,按2003年 PLC的 AJCC分期标准,Ⅱ期7例,其余均为Ⅲ期以上患者。生存曲线见图1。
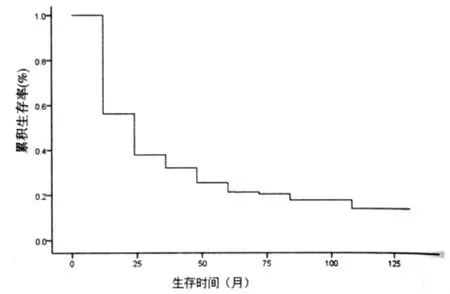
图1 单纯三维适形放射治疗原发性肝癌的生存曲线
2.3 治疗毒副反应
全组发生恶心、呕吐、食欲减退等消化道反应50例,发生率32.7%。出现白细胞降低14例,发生率9.2%。上消化道出血3例,发生率为1.3%。放射诱导的肝损伤(radiation-induced liver disease,RILD)13例,发生率为8.5%。
3 讨论
PLC是我国最常见的恶性肿瘤之一,手术是PLC的首选治疗手段,但临床上中晚期肝癌占大多数,确诊时往往已失去手术切除治疗的机会。即使是原发性小肝癌的病例,部分患者就诊时也往往因为合并多年的慢性活动性肝炎或肝硬化病史,肝脏潜在功能较差,不能耐受手术;部分患者肿瘤位于重要结构附近(如肝门、下腔静脉等),手术风险较大,也失去手术切除机会;亦有部分患者因其他医学原因如高龄、合并内科疾病以及患者拒绝手术等而不能采用手术方法治疗。故外科手术的应用存在很大的局限性[1,2]。因此,探索其他治疗方法显得十分必要。近年来,3DCRT正广泛应用于临床,3DCRT治疗肝癌已被多个研究机构证实是安全、有效的治疗方法[3~5],为不能手术切除的中晚期肝癌患者提供了一条新的治疗途径。为此,笔者对我院近年来应用3DCRT治疗的153例由于各种原因未行手术治疗肝癌进行回顾性分析,以了解3DCRT在PLC治疗中的地位。本组结果显示153例经3DCRT治疗的总有效率(CR+PR)37.3%,1、3、5年总生存率分别为 38.0%、25.0%、20.0%,与国内外研究报道相似[6,7]。综合其它文献及本组研究结果,笔者认为对合并其他器官疾病、年老体衰或患者拒绝手术等原因导致无法手术的PLC病例,3DCRT能有效地控制局部病灶,是较好的无创治疗手段。治疗中常见的反应包括消化道反应:恶心、呕吐、食欲减退等较为常见。上消化道出血,特别是在胃和十二指肠受到高剂量照射的患者,但一般较少,不需手术干预。发生骨髓抑制如白细胞、血红蛋白、血小板减少等,经对症治疗或中止治疗后都能恢复,多数病人能继续治疗。RILD为一种严重的放射性肝损伤,是肝癌放疗的主要并发症,也是影响肝癌3DCRT放射耐受量的主要因素。肝脏是放射耐受性较差的器官,放射敏感性次于骨髓、淋巴组织和肾,属于后期放射反应组织,即放射性肝病常出现在放疗结束后2周至数月中,大分割照射时RILD常发生于放疗后的4~8周,而常规分割照射时RILD多在放疗后2~6个月发生。其典型病理改变为中央小静脉闭塞性病变,病理过程为进行性肝纤维化。其主要表现为短期内肝脏增大、大量非癌性腹水、黄疸、碱性磷酸酶(AKP)升高≥2倍,转氨酶至少升高5倍于正常或治疗前的水平等,CT或MRI检查可见与射野形状一致的低密度区,边界清楚。保肝、支持和对症处理可延缓RILD的进展,严重者会导致患者死亡。因此,预防RILD的发生是首要考虑的问题。Cheng等[8]采用常规分割照射,靶区中位剂量50.2Gy治疗68例,用DVH研究了3DCRT对肝功能的影响。结果68例患者中有12例(17.6%)发生RILD,多因素分析表明,患者肝脏平均剂量>25Gy者较<20Gy者RILD发生率明显提高。梁世雄等[9]报道全肝平均剂量与RILD的发生有关,当V5、V10和V20≤81%、69%和42%且全肝平均剂量≤28Gy时RILD的发生概率<5%。蒋国梁[10]提出:伴发肝硬化是决定肝放射耐受性的一个关键因素,对Child-Pugh A级的患者,肝脏放射性耐受剂量是:正常肝的平均剂量(mean-dose to normal liver,MDTNL)为23Gy,该剂量预测RILD的敏感性为87.5%,特异性70.6%,阳性预测值21.9%,阴性预测值98.4%,假阴性率12.5%,假阳性率29.4%,预测总的准确度72%;安全剂量直方图(DVH)小于以下值的DVH是安全的:V5:86%;V10:68%;V15:59%;V20:49%;V25:35%;V30:28%;V35:25%;V40:20%;受照正常肝的体积越大,放射耐受剂量越低,可用以下方式估算能耐受的MDTNL(Gy)=-1.666+0.023×NLV(cm3)(正常肝的体积),Child-Pugh B级患者能耐受的MDTNL可能为6Gy。但在3DCRT中如何预防RILD的发生,仍需大量的临床资料进一步研究。
本研究结果显示3DCRT是PLC是有效而安全的无创治疗手段,对病灶邻近大血管或其它原因不能接受手术治疗的PLC患者,3DCRT是可供选择的较好治疗方法。但是,如何充分利用三维适形放疗物理剂量分布的优势,在病变周围正常组织剂量不增加的基础上,尽量提高病变的剂量以及在精确照射的前提下如何确定合理的分次方式、照射靶区等仍是值得进一步探讨的课题。
[1] Matsuura M,Nakajima N,Arai K,et al.The usefulness of radiation therapy for hepatocellular carcinoma[J].Hepatogastroenterology,1998,45(21)∶791-796.
[2] Tokuuye K,Sumi M,Ikeda H,et al.Technical considerations for fractionated stereotactic radiotherapy of hepatocellular carcinoma[J].Jpn J Clin Oncol,1997,27(3)∶170-173.
[3] Liu MT,Li SH,Chu TC,et al.Three-dimensional conformal radiation therapy for unresectable hepatocellular carcinoma patients who had failed with or were unsuited for transcatheter arterial chemoembolization [J].Jpn J Clin Oncol,2004,34(9)∶532-539.
[4] Cheng JC,Chuang VP,Cheng SH,et al.Local radiotherapy with or without transcatheter arterial chemoembolization for patients with unresectable hepatocellular carcinoma[J].Int J Radiat Oncol Biol Phys,2000,47(2)∶435-442.
[5] Liang SX,Zhu XD,Lu HJ,et al.Hypofractionated three-dimensional conformal radiation therapy for primary liver carcinoma[J].Cancer,2005,103(10)∶2181-2188.
[6] 王孝平,刘永敏,赫 颖.单纯三维适形放射治疗巨大原发性肝癌的临床观察[J].中华肿瘤防治杂志,2006,11(13)∶1677.
[7] 陈 华,陈华津,王晓云,等.中晚期肝癌三维适形放疗的临床观察[J].中华放射肿瘤学杂志,2005,14(2)∶128-130.
[8] Cheng JC,Wu JK,Huang CM,et a1.Radiation-induced liver disease after three-dimensional conformal radiotherapy for patients with hepatocellular carcinoma:dosimetric analysis and implication[J].Int J Radiat Oncol Biol Phys,2002,54(1)∶156-162.
[9] 梁世雄,蒋国梁,朱小东,等.原发性肝癌三维适形放疗后放射性肝病的影响因素[J].中华放射肿瘤学杂志,2005,14(4)∶248-288.
[10] 蒋国梁.原发性肝癌治疗的新方法—三维适形放疗[J].癌症进展杂志,2006,4∶279-282.
