弥漫大B细胞淋巴瘤患者血浆MGMT基因甲基化与化疗疗效关系
2011-08-01康马飞骆梅青廖漓漓
康马飞 骆梅青 刘 瑛 廖漓漓 陈 莹
一部分弥漫大B细胞淋巴瘤(DLBCL)对标准化疗方案(CHOP)抗拒或继发性耐药,其原因不明。O6甲基鸟嘌呤DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)是一种非常重要的DNA修复酶。烷化剂的细胞毒作用主要是由于DNA内O6位鸟嘌呤烷基化所引起,MGMT将烷基从O6鸟嘌呤转移到半胱氨酸残基内,修补DNA的完整性。肿瘤细胞对烷化剂耐药常与高水平的DNA修复蛋白MG-MT有关。研究表明,甲基化是MGMT基因失活的主要机制之一,MGMT基因甲基化可使MGMT表达和活性明显下降,因此,MGMT甲基化从另一方面反映了MGMT的表达和活性。本研究通过观察30例弥漫大B细胞淋巴瘤(DLBCL)患者血浆甲基化MGMT基因在化疗前后的表达情况,了解血浆甲基化MGMT基因表达与化疗疗效之间的关系,为血浆甲基化MGMT基因表达能否作为DLBCL化疗疗效预测指标提供理论依据。
1 材料与方法
1.1 一般资料
收集2008年10月至2010年4月期间桂林医学院附属医院肿瘤内科收治且经病理确诊的30例DLBCL患者,男性18例,女性12例,年龄34~76岁,中位年龄为54岁。测定所有患者化疗前的血浆甲基化MGMT基因表达情况。所有患者均给予CHOP方案(环磷酰胺750mg/m2,第1天;阿霉素50 mg/m2,第1天;长春新碱1.4 mg/m2,第1天;强的松60 mg/m2,第1~5天;每21d重复)治疗,每2个周期评价疗效1次,并测定所有患者的血浆甲基化MGMT基因表达,共6个周期。
1.2 疗效判断标准
按“Cheson淋巴瘤疗效标准”进行疗效评价,分为 CR、CRu、PR、SD 和复发/PD,总有效率(ORR)=CR+CRu+PR。
1.3 实验方法
1.3.1 标本采集
分别于患者化疗前、第3个化疗周期前、第5个化疗周期前收集其周围静脉血液标本2ml于EDTA抗凝管中,以3 000r/min离心15min分离获得血浆,将血浆置于-20℃保存备用,用于测定甲基化MGMT基因检测。
1.3.2 DNA的提取
血浆DNA的提取采用CWBIO康为世纪公司的TissueGen DNA Kit(ca.t no.CW0546)试剂盒,操作步骤如下:①取 100μl样品加入 Buffer GTL补足至200μl;②加入200μl proteinase K,涡旋震荡使样品彻底混匀;③加200μl Buffer GL,涡旋震荡充分混匀,加入200μl无水乙醇,涡旋震荡充分混匀;④将步骤3所得溶液全部加入到已装入收集管的吸附柱中,10 000r/min离心1min,倒掉收集管中的废液,将吸附柱重新放入收集管中;⑤向吸附柱中加入500μl Buffer GW1,10 000 r/min离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中;⑥向吸附柱中加入500μl Buffer GW2,10 000r/min 离心 1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。重复该步骤一次;⑦12 000r/min离心2min,倒掉收集管中的废液。将吸附柱置于室温数分钟,以彻底晾干;⑧将吸附柱置于一个新的离心管中,向吸附柱的中间部位悬空加入50~200μl Buffer GE,室温放置5min,10 000r/min离心1min,收集DNA溶液,-20℃保存DNA。
1.3.3 DNA的修饰
血浆中肿瘤细胞释放的DNA经过亚硫酸氢钠修饰,CpG中未甲基化的胞嘧啶被转变为尿嘧啶,而甲基化的胞嘧啶则不发生变化。修饰过程:①取20μl DNA,加入装有 130μl CT Conversion Reagent solution的PCR 管中,98℃水浴8min,64℃金属浴3.5h,4℃冰箱保存20h。②往已装入收集管的吸附柱中加入600μl M-Binding Buffer。③把步骤①所得的150μl液体全部加入到收集管中,10 000r/min离心30s,倒掉收集管中的废液,将吸附柱重新放回收集管中。④向吸附柱中加入100μl M-wash Buffer,10 000r/min离心30s,倒掉收集管中的废液,将吸附柱重新放回收集管中。⑤向吸附柱中加入200μl M-Desulphonation Buffer,置室温(20 ~30℃)20min,10 000r/min 离心 30s,倒掉收集管中的废液,将吸附柱重新放回收集管中。⑥向吸附柱中加入200μl M-wash Buffer,10 000r/min离心30s,倒掉收集管中的废液,将吸附柱重新放回收集管中。再重复实验步骤1次。⑦把吸附柱放入1.5ml的EP管中,向吸附柱中加入10μl M-Elution Buffer,10 000r/min离心 30s,收集 DNA 溶液,-20℃保存DNA。
1.3.4 引物序列及巢式PCR检测
巢式PCR按照文献报道的方法进行[1],所用的引物序列及产物片断大小为MGMT-F(160bp)上游引物:5'-GYGTTTYGGATATGTTGGGATAGTT-3',下游引物:5'-AAACTCCRCACTCTTCCRAAAAC-3';MGMT-M(81bp)上游引物:5'-TTTCGACGTTCGTAGGTTTTCGC-3',下游引物:5'-GCACTCTTCCGAAAACGAAACG-3';MGMT-U(93bp)上游引物:5'-TTTGTGTTTTGATGTTTGTAGGTTTTTGT-3',下游引物:5'-AACTCCACACTCTTCCAAAAACAAAACA-3'。MGMT-M用于扩增MGMT基因5'CpG岛甲基化等位基因,MGMT-U用于扩增MGMT基因5'CpG岛非甲基化等位基因。PCR分两步进行:首先用MGMT-F扩增富含CpG的启动子区片段,反应条件为:5×GoldStar Taq MasterMix 12.5μl,上下游 Primer各1μl,DNA 10μl,加 RNase Free dH2O至 25μl。95℃ 预变性 10min,进入循环:95℃ 变性30s,56℃退火 30s,72℃延伸 30s,35 个循环后 72℃ 延伸5min。反应产物稀释30倍,取2μl进行第2轮PCR反应,反应条件为:5×GoldStar Taq MasterMix 12.5μl,上下游 Primer各 1μl,DNA 2μl,加 RNase Free dH2O至25μl。95℃预变性10min,进入循环:95℃变性30s,56℃ 退火 30s ,72℃ 延伸 30s,35 个循环后72℃延伸5min。PCR反应试剂盒25μl(CWBIO康为世纪公司,2×GoldStar Taq MasterMix(Ca.t no.CW0939)。对全部亚硫酸氢钠处理后的DNA样品同时进行了MGMT基因的非甲基化分析,均可以观察到非甲基化产物,验证了DNA的修饰反应是成功的。
1.3.5 SssI酶处理
为保证检测的可靠性,以经SssI酶处理和未经SssI酶处理的正常人外周血淋巴细胞DNA分别作为MGMT基因启动子甲基化的阴性和阳性对照。SssI酶处理步骤:10 × NE Buffer2 4μl,200 × SAM 0.5μl,DNA 5μl,SssI酶(4U/μl)1.5μl,加 RNase Free dH2O至40μl。37℃水浴 4h,65℃金属浴 15min灭活 SssI酶,按照1.3.3步骤甲基化修饰及1.3.4的步骤进行巢氏PCR。
1.3.6 凝胶电泳分析
取5μl扩增产物,用2.0%的琼脂糖凝胶进行电泳鉴定,溴化乙啶染色,用凝胶电泳成像仪进行拍照分析。
1.4 统计学处理
用SPSS 17.0软件进行统计分析,计数资料的差别比较用χ2检验。P<0.05为差别有统计学意义。
2 结果
2.1 化疗前血浆甲基化MGMT基因表达与化疗疗效的关系
30例DLBCL患者血浆MGMT基因甲基化率为63.3%(19/30),血浆MGMT基因甲基化者化疗有效率为100.0%(19/19),血浆MGMT基因非甲基化者化疗有效率为72.7%(8/11),甲基化与非甲基化患者比较,化疗有效率差异有统计学意义(Fisher精确概率法,P=0.041。)其电泳图见图1。
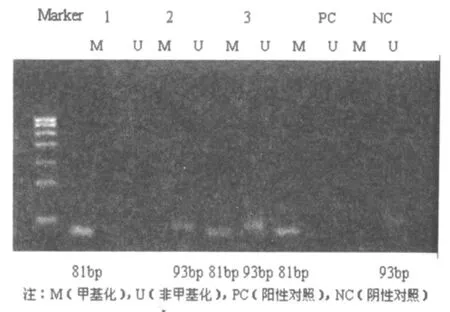
图1 血浆MGMT基因甲基化和非甲基化的电泳图
2.2 化疗后血浆甲基化MGMT基因表达与化疗耐药的关系
血浆MGMT基因甲基化者化疗后4个周期无效者1例,化疗6个周期后有1例出现耐药,耐药发生率为10.5%(2/19)。血浆MGMT基因非甲基化者化疗后2个周期无效者3例,化疗后4个周期无效者1例,化疗后6个周期无效者2例,化疗后耐药发生率为54.5%(6/11)。两组耐药发生率比较,差异有统计学意义(χ2=4.836,P=0.028)。
3 讨论
MGMT基因定位于10q26,编码产物MGMT是一种非常重要的修复蛋白。在烷化剂治疗过程中,肿瘤O6烷基鸟嘌呤修复程度依赖于细胞内MGMT的原始水平和新MGMT蛋白合成的程度。未能修复的O6甲基(或氯乙基)鸟嘌呤损害导致致命的DNA链内交联,导致肿瘤细胞死亡。提高烷化剂抗癌药临床疗效的一条途径是降低肿瘤细胞内MGMT的活性。大量研究表明,MGMT mRNA的表达水平决定MGMT蛋白水平,而MGMT蛋白水平直接反映MGMT酶活性[2]。
研究表明,MGMT基因甲基化可使MGMT表达和活性明显下降。因此,MGMT甲基化基因表达情况从另一方面反映了MGMT的表达和活性。Blough等[3]的研究结果表明,肿瘤组织中MGMT启动子甲基化预示将获益于烷化剂替莫唑胺(TMZ)化疗。此外,MGMT启动子甲基化还是一个良好的无进展生存预后指标[4,5]。
临床上因有的肿瘤不易取到组织,或不易在肿瘤治疗过程中反复获取组织,所以有学者开始寻找更方便获得标本的方法(如血液)评价肿瘤细胞MGMT基因甲基化情况。研究发现肿瘤患者血浆DNA与肿瘤组织存在一致的基因改变。Balana等[6]比较了多形性恶性胶质瘤肿瘤组织的甲基化MGMT DNA与血浆甲基化MGMT DNA的关系,结果显示,MGMT DNA甲基化情况在肿瘤和血浆中是一致的。
在DLBCL与MGMT甲基化关系的研究中,有研究者发现,DLBCL患者 MGMT蛋白表达阴性率为30.2%,MGMT蛋白表达阴性者,MGMT启动子甲基化达88.2%,而MGMT蛋白表达阳性者,MGMT启动子甲基化仅19.0%,提示MGMT蛋白表达缺乏与启动子甲基化相关[7],说明启动子甲基化与MGMT蛋白表达呈负相关。但有研究却发现,DNA甲基化测定不一定能准确预告基因静默状态[8],MGMT表达与非甲基化状态,MGMT不表达与甲基化状态关系不大[9]。有研究显示,MGMT基因表达与肿瘤细胞对烷化剂的敏感性密切相关,其启动子甲基化使MGMT失活,38.8%DLBCL患者的MGMT启动子甲基化,甲基化状态与OS正相关[10]。MGMT启动子甲基化在DLBCL患者中达52.3%,启动子甲基化与化疗疗效和DFS无关,但MGMT甲基化是DLBCL的有意义的预后因素[11]。本研究中30例DLBCL患者化疗前血浆甲基化 MGMT基因的表达率为63.3%,MGMT DNA甲基化者化疗有效率为100.0%,而MGMT DNA非甲基化者有效率为72.7%,两组差异有统计学意义(P <0.05)。
本研究结果显示,检测血浆甲基化MGMT基因表达与DLBCL患者使用CHOP方案治疗的疗效相关,血浆甲基化MGMT基因表达可能成为DLBCL患者个体化化疗的有用指标,检测血浆甲基化MGMT基因更便于动态观察,更方便在肿瘤治疗过程中根据其表达的变化选择个体化化疗方案,提高化疗效果。
[1] House MG,Guo M,Iacobuzio-Donahue C,et al.Molecular progression of promoter methylation in intraductal papillary mucinous neoplasms(IPMN)of the pancreas[J].Carcinogenesis,2003,24(2)∶193-198.
[2] Passagne I,Evrard A,Depeille P,et al.O(6)-methylguanine DNA-methyltransferase(MGMT)overexpression in melanoma cells induces resistance to nitrosoureas and temozolomide but sensitizes to mitomycin C [J].Toxicol Appl Pharmacol,2006,211(2)∶97-105.
[3] Blough MD,Zlatescu MC,Cairncross JG.O6-methylguanine-DNA methyltransferase regulation by p53 in astrocytic cells[J].Cancer Res,2007,67(2)∶580-584.
[4] Everhard S,Kaloshi G,Criniere E,et al.MGMT methyration:a marker of response to temozolomide in low grade gliomas[J].Ann Neurol,2006,60(6)∶740-743.
[5] Hiraga J,Kinoshita T,Ohno T,et al.O6-methylguanine-DNA methyltransferase and p53 mutation in diffuse large B-cell lymphoma[J].Int J Hematol,2006,84(3)∶248-255.
[6] Balana C,Ramirez JL,Taron M,et al.O6-methyl-guanine-DNA methyltransferase methylation in serum and tumor DNA predicts response to 1,3-bis(2-chloroethyl)-1-nitrosourea but not to temozolamide plus cisplatin in glioblastoma multiforme[J].Clin Cancer Res,2003,9(4)∶1461-1468.
[7] Ohno T,Hiraga J,Ohashi H.Loss of O6-methylguanine-DNA methyltransferase protein expression is a favorable prognostic marker in diffuse large B-cell lymphoma[J].Int J Hematol,2006,83(4)∶341-347.
[8] Pike BL,Greiner TC,Wang X,et al.DNA methylation profiles in diffuse large B-cell lymphoma and their relationship to gene expression status[J].Leukemia,2008,22(5)∶1035-1043.
[9] Uccella S,Cerutti R,Placidi C,et al.MGMT methylation in diffuse large B-cell lymphoma:validation of quantitative methylation-specific PCR and comparison with MGMT protein expression[J].J Clin Pathol,2009,62(8)∶715-723.
[10] Hiraga J,Kinoshita T,Ohno T,et al.Promoter hypermethylation of the DNA-repair gene O6-methylguanine-DNA methyltransferase and p53 mutation in diffuse large B-cell lymphoma[J].Int J Hematol,2006,84(3)∶248-255.
[11] Lee SM,Lee EJ,Ko YH,et al.Prognostic significance of O6-methylguanine DNA methyltransferase and p57 methylation in patients with diffuse large B-cell lymphomas[J].APMIS,2009,117(2)∶87-94.
