磁共振扩散加权成像在鉴别鼻咽癌放疗后鼻咽坏死与复发中的价值
2011-08-01杨百华徐鹭英姚逸琦吴君心
杨百华 陈 英 徐鹭英 姚逸琦 吴君心
鼻咽坏死是鼻咽癌放疗后严重的并发症之一,而鼻咽癌经首程根治性放射治疗后,仍有7% ~21%的复发率[1],两者在临床上均可出现头痛、鼻咽出血等症状,常规MRI检查都可以表现为鼻咽部不规则强化以及不同程度的周围软组织水肿征象,因此,常导致鉴别诊断困难。水分子扩散是人体内一个重要的生物物理现象,体内水分子扩散的异常变化反映某些病理生理状态[2]。磁共振扩散加权成像(diffusion weighted imaging,DWI)可以进行活体水分子扩散成像,为水分子扩散的定量研究提供了可能。本文旨在通过测量鼻咽癌放疗后鼻咽坏死组织的ADC值,以研究放射性鼻咽坏死水分子的扩散情况,并与鼻咽癌复发病灶进行对照,探讨其在鉴别鼻咽坏死与复发中的应用价值。
1 资料和方法
1.1 一般资料
1.1.1 放疗后鼻咽坏死组 收集我院2008年7月至2010年12月鼻咽癌放疗后鼻咽坏死患者35例,其中男26例,女9例,年龄30~70岁,平均(52.7±1.4)岁。临床表现包括头痛、鼻咽出血以及恶臭等,其中头痛33例、鼻咽出血9例,27例伴有鼻咽不同程度的细菌感染症状。鼻咽坏死症状一般出现在末次放疗后2~86个月,平均(10.2±3.2)个月。全组均行鼻咽MRI常规扫描及扩散加权成像检查,并于MRI检查后3~7d经病理活检证实为鼻咽坏死且排除复发者。
1.1.2 鼻咽癌放疗后复发组 同期随机选取鼻咽癌放疗后肿瘤复发患者35例,男25例,女10例,年龄30~65岁,平均(47.6±1.3)岁。12例有不同程度的头痛,血涕25例,14例有脑神经受累而出现相应面麻、口角歪斜、复视等症状。全组患者均行鼻咽镜检查和MRI常规扫描及扩散加权成像,且经鼻咽活检病理确诊为复发,皆为低分化鳞状细胞癌者。见表1。
1.2 检查方法
1.2.1 仪器与方法 全部患者均使用超导型磁共振成像仪(Signa 1.5T Excite III HD,美国GE公司)和头颈联合表面线圈进行常规平扫、DWI及增强扫描检查。常规平扫序列包括轴位 FSE T1FLAIR、PDWI、DWI(b=0s/mm2及 b=800s/mm2)。扫描参数:T1FLAIR TR 1 800ms,TE 25ms、TI 750ms;PDWI TR 3 600ms、TE 118ms;DWI(SE EPI)TR 6 000ms、TE 61.7ms。层厚5mm,层间距1mm,矩阵288×288,增强扫描选用钆喷酸葡胺(Gd-DTPA),手背静脉注射,注射速率 1.0ml/s,剂量为 0.1mmol/kg,均行 SE序列 T1WI轴位及冠状位扫描,TR 560ms、TE 20ms,层厚5mm,层间距1mm,矩阵192×288,部分患者加扫矢状位。
1.2.2 图像及数据处理 所有DWI图像用Functool 2分析软件进行图像分析。依据ADC图并结合常规MRI及增强图像,在对应DWI图上,以病灶最大层面为中心的上下2~3个层面选择3个感兴趣区(ROI);采用适形勾画测量,尽量包括病变区,避开囊变区、粘液滞留区及有伪影区域,测得三组ADC值,取其平均值列入统计。
1.3 统计学处理
用SPSS 17.0软件将鼻咽癌放疗后鼻咽坏死与复发的ADC值进行比较,检验前先行方差齐性检验,根据两者方差齐同与否,采用独立样本t检验或近似t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 放疗后鼻咽坏死在常规MRI可表现为鼻咽周围软组织结构的缺失,鼻咽的坏死组织在T1对比增强图像上不能被强化或周围不规则强化,T1WI低信号、T2WI高或稍高信号,在PDWI上呈现高信号,在DWI上常表现为不均匀的低信号,然而,伴有咽旁感染(n=27)可表现为不规则的稍高信号。见图1的①~④。
2.2 鼻咽癌放疗后复发表现为残留的鼻咽部异常信号影的扩大或出现新的异常信号影,复发灶呈现T1WI低信号、T2WI为中等或稍高信号以及T1增强扫描呈不同程度的强化,DWI图像上通常表现为高信号。见图1的⑤~⑧。
2.3 计算所有感兴趣区的平均ADC值,放疗后鼻咽坏死组ADC最小值和最大值分别为(0.468±0.0580)×10-3mm2/s和(1.728±0.0527)×10-3mm2/s,平均值为(1.073±0.0383)×10-3mm2/s;放疗后鼻咽癌复发组ADC最小值及最大值分别为(0.372±0.0456)×10-3mm2/s和(1.477±0.0675)×10-3mm2/s,平均值为(0.844±0.0309)×10-3mm2/s。两组的ADC均值及最大值经t检验结果示坏死组大于复发组,两组间差异有统计学意义 (t1=4.645,P<0.001;t2=2.932,P<0.005)。见图2。
表1 两组患者一般资料及ADC值()
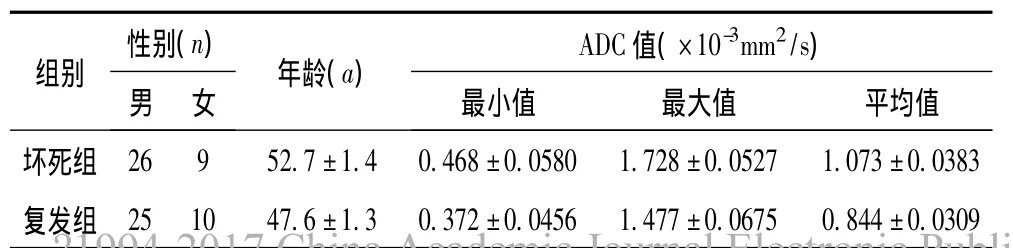
表1 两组患者一般资料及ADC值()
性别(n)ADC值(×10-3mm2/s)组别 年龄(a)最小值 最大值 平均值坏死组 26 9 52.7±1.4 0.468±0.0580 1.728±0.0527 1.07男 女3±0.0383复发组 25 10 47.6±1.3 0.372±0.0456 1.477±0.0675 0.844±0.0309
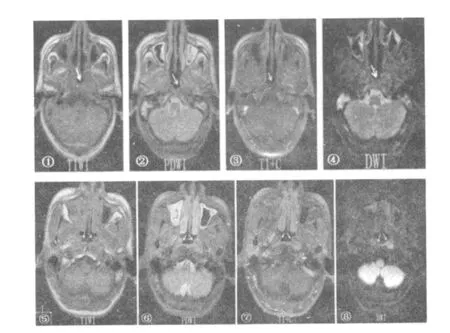
图1 鼻咽坏死与复发的MRI表现

图2 坏死组与复发组的ADC值比较
3 讨论
放疗后鼻咽坏死的机制是放疗后造成局部组织低供血、低供氧和微循环障碍,从而影响胶原蛋白和细胞的再生,导致局部组织坏死。大多学者认为放射、创伤和感染是放射性鼻咽坏死发病的三个要素[3]。鼻咽癌放疗后的患者,鼻咽部通常积聚大量的痂块和坏死分泌物,尤其是合并感染的时候,黏膜充血、糜烂、粗糙,加上原发病灶放疗后的瘢痕增生,常使鼻咽部发生变形,与鼻咽癌放疗后复发表现相类似;鼻咽坏死与鼻咽肿瘤复发在T1WI常表现为与肌肉相等的信号,两者无明显区别;由于放疗后复发或坏死病灶组织成分不均一,故均可表现为T2WI上高或稍高信号及T1增强扫描的不规则强化,导致二者鉴别诊断相对困难。
DWI能探测到组织内微弱的水分子的扩散活动,在病理情况下,细胞内外的大分子分布发生变化以及膜结构的完整性遭到破坏,使其中水分子的扩散速度发生改变,从而形成DWI上信号异常[4]。分子扩散受许多因素影响(如血流、脑脊液流动和细胞膜等),常用ADC值来描述活体内水分子的扩散状况,一般至少需要获得两幅不同b值的DWI图像,才能计算ADC值[5]。本研究选择b=Os/mm2和b=800s/mm2,实践应用证明,b=800s/mm2时图像信噪比较低,且能真实地反映组织的实际扩散系数。
本研究DWI显示鼻咽坏死表现为ADC值较高,而鼻咽癌复发则ADC值较低。关于鼻咽癌实性瘤灶的水分子扩散研究,Sugahara等[6]早已报道鼻咽癌病灶在DWI上呈高信号,ADC值较低。放疗后复发肿瘤细胞的迅速增殖,细胞密度增高,细胞外间隙缩小,同时因细胞生物膜的限制和大分子物质对水分子吸附作用增强等因素的综合作用,限制了恶性肿瘤水分子的扩散,导致其ADC值低。陈韵彬等报道鼻咽癌病灶ADC值降低的机制可能与鼻咽癌细胞体积大、排列紧密及细胞间隙变小等导致水分子扩散受限有关;也可能与鼻咽癌细胞膜上的钠-钾泵功能减退而导致细胞水肿等相联系[7]。DWI依靠实性肿瘤的细胞密度、细胞外间隙及组织结构来判断其组织学特点,当细胞密度增加时,细胞外间隙变窄,水分子扩散受限,ADC值降低;然而,对于肿瘤组织坏死,由于坏死区的细胞膜破裂,其内水分子的扩散比存活的肿瘤区明显增强,DWI上一般显示为低信号,其ADC值增高[8~10]。Zeng 等[8]通过联合磁共振波谱分析及扩散成像来鉴别脑胶质瘤复发及放射性坏死,其中坏死组与复发组的平均ADC值为1.39×10-3mm2/s和1.20×10-3mm2/s,两者差异有统计学意义;Hein 等[9]报道了应用ADC值及ADC比率鉴别诊断脑胶质瘤复发与放射性脑损伤,研究表明:复发组平均ADC值明显低于放射性损伤组,分别为(1.18±0.13)×10-3mm2/s和 (1.40±0.17)×10-3mm2/s,P<0.006;Chiaki等[10]报道了DWI是鉴别脑部肿瘤复发和放疗后坏死的有效方法,坏死组和复发组的最大ADC值分别为 (2.30±0.73)×10-3mm2/s和(1.68 ±0.37)×10-3mm2/s,两组差异有统计学意义。本文研究结果与上述研究结果相符,即鼻咽坏死组ADC平均值和最大值均明显高于复发组。
鼻咽癌放疗后鼻咽坏死常伴发咽旁感染。由于放疗后鼻咽的自清洁功能下降,导致局部分泌物及痂皮不能及时清除,附着在鼻咽部易导致细菌感染,加重形成了黏膜的慢性溃疡和经久不愈的坏死。溃疡一旦形成后,则难以愈合,极易造成细菌反复感染,炎症逐渐浸润至咽旁区或颅底,放射性纤维化与肉芽肿样增生同时并存时,形成影像学上的肿块和复发假象[11]。相关报道指出DWI图像上坏死灶也可表现出不均匀高信号,ADC值降低,考虑与其理化特性相关;坏死区内大量炎性细胞、细菌、坏死组织及蛋白分泌物等黏稠物质,高黏稠度使坏死区内水分子扩散受限,从而在 DWI表现出高信号及 ADC值降低[10,12~14]。本文坏死组中有 16例 ADC 均值小于 1×10-3mm2/s,DWI上表现为不同强度的高信号,虽然坏死组ADC均值与最大值高于复发组,但坏死组或复发组的ADC值仍存在一定的交叉,故该技术仍需结合常规MR序列进一步鉴别诊断。Pruzincova等[15]及 Hakyemez等[16]均报道了炎症、感染或出血的组织在DWI上可表现为均匀或不均匀的高信号区;认为坏死灶在DWI上的表现特异性不足,ADC值的量化检测不能应用于所有坏死相关研究。因此,通过DWI及ADC值鉴别诊断鼻咽坏死和复发的特异性与有效性值得商榷,仍需进一步扩大病例研究以确定ADC值的诊断阈值。鼻咽部组织活检病理才是鉴别复发和坏死的金标准。
总之,DWI可以显示坏死或肿瘤的病灶及范围,结合ADC值的测量,对于鉴别放疗后鼻咽坏死或复发的早期诊断有一定意义,以提示早期介入干预性治疗,减缓坏死或复发进程;鼻咽镜病理检查的同时结合MRI扫描、DWI和ADC值测量,尤其ADC值可反映病变本身及内容物的细微变化,可为临床提供更多关于病变部位的解剖及理化信息。
4 结论
放疗后鼻咽坏死在DWI上通常表现为不均匀低信号;鼻咽坏死组ADC均值及最大值均明显高于复发组,因此,DWI以及ADC值测量在鼻咽癌放疗肿瘤复发与鼻咽坏死鉴别诊断中具有重要作用,可作为常规MR序列的重要补充。
[1] 高 黎,易俊林,黄晓东,等.鼻咽癌根治性放疗10年经验总结[J].中华放射肿瘤学杂志,2006,15(4)∶249-256.
[2] Schaefer PW.Applications of DWI in clinical neurology[J].J Neurol Sci,2001,186(Suppl 1)∶S25-S35.
[3] Hao SP,Chen HC,Wei FC,et al.Systematic management of osteoradionecrosis in the head and neck[J].Laryngoscope,1999,109(8)∶1324-1328.
[4] Sadehi N,Camby I,Goldman S,et al.Effect of hydrophilic components of the extracellular matrix on quantifiable-diffusion-weighted imaging of human gliomas preliminary results of correlating apparent diffusion coefficient values and hyaluronan expression level[J].AJR,2003,181(7)∶235-241.
[5] Armstrong CL,Hunter JV,Hackney D,et al.MRI changes due to early-delayed conformal radiotherapy and postsurgical effects in patients with brain tumors[J].Int J Radiat Oncol Biol Phys,2005,63(1)∶56-63.
[6] Sugahara T,Korogi Y,Koehi M,et al.Usefulness of diffusion weighted MRI with echo-planar technique in the evaluation of cellularity in gliomas[J].J Magn Reson imaging,1999,9∶53-60.
[7] 陈韵彬,毛 瑜,潘建基,等.鼻咽癌扩散加权成像临床研究[J].中华放射肿瘤学杂志,2009,18(2)∶88-91.
[8] Zeng QS,Li CF,Liu H,et al.Distinction between recurrent glioma and radiation injury sing magnetic resonance spectroscopy in combination with diffusionweighted imaging[J].Int J Radiation Oncology Biol Phys,2007,68(1)∶l51-158.
[9] Hein PA,Eskey CJ,Dunn JF,et al.Diffusion-Weighted Imaging in the followup of treated high-grade Gliomas:tumor recurrence versus radiation injury[J].AJNR Am J Neuroradiol,2004,25∶201-209.
[10] Chiaki A,Yukunori K,Mika K,et al.Diffusion-Weighted Imaging of radiation-induced brain injury for differentiation from tumor recurrence[J].AJNR Am J Neuroradiol,2005,26∶1455-1460.
[11] 张 宁,卫光宇,曾晓红,等.40例鼻咽癌高剂量放疗后咽旁感染临床特点分析[J].中国肿瘤临床与康复,2010,17(2)∶160-163.
[12] Tung GA,Evangelista P,Rogg JM,et al.Diffusion-weighted MR imaging of rim-enhancing brain masses:is markedly decreased water diffusion specific for brain abscess?[J].AJR,2001,177∶709-712.
[13] Asao CH,Korogi Y,Kitajima M,et al.Diffusion weighted imaging of radiation-induced brain injury for differentiation from tumor recurrence [J].AJNR,2005,26∶1455-1460.
[14] Ebisu T,Tanaka C,Umeda M,et al.Discrimination of brain abscess from necrotic or cystic tumors by echo planar imaging[J].Magn Reson Imaging,1996,14∶1113-1116.
[15] Pruzincova L,Steno J,Srbecky M,et al.MR imaging of late radiation therapyand chemotherapy-induced injury:a pictorial essay[J].Eur Radiol,2009,19∶2716-2727.
[16] Hakyemez B,Erdogan C,Yildirim N,et al.Glioblastoma multiforme with atypical diffusion-weighted MR findings[J].Br J Radiol,2005,78∶989-992.
